Натрий (а, точнее, его соединения) использовался с давних времён. Например, сода (натрон), встречающаяся в природе в водах натронных озёр в Египте. Природную соду древние египтяне использовали для бальзамирования, отбеливания холста, при варке пищи, изготовлении красок и глазурей. Плиний Старший пишет, что в дельте Нила соду (в ней была достаточная доля примесей) выделяли из речной воды. Она поступала в продажу в виде крупных кусков, из-за примеси угля окрашенных в серый или даже чёрный цвет.
Натрий впервые был получен английским химиком Хемфри Дэви в 1807 году электролизом твердого NaOH.
Название «натрий» (natrium) происходит от араб. натрун(по-гречески — nitron). Первоначально оно относилось к природной соде.
Получение [ ]
Первым способом получения натрия стала реакция восстановления карбоната натрия углем при нагревании тесной смеси этих веществ в железной ёмкости до 1000°C:
Затем появился другой способ получения натрия — электролиз расплава едкого натра или хлорида натрия.
Избыток и дефицит натрия в организме | Роль натрия в организме человека | ПРО #МИКРОЭЛЕМЕНТЫ
Физические свойства [ ]
Металлический натрий сохраняемый в ксилоле
Химические свойства [ ]
Щелочной металл, на воздухе легко окисляется. Для защиты от кислорода воздуха хранят металлический натрий под слоем керосина.
Применение [ ]
Металлический натрий широко используется в препаративной химии и промышленности как сильный восстановитель, в том числе в металлургии. Натрий используется в производстве весьма энергоемких натриево-серных аккумуляторах . Изредка металлический натрий применяется в качестве материала для электрических проводов, предназначенных для очень больших токов.
В сплаве с калием, а так же с рубидием и цезием используется в качестве высокоэффективного теплоносителя, в частности сплав состава натрий 12%, калий 47%, цезий 41% имеет рекордно низкую температуру плавления -78°С, и предложен в качестве рабочего тела ионных ракетных двигателей и теплоносителя для атомных энергоустановок.
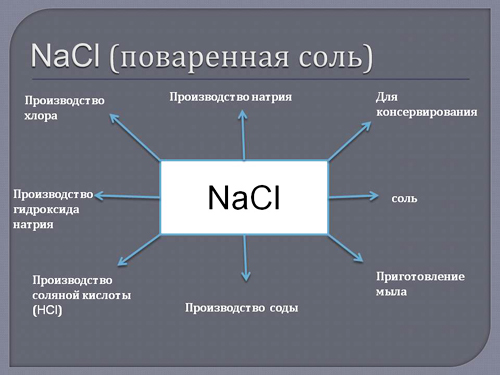
Хлорид натрия (поваренная соль) — древнейшее применяемое вкусовое и консервирующее средство.
Азид натрия применяется в качестве азотирующего средства в металлургии и при получении азида свинца.
Цианид натрия применяется при гидрометаллургическом способе выщелачивания золота из горных пород, а так же при нитроцементации стали и в гальванотехнике (серебрение, золочение).
Хлорат натрия применяется для уничтожения нежелательной растительности на железнодорожном полотне.
Биологическая роль [ ]
В организме находится только в виде солей. Отвечает за поддержание осмотического давления всех тканей и клеток организма. Участвует в образовании потенциала действия нервных клеток ( См. также [ ]
Ссылки [ ]
- Натрий на Webelements
- Натрий в Популярной библиотеке химических элементов
- WWW.WIKIZNANIE.RU — Викизнание — свободная беcплатная энциклопедия, использующая wiki-технологию
- «Натрий»- статья в Физической энциклопедии
| H | He | ||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe |
| Cs | Ba | * | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | ** | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Uub | Uut | Uuq | Uup | Uuh | Uus | Uuo |
| * | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | ||
| ** | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr |
Роль натрия в организме ► Что происходит с организмом при нехватке натрия?🤔
| Это незавершённая статья о химическом элементе. Вы можете помочь проекту, исправив и дополнив её. |
bs:Natrijum co:Sodiu es:Sodio et:Naatrium io:Natro is:Natrín it:Sodio ku:Sodyûm nov:Natrium pl:Sód ro:Sodiu sq:Natriumi vi:Natri
Источник: science.fandom.com
Натрий
На́трий(лат. Natrium), Na, химический элемент I группы короткой формы (1-й группы длинной формы) периодической системы ; атомный номер 11; атомная масса 22,98976928; относится к щелочным металлам . В природе один стабильный изотоп 23 Na. Искусственно получены радиоизотопы с массовыми числами 17–35.
Историческая справка
Природные соединения натрия известны с древних времён. В эпоху неолита , приблизительно 5–7 тыс. лет назад, в качестве компонента пищи людей вошла в употребление поваренная соль ( хлорид натрия ) NaCl. В Древнем Египте применяли природную соду ( карбонат натрия ) Na2CO3как моющее средство, а также для варки стекла . К началу 18 в. в Западной Европе соли натрия широко применялись в медицине, при выделке кож, крашении тканей. В 1807 г. Г. Дэви электролизом расплава едкого натра NaOH впервые получил расплавленный металлический натрий и дал ему название «содиум» (sodium, от позднелат. soda – сода), которое отражает происхождение этого элемента из соды; название сохранилось в США, Великобритании и некоторых других странах. Название «натрий», происходящее от арабского «натрун» (греч. νίτρον) и первоначально относившееся к природной соде, предложено Й. Берцелиусом в 1811 г. и введено в отечественную химическую номенклатуру Г. И. Гессом в 1831 г.
Распространённость в природе

Минерал улексит, борат натрия. Округ Керн (штат Калифорния). Минерал улексит, борат натрия. Округ Керн (штат Калифорния).
Свойства
Конфигурация внешней электронной оболочки атома натрия 3s 1 ; в соединениях проявляет степень окисления +1; энергии ионизации Na 0 →Na + 495,8 кДж/моль; электроотрицательность по Полингу 0,93; атомный радиус 180 пм, радиус иона Na + 116 пм ( координационное число 6).
Натрий – металл высокой химической активности (хранят под слоем инертной обезвоженной и не содержащей кислорода жидкости – керосина , минеральные масла ; перевозят в запаянных металлических сосудах). В реакциях с различными соединениями (оксидами, галогенидами и пр.) ведёт себя как сильный восстановитель . На воздухе активно окисляется с поверхности, в жидком состоянии при температуре выше 200 °С загорается.
В зависимости от условий может окисляться до оксида Na2O или пероксида Na2O2. Энергично реагирует с водой с образованием гидроксида NaOH и H2, за счёт выделяющейся энергии Na плавится; при большой поверхности контакта реакция происходит со взрывом. Натрий воспламеняется в атмосфере фтора , в атмосфере хлора горит при комнатной температуре, с бромом реагирует лишь при нагревании. Энергично взаимодействует с S, Se и Te, образуя халькогениды состава Na2X, NaX, NaX2, Na2X5.
Благородные газы незначительно растворимы в твёрдом и жидком натрии, при температуре 200 °C металл начинает поглощать H2, образуя гидрид NaH. С азотом в электрическом разряде даёт нитрид Na3N или азид NaN3, с разбавленными кислотами – соли.
В жидком NH3легко растворяется, образуя раствор синего цвета с металлической проводимостью, содержащий катионы Na + и сольватированные электроны. Взаимодействием с NH3при 300–400 °C или в присутствии катализатора при охлаждении до –30 °C получают амид NaNH2. При 800–900 °C газообразный натрий реагирует с углеродом , образуя карбид (ацетиленид) Na2C2. Реакцией натрия с ацетиленом при 98 °С получают NaCCH и этилен , при более высоких температурах – Na2C2. С графитом натрий образует соединения включения. Натрий реагирует с донорами протонов ( спиртами , карбоновыми кислотами и др.), давая производные со связью C─O─Na (например, натриевые соли высших жирных кислот – мыла́ ). Входит в состав натрийорганических соединений .
Со многими металлами (Ag, Au, Cd, Ga, Tl, Sn, Pb, Sb, Bi, K, Cs) образует интерметаллиды ; не образует соединений с Ba, Sr, Mg, Li, Zn, Al. C ртутью даёт амальгамы – интерметаллиды состава NaHg2, NaHg, Na3Hg2и др. (наибольшее значение имеют жидкие амальгамы).
При работе с натрием необходимо учитывать его высокую реакционную способность, в том числе способность загораться при контакте с водой. Натрий разъедает кожу, вызывает ожоги . В целях безопасности необходимо использовать резиновые перчатки, защитные очки или маску. С большим количеством натрия следует работать в специальных камерах, в инертной атмосфере ( аргон , азот ). Для тушения горящего натрия применяют поваренную соль, песок .
Получение
Натрий получают: электролизом расплава NaCl или расплава NaOH (с добавками других солей для снижения температуры плавления электролита ); небольшие количества – разложением азида NaN3. Электролиз NaCl проводят в электролизёрах с диафрагмой. Мировое производство натрия превышает 200 тыс. т/год (2012).
Применение
Натрий и его сплавы с калием применяются как жидкие теплоносители в ядерных реакторах ; пары́ натрия используются для наполнения газоразрядных ламп; сплавы натрия со свинцом – для изготовления подшипников . Натрий применяется как модификатор алюминиевых и других сплавов, как восстановитель в металлургии , в органическом синтезе , для получения соединений натрия, как катализатор в производстве бутадиенового и других каучуков. Амальгама Na используется при получении NaOH высокой чистоты. Радиоизотопы 22 Na и 24 Na применяются в медицине (диагностика, лечение лейкемии) и в качестве радиоактивных меток .
Аликберова Людмила Юрьевна . Первая публикация: Большая российская энциклопедия, 2013.
в 17:21 (GMT+3) Обратная связь
Информация

Области знаний: Общие вопросы химии Символ: Na Атомный номер: 11 Группа элементов: Щелочные металлы Относительная атомная масса: 22,98976928 а. е. м. Радиус атома: 180 пм Электроотрицательность: 0,93 ед. по шкале Полинга Агрегатное состояние: Твёрдое Плотность при н. у.: 0,971 г/см³ Температура плавления: 97,7 °C Температура кипения: 883 °C
Источник: bigenc.ru
Натрий (Na, Natrium)
Натрий в чистом виде получил в 1807 году Хемфри Дэви – английский химик, который незадолго до натрия открыл калий. Дэви проводил процесс электролиза одного из соединений натрия – гидроксида, расплавив который и получил натрий. Соединениями натрия человечество пользовалось со времён глубокой древности, содой природного происхождения пользовались ещё в Древнем Египте (calorizator). Называли элемент содий (sodium), иногда именно это название можно встретить даже сейчас. Привычное название натрий (от латинского natrium– сода) было предложено шведом Йенсом Берцелиусом.
Общая характеристика натрия
Натрий является элементом I группы III третьего периода периодической системы химических элементов Д.И. Менделеева, имеет атомный номер 11 и атомную массу 22,99. Принятое обозначение – Na(от латинского natrium).

Нахождение в природе
Соединения натрия содержатся в земной коре, морской воде, в виде примеси, имеющей свойство окрашивать каменную соль в синий цвет из-за действия радиации.
Физические и химические свойства
Натрий является мягким пластичным щелочным металлом, имеет серебристо-белый цвет и блеск на свежем срезе (натрий вполне возможно разрезать ножом). При применении давления превращается в прозрачное вещество красного цвета, при обычной температуре кристаллизуется. При взаимодействии с воздухом быстро окисляется, поэтому хранить натрий необходимо под слоем керосина.

Суточная потребность в натрии
Натрий – важный для организма человека микроэлемент, суточная потребность в нём для взрослых составляет 550 мг, для детей и подростков – 500-1300 мг. В период беременности норма натрия в сутки составляет 500 мг, а в некоторых случаях (обильное потоотделение, обезвоживание, приём мочегонных препаратов) должна быть увеличена.
Продукты питания богатые натрием
Натрий содержится практически во всех морепродуктах (раках, крабах, осьминогах, кальмарах, мидиях, морской капусте), рыбе (анчоусах, сардинах, камбале, корюшке и т.д.), куриных яйцах, крупах (гречневой, рисе, перловой, овсяной, пшённой), бобовых (горохе, фасоли), овощах (томатах, сельдерее, моркови, капусте, свёкле), молочных продуктах и мясных субпродуктах.

Полезные свойства натрия и его влияние на организм
Полезными для организма свойствами натрия являются:
- Нормализация водно-солевого обмена;
- Активизация ферментов слюнной и поджелудочной желез;
- Участие в выработке желудочного сока;
- Поддержание нормального кислотно-щелочного баланса;
- Генерирование функций нервной и мышечной системы;
- Сосудорасширяющее действие;
- Поддержание осмотической концентрации крови.
Усвояемость натрия
Натрий содержится практически во всех продуктах, хотя большую его часть (около 80%) организм получает из поваренной соли. Усвоение в основном происходит в желудке и тонком кишечнике. Витамин D улучшает усвоение натрия, однако, чрезмерно соленая пища и пища богатая белками препятствуют нормальному всасыванию.
Взаимодействие с другими
Повышенное потребление натрия вызывает накопление жидкости в организме, отеки, повышает кровяное давление. Большой прием натрия (соли) приведет к истощению запасов калия, кальция и магния.
Применение натрия в жизни
Применение металлического натрия – химическая и металлургическая промышленность, где он выступает в роли сильнейшего восстановителя. Хлоридом натрия (поваренной солью) пользуются все без исключения жители нашей планеты, это самое известное вкусовое средство и древнейший консервант.
Признаки нехватки натрия
Нехватка натрия обычно случается при чрезмерном потоотделении – в жарком климате или при физических нагрузках. Недостаток натрия в организме характеризуется ухудшением памяти и потерей аппетита, головокружением, быстрой утомляемостью, обезвоживанием, мышечной слабостью, а иногда – судорогами, кожными высыпаниями, желудочными спазмами, тошнотой, рвотой.
Признаки избытка натрия
Излишнее количество натрия в организме даёт о себе знать постоянной жаждой, отёками и аллергическими реакциями.
Источник: calorizator.ru