Описание: бесцветные прозрачные кристаллы или мелкокристаллический порошок без запаха. На воздухе выветривается, водный раствор имеет кислую реакцию.
Растворимость: очень легко растворим в воде, практически нерастворим в спирте. Растворим в 10 частях глицерина.
1) При взаимодействии с сульфидом натрия выпадает белый осадок, нерастворим в уксусной кислоте (р), легко растворим в НСl.
2) С гексацианоферратом калия дает белый аморфный студенистый осадок, нерастворимый в HCl.
3) Сульфат с солью бария дает белый осадок, нерастворимый в минер. кислотах
Допустимые примеси: хлориды, мышьяк.
Недопустимые примеси: нитраты, алюминий, железо, медь, магний, кальций.
Количественное определение: Прямая комплексонометрия. Титрант: трилон Б,pH=9,5-10. Инд – кислотный хром черный специальный.
Хранение: Список Б. В хорошо упакованной таре.
Применение: Антисептик и вяжущее.
Zinci oxydum – окись цинка – ZnO
Описание: белый или белый с желтоватым оттенком аморфный порошок без запаха. Поглощает СО2воздуха.
Реакция ХЛОРИДА ЦИНКА и ХРОМАТА НАТРИЯ. Реакция ХРОМАТА ЦИНКА. Опыты по химии.
Растворимость: практически нерастворим в воде и спирте, растворим в растворах щелочей, разв. минеральных кислотах, уксусной кислоте.
Подлинность: при прокаливании окрашивается в желтый цвет., при охлаждении снова белеет.
Допустимые примеси: мышьяк.
Недопустимые примеси: карбонаты и нер-мые примеси железа, меди, алюминия, свинца.
Количественное определение: Прямая комплексонометрия после растворения в соляной кислоте и нейтрализации раствором аммиака. Титрант: трилон Б,pH=9,5-10. Инд – кислотный хром черный специальный.
Хранение: в хорошо упакованной таре
Применение: вяжущее, подсушивающее, дезинфицирующее, при кожных заболеваниях.
Bismuthi subnitras – висмута нитрат основной.
Описание: белый аморфный или микрокристаллический прошок. Смоченный водой окрашивает синюю лакмусовую бумагу в красный цвет.
Растворимость: практически нерастворим в воде и спирте, легко растворим в азотной и соляной кислоте.
С сульфидом натрия выпадет коричнево-черный осадок, растворимый в концентрированной азотной кислоте.
С KIвыпадет черный осадок, растворимый в избыткеKI(образуется желто-оранжевый комплекс).

Bi 3+ + 3KIBiI3+ 3K + K[BiI4]
При прокаливании выделяются желто-бурые пары и остаток ярко-желтого цвета.

Висмута нитрат основной 2Bi2O3 + H2O + 2NO2 + O2
Допустимые примеси: хлориды щелочных и щелочно-земельных металлов, серебро.
Недопустимые примеси: CO3, NH4, Cu, Pb, SO4, As, Te
Количественноеопределение: прямая комплексонометрия. Индикатор: пирокатехиновый фиолетовый. рН=2-3 (HNO3). Титрант – трилон Б.

Вторая и третья стадии см. Магния сульфат.
Типы химических реакций
Расчет ведут по Bi2O3. Расчетная формула для прямого титрования без контрольного опыта.
Хранение: в хорошо упак. таре, предохр. от д-я света.
Применение: Вяжущее антисептическое при заболеваниях ЖКТ.
Соединения меди, серебра. Cupri sulfas – сульфат меди – CuSo4•5h2o
Описание: синие кристаллы или синий кристаллический порошок без запаха. Медленно выветривается на воздухе. Водный растворы имеют слабокислую реакцию.
Растворимость: легко растворим в воде. Очень легко в кипящей. Пр. нер-рим в 95%спирте.
1) Металлическая скрепка покрывается медным налетом.
Сu 2+ + Fe Fe 2+ + Cu
2) Ионы меди образуют синий комплекс с раствором аммиака.
3) Сульфаты с солями бария дают белый осадок, нерастворимый в минеральных кислотах.
Допустимые примеси: хлориды, железо, соли металлов, не осаждающихсяH2S
Количественное определение: косвенная йодометрия (нефармакопейно – прямая комплексонометрия с индикатором мурексидом)
2CuI2 2CuI + I2 осадок цвета слоновой кости

f(CuSO4) = 1/2
Хранение: список Б. В хорошо упакованной таре.
Применение: Антисептик, вяжущее, прижигающее, наружно, иногда внутрь (рвотное).
Источник: studfile.net
Тема I. Работа 5. Типы химических реакций. Вариант 4
1. Перепишите приведенные ниже схемы реакций, расставьте в них коэффициенты и укажите, к какому типу относится каждая из реакций. а) СH4 → С + H2 в) CuCl2 + Mg → MgCl2 + Cu б) NO + O2 → NO2 г) KCl3 → KCl + O2
2. Составьте уравнения реакций соединения: а) серебра с серой; б) цинка с серой, зная, что в образовавшихся веществах сера проявляет валентность, равную двум.
3. Из приведенных схем реакций выпишите только те, которые относятся к реакциям замещения. Вместо знаков вопроса напишите формулы соответствующих веществ и расставьте коэффициенты. а) Р + ? → Р2O5 в) H2O → ? + O2 б) Nal + ? → I2 + NaCl г) HBr + Zn → ZnBr2 + ?
Решения и ответы:
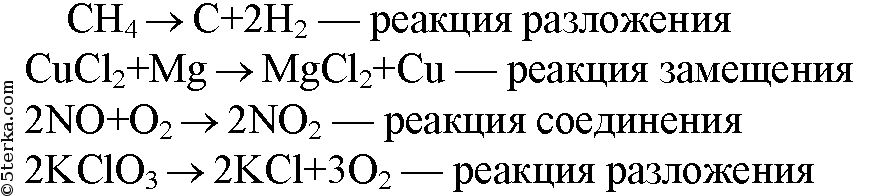
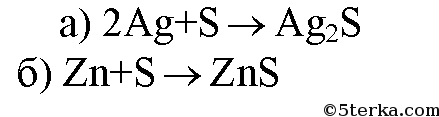
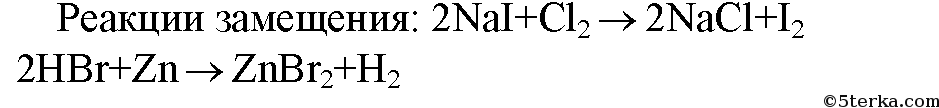
Источник:

Решебник по химии за 8 класс (А.М.Радецкий, 2011 год),
задача №4
к главе «Тема I. Первоначальные химические понятия. Работа 5. Типы химических реакций».
Источник: 5terka.com
Нитрат серебра цинк тип химической реакции
Внимание Скидка 50% на курсы! Спешите подать
заявку
Профессиональной переподготовки 30 курсов от 6900 руб.
Курсы для всех от 3000 руб. от 1500 руб.
Повышение квалификации 36 курсов от 1500 руб.
Лицензия №037267 от 17.03.2016 г.
выдана департаментом образования г. Москвы

Тест для 9 класса «Азот и его соединения»
Тест «Азот и его соединения»
1. Наиболее прочная молекула:
а) Н 2 ; б) F 2 ; в) О 2 ; г) N 2 .
2. Окраска фенолфталеина в растворе аммиака: а) малиновая; б) зеленая; в) желтая;
3. Степень окисления +3 у атома азота в соединении: а) NH 4 NO 3 ; б) NaNО 3 ; в) NО 2 ; г) КNO 2 .
4. При термическом разложении нитрата меди(II) образуются:
а) нитрит меди(II) и О 2 ;б) оксид азота(IV) и О 2 ;в) оксид меди(II), бурый газ NO 2 и О 2 ;
г) гидроксид меди(II), N 2 и О 2 .
5. Какой ион образован по донорно-акцепторному механизму?
а) NH 4 + ; б) NO 3 – ; в) Сl – ; г) SO 4 2– .
6. Укажите сильные электролиты:
а) азотная кислота; б) азотистая кислота; в) водный раствор аммиака; г) нитрат аммония.
7. Водород выделяется при взаимодействии:
а) Zn + HNO 3 (разб.);
в ) Al + NaOH + H 2 O;
г ) Zn + H 2 SO 4 ( разб .);
д) Fe + HNO 3 (конц.).
8. Составьте уравнение реакции цинка с очень разбавленной азотной кислотой, если один из продуктов реакции – нитрат аммония. Укажите коэффициент, стоящий перед окислителем.
9. Напишите уравнения реакций для следующих превращений:
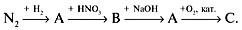
Дайте названия веществам А, В, С.
1. Cпособом вытеснения воды нельзя собрать:а) азот; б) водород; в) кислород; г) аммиак.
2. Реактивом на ион аммония служит раствор: а) сульфата калия; б) нитрата серебра;
в) гидроксида натрия; г) хлорида бария.
3. При взаимодействии НNО 3 (конц.) с медной стружкой образуется газ:
а) N 2 O; б) NН 3 ; в) NO 2 ; г) Н 2 .
4. При термическом разложении нитрата натрия образуется:
а) оксид натрия, бурый газ NO 2 , O 2 ; б) нитрит натрия и О 2 ;
в) натрий, бурый газ NO 2 , O 2 ;г) гидроксид натрия, N 2 , О 2 .
5. Cтепень окисления азота в сульфате аммония:
а) –3; б) –1; в) +1; г) +3.
6. С какими из указанных веществ реагирует концентрированная HNO 3 при обычных условиях?
а) NаОН; б) АgСl; в) Al; г) Fе; д) Сu.
7. Укажите число ионов в сокращенном ионном уравнении взаимодействия сульфата натрия и нитрата серебра:
а) 1; б) 2; в) 3; г) 4.
8. Составьте уравнение взаимодействия магния с разбавленной азотной кислотой, если один из продуктов реакции – простое вещество. Укажите коэффициент, стоящий в уравнении перед окислителем.
9. Напишите уравнения реакций для следующих превращений:
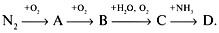
Дайте названия веществам А, В, С, D.
1 – г; 2 – а; 3 – г; 4 – в; 5 – а; 6 – а, г; 7 – в, г; 8 – 10,

9. А – NH 3 , B – NH 4 NO 3 , C – NO,
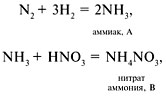
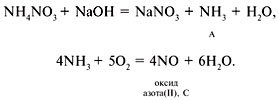
1 – г; 2 – в; 3 – в; 4 – б; 5 – а; 6 – а, д; 7 – в,
2Ag + + SO 4 2– = Ag 2 SO 4 ;
9. А – NO, B – NO 2 , C – HNO 3 , D – NH 4 NO 3 ,
Источник: doc4web.ru