Задание 7. К сильным электролитам относится каждое из двух веществ:
1) NaOH и С2Н5ОН
2) Са(ОН)2 и Н2СO3
3) AgNO3 и Ва(ОН)2
Распад вещества на ионы называется электролитической диссоциацией.
Электролитами называются вещества, молекулы которых в определенных условиях распадаются на ионы.
Для количественной оценки процесса диссоциации важное значение имеют степень диссоциации (α) и константа диссоциации (Кд).
Степень диссоциации – отношение числа молекул. Распавшихся на ионы, к общему числу молекул электролита, введенного в раствор:
По степени диссоциации в растворах с молярной концентрацией эквивалента равной 0,1 моль/л, все электролиты делятся на сильные и слабые.
Если степень диссоциации электролита больше 30%, электролит считается сильным, меньше 3% — слабым, 30-3 % — средней силы.
В растворах сильные электролиты полностью распадаются на ионы.
В растворах слабых электролитов процесс диссоциации протекает обратимо, ступенчато и продукты определяются, как правило, первой ступенью.
3. ЕГЭ по химии 2018 (варианты 5, 6)
Сильные электролиты: а) почти все соли; б) кислоты: НГ, НС1О4, НNО3, Н2SО4 и т. д. в) основания: S-элементов, кроме Ве(ОН)2 и Мg(ОН)2
Слабые электролиты: а) кислоты: НСlО, НС1О2, НNО2, Н2SО3, Н2S и т.д.; г) основания: р- и d-элементов, NН4ОН. (см. таблицу «Константы диссоциации некоторых слабых электролитов в водных растворах при 25 оС»).
Деление на сильные и слабые электролиты условный характер. Степень диссоциации зависит от природы растворителя и растворенного электролита, концентрации и других факторов.
1) NaOH и С2Н5ОН. Гидроксид натрия – сильный электролит:
Этиловый спирт – неэлектролит.
2) Са(ОН)2 и Н2СO3. Гидроксид кальция – сильный электролит:
Угольная кислота – слабая кислота:
3) AgNO3 и Ва(ОН)2. Нитрат серебра – соль, сильный электролит:
а гидроксид бария – сильное основание:
4) AlCl3 и H2S. Хлорид алюминия – соль, сильный электролит:
а сероводородная кислота – слабый электролит:
Источник: self-edu.ru
Теория электролитической диссоциации

Электролиты – это вещества, растворы и расплавы которых проводят электрический ток.
Электрический ток – это упорядоченное движение заряженных частиц под действием электрического поля. Таким образом, в растворах или расплавах электролитов есть заряженные частицы. В растворах электролитов, как правило, электрическая проводимость обусловлена наличием ионов.
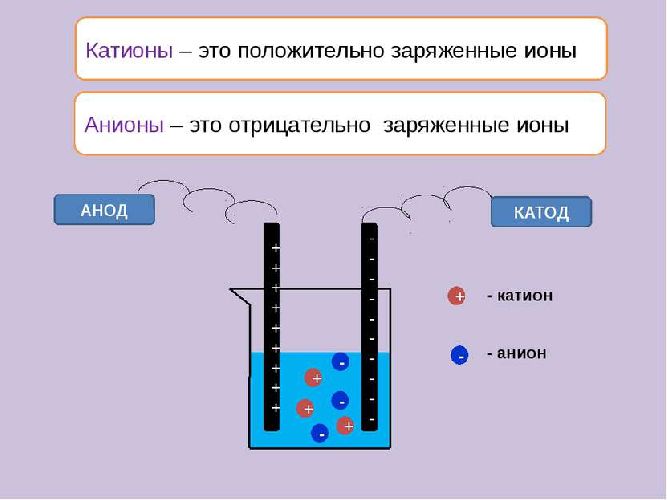
Ионы – это заряженные частицы (атомы или группы атомов). Разделяют положительно заряженные ионы (катионы) и отрицательно заряженные ионы (анионы).
Электролитическая диссоциация — это процесс распада электролита на ионы при его растворении или плавлении.
Разделяют вещества — электролиты и неэлектролиты. К неэлектролитам относятся вещества с прочной ковалентной неполярной связью (простые вещества), все оксиды (которые химически не взаимодействуют с водой), большинство органических веществ (кроме полярных соединений — карбоновых кислот, их солей, фенолов) — альдегиды, кетоны, углеводороды, углеводы.
Диссоциация. Сильные и слабые электролиты. Проводник второго рода. Химия – Просто
К электролитам относят некоторые вещества с ковалентной полярной связью и вещества с ионной кристаллической решеткой.
В чем же суть процесса электролитической диссоциации?
Поместим в пробирку несколько кристаллов хлорида натрия и добавим воду. Через некоторое время кристаллы растворятся. Что произошло?
Хлорид натрия – вещество с ионной кристаллической решеткой. Кристалл NaCl состоит из ионов Na + и Cl — . В воде этот кристалл распадается на структурные единицы-ионы. При этом распадаются ионные химические связи и некоторые водородные связи между молекулами воды. Попавшие в воду ионы Na + и Cl — вступают во взаимодействие с молекулами воды.
В случае хлорид-ионов можно говорить про электростатическое притяжение дипольных (полярных) молекул воды к аниону хлора, а в случае катионов натрия оно приближается по своей природе к донорно-акцепторному (когда электронная пара атома кислорода помещается на вакантные орбитали иона натрия). Окруженные молекулами воды ионы покрываются гидратной оболочкой. Диссоциация хлорида натрия описывается уравнением:
NaCl = Na + + Cl –

При растворении в воде соединений с ковалентной полярной связью, молекулы воды, окружив полярную молекулу, сначала растягивают связь в ней, увеличивая её полярность, затем разрывают её на ионы, которые гидратируются и равномерно распределяются в растворе. Например, соляная ксилота диссоциирует на ионы так: HCl = H + + Cl — .

При расплавлении, когда происходит нагревание кристалла, ионы начинают совершать интенсивные колебания в узлах кристаллической решётки, в результате чего она разрушается, образуется расплав, который состоит из ионов.
Процесс электролитической диссоциации характеризуется величиной степени диссоциации молекул вещества:
Степень диссоциации — это отношение числа продиссоциировавших (распавшихся) молекул к общему числу молекул электролита. Т.е., какая доля молекул исходного вещества распадается в растворе или расплаве на ионы.
Nпродисс — это число продиссоциировавших молекул,
Nисх — это исходное число молекул.
По степени диссоциации электролиты делят на делят на сильные и слабые.
Сильные электролиты (α≈1):
1. Все растворимые соли (в том числе соли органических кислот — ацетат калия CH3COOK, формиат натрия HCOONa и др.)
2. Сильные кислоты: HCl, HI, HBr, HNO3, H2SO4 (по первой ступени), HClO4 и др.;
3. Щелочи: NaOH, KOH, LiOH, RbOH, CsOH; Ca(OH)2, Sr(OH)2, Ba(OH)2.
Сильные электролиты распадаются на ионы практически полностью в водных растворах, но только в ненасыщенных. В насыщенных растворах даже сильные электролиты могут распадаться только частично. Т.е. степень диссоциации сильных электролитов α приблизительно равна 1 только для ненасыщенных растворов веществ. В насыщенных или концентрированны растворах степень диссоциации сильных электролитов может быть меньше или равна 1: α≤1.
Слабые электролиты (α <1):
1. Слабые кислоты, в т.ч. органические;
2. Нерастворимые основания и гидроксид аммония NH4OH;
3. Нерастворимые и некоторые малорастворимые соли (в зависимости от растворимости).
Неэлектролиты:
1. Оксиды, не взаимодействующие с водой (взаимодействующие с водой оксиды при растворении в воде вступают в химическую реакцию с образованием гидроксидов);
2. Простые вещества;
3. Большинство органических веществ со слабополярными или неполярными связями (альдегиды, кетоны, углеводороды и т.д.).

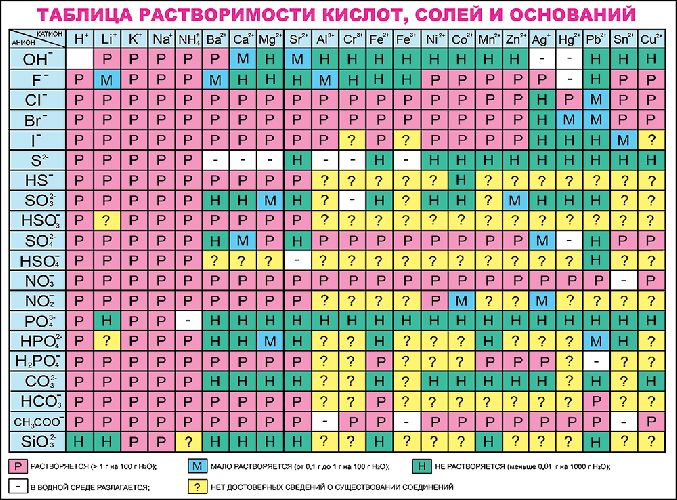
Как диссоциируют вещества? По степени диссоциации различают сильные и слабые электролиты.
Сильные электролиты диссоциируют полностью (в насыщенных растворах), в одну ступень, все молекулы распадаются на ионы, практически необратимо. Обратите внимание — при диссоциации в растворе образуются только устойчивые ионы. Самые распространенные ионы можно найти в таблице растворимости — это ваша официальная шпаргалка на любом экзамене. Степень диссоциации сильных электролитов примерно равна 1. Например, при диссоциации фосфата натрия образуются ионы Na + и PO4 3– :
Диссоциация слабых электролитов : многоосновных кислот и многокислотных оснований происходит ступенчато и обратимо. Т.е. при диссоциации слабых электролитов распадается на ионы только очень небольшая часть исходных частиц. Например, угольная кислота:
HCO3 – ↔ H + + CO3 2–
Гидроксид магния диссоциирует также в 2 ступени:
Mg(OH)2 ⇄ Mg(OH) + OH –
Mg(OH) + ⇄ Mg 2+ + OH –
Кислые соли диссоциируют также ступенчато, сначала разрываются ионные связи, затем — ковалентные полярные. Например, гидрокабонат калия и гидроксохлорид магния:
KHCO3 ⇄ K + + HCO3 – (α=1)
Mg(OH)Cl ⇄ MgOH + + Cl – (α=1)
MgOH + ⇄ Mg 2+ + OH – (α
Степень диссоциации слабых электролитов намного меньше 1: α
Основные положения теории электролитической диссоциации, таким образом:
1. При растворении в воде электролиты диссоциируют (распадаются) на ионы.
2. Причина диссоциации электролиты в воде – это его гидратация, т.е. взаимодействие с молекулами воды и разрыв химической связи в нем.
3. Под действием внешнего электрического поля положительно заряженные ионы двигаются к отрицательно заряженному электроду — катоду, их называют катионами. Отрицательно заряженные электроны двигаются к положительному электроду – аноду. Их называют анионами.
4. Электролитическая диссоциация происходит обратимо для слабых электролитов, и практически необратимо для сильных электролитов.
5. Электролиты могут в разной степени диссоциировать на ионы — в зависимости от внешних условий, концентрации и природы электролита.
6. Химические свойства ионов отличаются от свойств простых веществ. Химические свойства растворов электролитов определяются свойствами тех ионов, которые из него образуются при диссоциации.
Примеры .
1. При неполной диссоциации 1 моль соли общее количество положительных и отрицательных ионов в растворе составило 3,4 моль. Формула соли – а) K2S б) Ba(ClO3)2 в) NH4NO3 г) Fe(NO3)3
Решение: для начала определим силу электролитов. Это легко можно сделать по таблице растворимости. Все соли, приведенные в ответах — растворимые, т.е. сильные электролиты. Далее, запишем уравнения электролитической диссоциации и по уравнению определим максимально число ионов в каждом растворе:
а) K2S ⇄ 2K + + S 2– , при полном распаде 1 моль соли образуется 3 моль ионов, больше 3 моль ионов не получится никак;
б) Ba(ClO3)2 ⇄ Ba 2+ + 2ClO3 – , опять при распаде 1 моль соли образуется 3 моль ионов, больше 3 моль ионов не образуется никак;
в) NH4NO3 ⇄ NH4 + + NO3 – , при распаде 1 моль нитрата аммония образуется 2 моль ионов максимально, больше 2 моль ионов не образуется никак;
г) Fe(NO3)3 ⇄ Fe 3+ + 3NO3 – , при полном распаде 1 моль нитрата железа (III) образуется 4 моль ионов. Следовательно, при неполном распаде 1 моль нитрата железа возможно образование меньшего числа ионов (неполный распад возможен в насыщенном растворе соли). Следовательно, вариант 4 нам подходит.
Источник: chemege.ru
Сильные электролиты

Вещества, быстро распадающиеся на ионы в расплавах или растворах, называются сильными электролитами. К ним относятся растворимые соли, сильные кислоты и щёлочи.
Электролитическая диссоциация
Чтобы раствор или расплав проводил электрических ток, необходимо наличие заряженных частиц – ионов. Распадаются на ионы, т.е. подвергаются электролитической диссоциации вещества, содержащие полярные молекулы. Под действием молекул воды или высокой температуры разрушаются ковалентные полярные или ионные связи. В результате образуются катионы – положительно заряженные ионы и анионы – отрицательно заряженные ионы.
Реакция электролитической диссоциации записывается с помощью ионного уравнения:
- HCl → H + + Cl – ;
- КОН → К + + ОН – ;
- Na3PO4 → 3Na + + PO4 3- .
Скорость реакции и полнота разложения веществ зависит от степени диссоциации. Эта величина показывает, какая часть молекул от общего количества молекул вещества распалась на катионы и анионы. От степени диссоциации зависит, как поведёт себя вещество в растворе – растворится полностью или частично.
Степень диссоциации зависит он некоторых внешних факторов. Показатель степени можно увеличить с помощью повышения температуры. В кипящей воде электролит диссоциирует быстрее, молекулы активнее распадаются на ионы. А вот повышение концентрации вещества уменьшает степень диссоциации. Чем больше концентрация электролита, тем меньше действие растворителя и, следовательно, слабее диссоциация.
Степень диссоциации чаще всего выражают в процентах. Для вычисления степени диссоциации используется формула:
α = n / N ∙ 100 %,
- n – количество молекул, распавшихся на катионы и анионы;
- N – общее число молекул электролита.
Электролиты, молекулы которых быстро и необратимо распадаются на ионы, называются сильными электролитами.
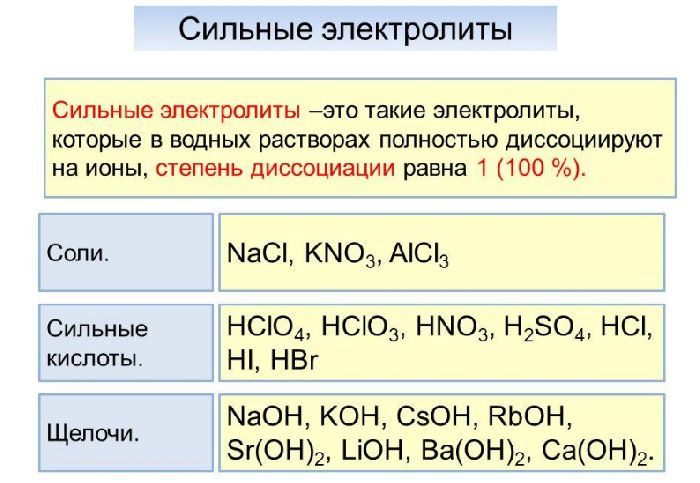
Сильные электролиты
Степень диссоциации сильных электролитов больше 0,3 или 30 %. Они диссоциируют практически полностью. Диссоциация в этом случае необратима.
Список сильных электролитов:
Са(NO3)2, Na2SO4, NaCl, K2S, AlBr3, Cr2(SO4)3;
HCl, HBr, HI, H2SO4, HNO3, HClO4, HMnO4;
KOH, RbOH, Ca(OH)2, Sr(OH)2.
Определить, какая соль относится к сильным электролитам, можно с помощью таблицы растворимости солей. Все растворимые в воде соли – сильные электролиты, малорастворимые и нерастворимые соли – слабые электролиты.
Что мы узнали?
Из урока химии узнали, что такое электролитическая диссоциация и какие электролиты относятся к сильным. Электролитическая диссоциация характеризуется степенью диссоциации. Чем выше степень диссоциации, тем больше распадается электролит. У сильных электролитов степень диссоциации больше 30 %. К ним относятся сильные неорганические кислоты, растворимые соли и щёлочи. На степень диссоциации могут влиять внешние факторы – температура, концентрация, давление.
Источник: obrazovaka.ru