Налейте в пробирку 1-2 мл раствора фосфата натрия или калия. С помощью пипетки добавьте к нему несколько капель раствора нитрата серебра. Что наблюдаете? Запишите молекулярное и ионное уравнения. Можно ли считать эту реакцию качественной на фосфат-ион?
Добавьте к содержимому пробирки азотную кислоту до растворения осадка. Почему это происходит?
При добавлении раствора нитрата серебра в раствор фосфата натрия, наблюдается выпадение желтого осадка:
Na3PO4 + 3AgNO3 ⟶ 3NaNO3 + Ag3PO4↓
3Na + + PO4 3- + 3Ag + + 3NO3 — ⟶ 3Na + + 3NO3 — + Ag3PO4↓
3Ag + + PO4 3- ⟶ Ag3PO4↓
При добавлении к осадку азотной кислоты происходит растворение осадка, т. к. азотная кислота (более сильная) вытеснят фосфорную кислоту из её соли:
Ag3PO4 + 3HNO3 ⟶ 3AgNO3 + H3PO4
Ag3PO4 + 3H + + 3NO3 — ⟶ 3Ag + + 3NO3 — + H + + H2PO4 —
Ag3PO4 + 2H + ⟶ 3Ag + + H2PO4 —
Источник: gomolog.ru
Проводим ЭКСПЕРИМЕНТ в ОГЭ по Химии — задание 24 | Умскул 2023
Как определить фосфат натрия
В школьном курсе химии приводятся описания целого ряда специфических химических реакций, позволяющих выявить то или иное соединение. Многие из них протекают с образованием веществ, имеющих красочные оттенки. К подобным относится и реакция, при помощи которой можно определить фосфат натрия.

Статьи по теме:
- Как определить фосфат натрия
- Как научиться писать формулу карбоната
- Почему фосфор светится
Вам понадобится
- — две пробирки;
- — дистиллированная вода;
- — нитрат серебра;
- — соль, предположительно являющаяся фосфатом натрия.
Инструкция
Подготовьте все, необходимое для эксперимента. На штативы установите две чистых пустых пробирки. Они должны быть достаточно широкими. Подготовьте емкость с дистиллированной водой. Желательно заранее налить ее в реторту.
Получите раствор исследуемой соли, если она находится в кристаллическом состоянии. Налейте небольшое количество дистиллированной воды в одну из пробирок. Затем поместите в нее немного кристаллов соли, предположительно являющейся фосфатом натрия. Извлеките пробирку из штатива и начните перемешивание жидкости, совершая ей круговые движения.
Дождитесь полного растворения кристаллов. Если вещество в пробирке не растворяется — это не фосфат натрия. После окончания процесса получения раствора установите пробирку обратно на штатив.
Приготовьте раствор нитрата серебра. Используйте свободную пробирку. Действуйте способом, аналогичным тому, что был описан в предыдущем шаге. Нитрат серебра, как и фосфат натрия, очень хорошо растворим в воде. Поэтому раствор нужной концентрации будет получен достаточно быстро.
Проведите реакцию определения содержания фосфата натрия в растворе исследуемой соли. Осторожно, тонкой струйкой влейте жидкость из второй пробирки в первую. При этом если в первой пробирке содержится действительно фосфат натрия, в ней почти мгновенно образуется желтый осадок. Это будет фосфат серебра, который практически нерастворим в воде. Протекающая реакция может быть описана следующим уравнением: 3АgNО3 + Nа3PО4 = 3NаNО3 + Аg3PО4.
Фосфат-ионы — КАЧЕСТВЕННАЯ РЕАКЦИЯ
Источник: www.kakprosto.ru
Вариант 2
1. Напишите уравнения реакций: а) фосфора с хлором; б) фосфора с магнием; в) раствора фосфата натрия с раствором нитрата серебра (в молекулярной и ионной формах).
2. Поясните, почему фосфор встречается в природе только в виде соединений, тогда как находящийся с ним в одной группе азот — главным образом в свободном виде.
3. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Ответы и решения:

2. Фосфор очень реакционноспособное вещество, а молекула азота устойчива и химически малоактивна
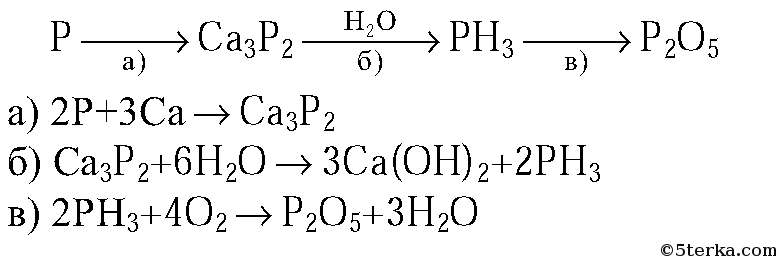
Источник:

Решебник по химии за 9 класс (А.М.Радецкий, 2011 год),
задача №2
к главе «Тема III. Подгруппа азота. Работа 3. Фосфор и его соединения».
Источник: 5terka.com