Измерение степени диссоциации различных электролитов показало, что отдельные электролиты при одинаковой нормальной концентрации растворов диссоциируют на ионы весьма различно.
Особенно велика разница в значениях степени диссоциации кислот. Например, азотная и соляная кислоты в 0 ,1 н. растворах почти полностью распадаются на ионы; угольная же, синильная и другие кислоты диссоциируют при тех же условиях лишь в не-знaчитeльнoй степени.
Из растворимых в воде оснований (щелочей) слабо диссоциирующим является гидрат окиси аммония, остальные щелочи хорошо диссоциируют. Все соли, за небольшим исключением, также хорошо диссоциируют на ионы.
Различие в значениях степени диссоциации отдельных кислот обусловливается характером валентной связи между атомами, образующими их молекулы. Чем более полярна связь между водородом и остальной частью молекулы, тем легче отщепляется водород, тем сильнее будет диссоциировать кислота.
Электролиты, хорошо диссоциирующие на ионы, получили название сильных электролитов, в отличие от слабых электролитов, образующих в водных растворах лишь незначительное число ионов. Растворы сильных электролитов сохраняют высокую электропроводность даже при очень больших концентрациях. Наоборот, электропроводность растворов слабых электролитов быстро падает с увеличением концентрации. к сильным электролитам относятся такие кислоты, как соляная, азотная, серная и некоторые другие, затем щелочи (кроме NH4OH) и почти все соли.
Как отличить слабый электролит от сильного?
Многоооновные кислоты и многокислотные основания диссоциируют ступенчато. Так, например, молекулы серной кислоты в первую очередь диссоциируют по уравнению
Отщепление второго иона водорода по уравнению
идет уже значительно труднее, так как ему приходится преодолевать притяжение со стороны двухзарядного иона SO 4», который, конечно, притягивает к себе ион водорода сильнее, чем однозарядный ион HSO 4‘. Поэтому вторая ступень диссоциации или, как говорят, вторичная диссоциация происходит в гораздо меньшей степени, чем первичная, и в обычных растворах серной кислоты содержится лишь небольшое число ионов SO4»
Фосфорная кислота Н3РО4 диссоциирует в три ступени:
Молекулы Н3РO4 сильно диссоциируют на ионы Н • и Н2РО4‘. Ионы H2PO4 ‘ ведут себя, как более слабая кислота, и диссоциируют на H • и HPO4 » в меньшей степени. Ионы же НРО4» диссоциируют, как очень слабая кислота, и почти не дают ионов Н •
Основания, содержащие более одной гидроксильной группы в молекуле, тоже диссоциируют ступенчато. Например:
Что касается солей, то нормальные соли всегда диссоциируют на ионы металлов и кислотных остатков. Например:
Кислые соли, подобно многоосновным кислотам, диссоциируют ступенчато. Например:
Однако степень диссоциации по второй ступени очень мала, так что раствор кислой соли содержит лишь незначительное число ионов водорода.
Основные соли диссоциируют на ионы основных и кислотных остатков. Например:
Вторичной диссоциации ионов основных остатков на ионы металла и гидроксила почти не происходит.
Электропроводность сильных и слабых электролитов
В табл. 11 приведены числовые значения степени диссоциации некоторых кислот, оснований и солей в 0 ,1 н. растворах.
С увеличением концентрации степень диссоциации уменьшается. Поэтому в очень концентрированных растворах даже сильные кислоты диссоциированы сравнительно слабо. Для
Степень диссоциации кислот , оснований и солей в 0,1 н. растворах при 18°
| Электролит | Формула | Степень диссоциаци и в % |
| Кислоты | ||
| Соляная | HCl | 92 |
| Бромистоводородная | НВr | 92 |
| Йодистоводородная | HJ | . 92 |
| Азотная | HNO3 | 92 |
| Серная | H 2SO4 | 58 |
| Сернистая | H 2SO3 | 34 |
| Фосфорная | H 3PO4 | 27 |
| Фтористоводородная | HF | 8,5 |
| Уксусная | CH3COOH | 1 ,3 |
| Уголная | H2 CO3 | 0 ,17 |
| Сероводородная | H2S | 0,07 |
| Синильная | HCN | 0,01 |
| Борная | H 3BO3 | 0,01 |
| Основания | ||
| Гидроксид бария | Ва (OH)2 | 92 |
| Едкое кали | кон | 89 |
| Едкий натр | NaON | 84 |
| Гидроксид аммония | NH4OH | 1 ,3 |
| Соли | ||
| Хлористый калий | КСl | 86 |
| Хлористый аммоний | NH4Cl | 85 |
| Хлористый натрий | NaCl | 84 |
| Азотнокислый калий | KNO3 | 83 |
| Азотнокислое серебро | AgNO3 | 81 |
| Уксуснокислый натрий | NaCH3COO | 79 |
| Хлористый цинк | ZnCl2 | 73 |
| Сернокислый натрий | Na2 SO4 | 69 |
| Сернокислый цинк | ZnSO4 | 40 |
| Сернокислая медь | CuSO4 | 40 |
примера приводим значения степени диссоциации обы чно употребляемых в лаборатории концентрированных кисло:
Азотная кислота (62% HNO3) . . . 9,6
Серная кислота (95% H2SО4) . . . 1
Вы читаете, статья на тему Сильные и слабые электролиты
Похожие страницы:
Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации В предыдущих параграфах мы познакомились с теорией электролитической диссоциации.
Кристаллогидраты и двойные соли как комплексные соединения Особенный интерес представляет возможность замещения молекул аммиака в комплексе молекулами воды. Для хрома.
Состояние сильных электролитов в растворе Теория Аррениуса во всех своих выводах исходит из предположения, что между находящимися в растворе ионами.
Ионные уравнения В обыкновенных химических уравнениях не учитывается диссоциация молекул на ионы, поэтому для выражения сущности реакций, происходящих при взаимодействии.
Диссоциация воды Одним из наименее диссоциированных веществ, образующихся при реакциях между ионами, является вода. Чистая вода очень плохо проводит электрический.
Понравилась статья поделись ей
Leave a Comment
Для отправки комментария вам необходимо авторизоваться.
Источник: znaesh-kak.com
Решение задач по теме «Классы неорганических соединений»
Задача 149.
Можно ли получить раствор, содержащий одновременно: а) Ва(ОН)2 и HCl; б) СаСI2 и Na2СО3; в) NaCl и AgNO3 ; г) КСI и NaNO3. Указать, какие комбинации невозможны и почему.
Решение:
а) Ba(OH)2 и HCl – сильные электролиты, поэтому в водных растворах диссоциируют полностью:
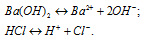
Находящиеся в растворе ионы Ba 2+ и Cl – не связываются с ионами H + и OH – с образованием осадка, газа или слабого электролита. Поэтому раствор Ba(OH)2 и HCl будет существовать.
б) Растворимые соли CaCl2 и Na2CO3 как сильные электролиты в водных растворах диссоциируют полностью по схемам:
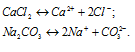
Ионы Ca 2+ и CO3 – связываются друг с другом, образуя осадок — не растворимая соль. В растворе останутся ионы Cl – и OH – , которые не связываются друг с другом, молекулами CaCO3 и ионами воды H + и OH — . Поэтому невозможно получить раствор, содержащий одновременно CaCl2 и Na2CO3, так как выпадает осадок СаСО3.
в) NaCl и AgNO3, как сильные электролиты в водных растворах диссоциируют полностью по схемам:
Ионы Ag + и Cl — связываются друг с другом, образуя осадок AgCl. В растворе остаются ионы Na + и NO3 — , которые не связываются друг с другом с молекулами AgCl, ионами воды H+ и OH- и не образуют осадок, газ или слабый электролит. Поэтому невозможно получить раствор, содержащий одновременно NaCl и AgNO3, так как выпадает осадок AgCl.
г) КСI и NaNO3 – растворимые соли, которые в водных растворах полностью распадаются на ионы:
KCl ⇔ K + + Cl — ;
NaNO3 ⇔ Na + + NO 3 — .
Образовавшиеся ионы K + , Na + , Cl — и NO 3 — не связываются друг с другом и ионами воды H + и OH — и не образуют осадок, газ или слабодиссоциируемое вещество. Таким образом, можно получить раствор одновременно содержащий КСI и NaNO3.
Задача 150.
Какие из перечисленных кислот образуют кислые соли: HJ, H2Se, H2SeO3, H2C2O4, CH3COOH.
Решение:
Кислые соли образуют многоосновные кислоты, в которых атомы водорода не все замещены на катионы кислоты. Так как кислоты HJ и CH3COOH содержат по одному катиону водорода в составе молекул, то они не могут образовать кислых солей. Кислоты H2Se, H2SeO3, H2C2O4 являются двухосновными кислотами, то они могут образовать кислые соли при замещении одного атома водорода на катион металла. При взаимодействии этих кислот с основаниями, в случае, если кислота взята в избытке, образуется кислая соль, например:
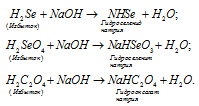
Названия кислых солей образуются, так же как и средних, но при этом добавляют приставку «гидро» и указывают наличие незамещённых атомов водорода, число которых обозначают греческими числительными («ди», «три» и т.д.). Например: NaH2HO4 — дигидроортофосфат натрия; KH2AsO4 – дигидроортоарсенат калия; Mg(HCO3)2 – гидрокарбонат магния.
Задача 151.
Какие кислоты могут быть получены непосредственным взаимодействием с водой оксидов: Р2О5, СО2, N2O5, NO2, SO2?
Решение:
а) При взаимодействии P2O5 с водой могут образоваться различные кислоты, например метафосфорная HPO3 и ортофосфорная H3PO4:
б) При пропускании углекислого газа через воду образуется раствор слабой угольной кислоты H2CO3:
в) При растворении N2O5 в воде образуется азотная кислота HNO3 – сильный электролит.
г) при взаимодействии NO2 с водой может быть получена смесь двух кислот азотистой HNO2 и азотной HNO3:
В присутствии избытка кислорода в воде образуется только азотная кислота:
д) SO2 хорошо растворим в воде (36 об. ч. SO2 на 1 об. ч. Н2О при 20 0 С), при этом образуется сернистая кислота H2SO3 – кислота средней силы:
Задача 152.
С какими из перечисленных ниже веществ будет реагировать соляная кислота: N2O5, Zn(ОН)2, СаО, AgNO3, Н3РO3, Н2SO4? Составить уравнения реакций.
Решение:
а) Оксид азота (V) N2O5 является кислотным оксидом, поэтому не реагирует с соляной кислотой HCl.
б) гидроксид цинка Zn(ОН)2 является амфотерным основанием, поэтому реагирует как с основаниями, так и с кислотами. Реакция между Zn(ОН)2 и HCl протекает:
в) Оксид кальция СаО является основным оксидом, поэтому реагирует с соляной кислотой:
г) Нитрат серебра AgNO3 – сильный электролит, который в водных растворах диссоциирует на ионы Ag + и NO3 — , а соляная кислота как электролит распадается на ионы H + и Cl — . Ионы Ag + и Cl — , соединяясь, образуют нерастворимую соль AgCl, которая выпадает в осадок. Реакция между нитратом серебра и соляной кислотой протекает по схеме:
д) Ортофосфорная кислота Н3РO4, серная кислота H2SO4 и соляная кислота HCl – электролиты, которые в водных растворах распадаются на ионы:
Ионы PO4 3- , SO4 2- , H + и Cl — не связываются друг с другом, не образуют осадок, газ или малодиссоциируемое вещество. Поэтому Н3РO3 и Н2SO4 не реагируют с HCl.
Задача 153.
Какие из указанных веществ реагируют с гидроксидом натрия: HNO3, CaO, CO2, CuSO4, Cd(OH)2, P2O5. Составить уравнения реакций.
Решение:
а) Азотная кислота как кислота вступает в реакцию нейтрализации с основанием NaOH, при этом образуется соль и вода:
б) Оксид кальция СаО – основной оксид, поэтому не будет реагировать с NaOH – сильным основанием.
в) Оксид углерода (II) СО2 – кислотный оксид, поэтому будет реагировать с гидроксидом NaOH с образованием соли и воды:
г) CuSO4 и NaOH – сильные электролиты, поэтому в водных растворах распадаются на ионы:
CuSO4 ⇔ Cu 2+ + SO4 2- ;
NaOH ⇔ Na + + OH —
Ионы Cu 2+ и OH — связываются друг с другом, образуя осадок из нерастворимого Cu(OH)2. Значит, между CuSO4 и NaOH реакция протекает по уравнению:
д) Гидроксид кадмия Сd(OH)2 имеет слабо выраженные кислотные свойства, поэтому в растворе гидроксида натрия высокой концентрации при длительном кипячении образует неустойчивые гексагидроксокадмиат(I) – ионы [Cd(OH)6] 4- :
Сd(OH)2 + 4NaOH → Na4[Cd(OH)6]
Оксид фосфора(V) Р2О5 – кислотный оксид, поэтому будет реагировать с раствором гидроксида натрия с образованием соли и воды:
Задача 154.
Написать уравнения реакций, свидетельствующих об основных свойствах FeO, Cs2O, HgO, Bi2O3.
Решение:
Оксиды FeO, Cs2O, HgO, Bi2O3 имеют основной характер, поэтому все они растворяются в кислотах с образованием соли и воды:
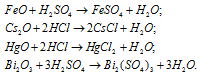
Задача 155.
Написать уравнения реакций, доказывающих кислотный характер SеО2, SО3, Мn2O7, Р2O5, СrО3.
Решение:
Кислотные оксиды SеО2, SО3, Мn2O7, Р2O5 и СrО3 при взаимодействии с водой образуют соответствующие кислоты. Все они проявляют кислотные свойства, взаимодействуют как с основаниями, так и с основными оксидами:
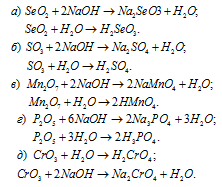
Задача 156.
Составить уравнения реакций получения хлорида магния: а) действием кислоты на металл; б) действием кислоты на основание; в) действием кислоты на соль.
Решение:
Уравнения реакций получения хлорида магния:
а) Действием кислоты на металл:
б) Действием кислоты на основание:
в) Действием кислоты на соль:
Задача 157.
Составить уравнения реакций между кислотами и основаниями, приводящих к образованию солей: NaNO3, NaHSO4, Na2HPO4, K2S, Fe2(SO4)3.
Решение:
Уравнения реакций образования солей:
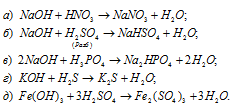
Задача 158.
Какие вещества могут быть получены при взаимодействии кислоты с солью? Кислоты с основанием? Соли с солью? Привести примеры реакций.
Решение:
а) При взаимодействии кислоты с солью могут быть получены кислота и соль, а также и другие вещества, например оксиды и вода:
б) При взаимодействии кислоты с основанием (реакция нейтрализации) образуются соль и вода:
в) Реакция между солями идёт, если при этом образуется малорастворимое соединение (реакция обмена). При взаимодействии соли с солью образуются новые соли, одна из них нерастворима:
- Вы здесь:
- Главная

- Задачи

- Химия-Глинка

- Основания и кислоты | Задачи 140 — 148
Источник: buzani.ru
Таблица сильных и слабых электролитов


Не расписываем на ионы ОКСИДЫ, осадки, газы, Н2О, малодиссоциирующие вещества.
Сильные электролиты (расписываем на ионы) кислоты щёлочи

Материалы на данной страницы взяты из открытых истончиков либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.
Источник: znanio.ru