Цель аналитической химии — установление качественного и количественного состава вещества или смеси веществ. В соответствии с этим аналитическая химия делится на качественный и количественный анализ.
Задачей качественного анализа является выяснение качественного состава вещества, т. е. из каких элементов или ионов состоит данное вещество.
При изучении состава неорганических веществ в большинстве случаев приходится иметь дело с водными растворами кислот, солей и оснований. Эти вещества являются электролитами и в растворах диссоциированы на ионы. Поэтому анализ сводится к определению отдельных ионов — катионов и анионов.
При проведении качественного анализа можно работать с различными количествами исследуемого вещества. Имеются так называемые грамм-метод, при котором масса исследуемого вещества берется более 0,5 г (более 10 мл раствора), сантиграмм-метод (масса исследуемого вещества от 0,05 до 0,5 г, или 1-10 мл раствора), миллиграмм-метод (масса исследуемого вещества от 10-6 г до 10-3 г, или от 0,001 до 0,1 мл раствора) и др. Наиболее распространенным является сантиграмм — метод, или полумикрометод.
Качественный анализ смеси анионов всех трех групп.
В данной курсовой работе рассмотрены следующие вопросы: методы качественного анализа, оборудование и посуда, классификация анионов и групповые реагенты, общая характеристика анионов первой группы, общая характеристика анионов второй группы, общая характеристика анионов третьей группы.
1 Методы качественного анализа
Методы качественного анализа делятся на химические, физико — химические и физические.
Физические методы основаны на изучении физических свойств анализируемого вещества. К этим методам относятся спектральный, рентгеноструктурный, масс-спектрометрический анализы и др.
В физико-химических методах течение реакции фиксируется измерением определенного физического свойства исследуемого раствора. К этим методам относятся полярография, хроматография и др.
К химическим методам относятся методы, основанные на использовании химических свойств исследуемых веществ.
1.1 Аналитические реакции
Анализ вещества, проводимый в растворах, называется анализом мокрым путем. Это основной путь полного определения состава вещества. При этом применяют реакции образования осадка, окрашенных соединений или выделения газа. Эти реакции проводят обычно в пробирках. Ряд качественных реакций проводят на предметных стеклах и образующиеся кристаллы рассматривают под микроскопом.
Это так называемые микрокристаллоскопические реакции. Иногда прибегают к выполнению реакций капельным методом. Для этого на полоску фильтровальной бумаги наносят каплю испытуемого раствора и каплю реактива и рассматривают окраску пятна на бумаге.
В химическом анализе используется лишь незначительная часть того многообразия реакций, которое свойственно данному иону.
Для открытия ионов пользуются реакциями, сопровождающимися различными внешними изменениями, например выпадением или растворением осадка, изменением окраски раствора, выделением газов, т. е. открываемый ион переводят в соединение, внешний вид и свойства которого характерны и хорошо известны. Происходящее при этом химическое превращение называется аналитической реакцией.
Нитрат серебра раствор плюс соляная кислота
Для аналитических реакций важнейшими требованиями являются специфичность и чувствительность. Чем меньшее количество ионов вступает в реакцию с данным реактивом, тем более специфична данная реакция. Чем меньшее количество вещества может быть определено с помощью данного реактива, тем более чувствительна эта реакция.
Чувствительность реакции можно охарактеризовать количественно при помощи двух показателей: открываемого минимума и предельного разбавления.
Открываемым минимумом называется наименьшее количество вещества или иона, которое может быть открыто данным реактивом при данных условиях.
Предельное разбавление характеризует наименьшую концентрацию вещества (или иона), при которой еще возможно открыть его данным реактивом.
1.2 Условия проведения аналитических реакций
Выполнение каждой аналитической реакции требует соблюдения определенных условий ее проведения, важнейшими из которых являются:
- концентрация реагирующих веществ;
- среда раствора;
- температура.
Реактивы, используемые для выполнения аналитических реакций, делятся на специфические, избирательные или селективные, и групповые.
Специфические реактивы образуют характерный осадок или окрашивание только с определенным ионом. Например, реактив образует темно-синий осадок только с ионами .
Избирательные или селективные реактивы реагируют с несколькими ионами, которые могут принадлежать к одной или к разным группам.
Например, реактив реагирует с ионами , , (II группа), а также с ионами и (VI группа).
Групповой реактив вступает в реакцию со всеми ионами данной группы. С помощью этого реактива ионы данной группы можно отделить от ионов других групп. Например, групповым реактивом второй аналитической группы является хлороводородная кислота, которая с катионами , , образует белые труднорастворимые осадки.
1.4 Систематический и дробный анализ
Большинство аналитических реакций недостаточно специфично и дает сходный эффект с несколькими ионами. Поэтому в процессе анализа приходится прибегать к отделению ионов друг от друга. Таким образом, открытие ионов проводится в определенной последовательности. Последовательное разделение ионов и их открытие носит название систематического хода анализа.
Систематический ход анализа основан на том, что сначала с помощью групповых реактивов разделяют смесь ионов на группы и подгруппы, а затем уже в пределах этих подгрупп обнаруживают каждый ион характерными реакциями. Групповыми реагентами действуют на смесь ионов последовательно и в строго определенном порядке.
В ряде случаев прибегают не к систематическому разделению ионов, а к дробному методу анализа. Этот метод основан на открытии ионов специфическими реакциями, проводимыми в отдельных порциях исследуемого раствора. Так, например, ион можно открыть при помощи реактива в присутствии любых ионов.
Так как специфических реакций немного, то в ряде случаев мешающее влияние посторонних ионов устраняют маскирующими средствами. Например, ион можно открыть в присутствии при помощи реактива , связывая мешающие ионы гидратом натрия в бесцветный комплекс.
Дробный анализ имеет ряд преимуществ перед систематическим ходом анализа: возможность обнаруживать ионы в отдельных порциях в любой последовательности, а также экономия времени и реактивов.
Но так как специфических реакций немного и мешающее влияние многих ионов нельзя устранить маскирующими средствами, в случае присутствия в растворе многих катионов из разных групп прибегают к систематическому ходу анализа, открывая лишь некоторые ионы дробным методом.
2 Оборудование и посуда
Наиболее удобно в обычной практике проводить качественное исследование полумикрометодом. Этот метод не требует больших количеств веществ для анализа, дает значительную экономию времени и реактивов по сравнению с макрометодом. В то же время этот метод значительно проще микрометода, требующего специальной аппаратуры и особых навыков работы.
Для работы полумикрометодом в лаборатории необходимо иметь следующее оборудование:
1) переносной деревянный штатив с набором капельниц с растворами солей, реактивов, кислот и щелочей и баночек с сухими солями (рисунок 1);
Рисунок 1 — Штатив с набором капельниц
2) штатив для пробирок;
3) металлический штатив с кольцом, фарфоровым треугольником и асбестированной сеткой;
4) держатели для пробирок;
5) центрифужные пробирки (рисунок 2);
Рисунок 2 — Центрифужные пробирки
6) пробирки цилиндрические;
7) капиллярные пипетки (рисунок 3.);
Рисунок 3 — Капиллярные пипетки
8) стеклянные палочки (рисунок 4.);
Рисунок 4 — Стеклянные палочки
9) фарфоровые чашки диаметром 3-5 см;
10) промывалка (рисунок 5);
Рисунок 5 — Промывалка
11) предметные стекла;
12) фарфоровая капельная пластинка (рисунок 6);
Рисунок 6 — Фарфоровая капельная пластинка
13) предметные стекла с углублениями (рисунок 7);
Рисунок 7 — Предметные стекла с углублениями
14) ершик для мытья посуды;
15) водяная баня (рисунок 8);
Рисунок 8 — Водяная баня
16) центрифуга (рисунок 9).
Рисунок 9 — Центрифуга
Частные реакции, а также операции разделения ионов проводят в конических пробирках для центрифугирования или в маленьких цилиндрических пробирках. В пробирку вносят несколько капель анализируемого раствора и, соблюдая необходимые условия, прибавляют по каплям реактив, помешивая реакционную смесь стеклянной палочкой.
Выполняя реакцию, необходимо следить за тем, чтобы кончик пипетки не касался стенок пробирки во избежание загрязнения реактива. Вынутую из капельницы пипетку по выполнении реакции необходимо сразу же опустить в ту же капельницу.
Вместо пробирок частные реакции можно выполнять также на фарфоровых капельных пластинках (рисунок 6) или особых предметных стеклах с углублениями (рисунок 7). В этом случае расход реактивов минимальный, а результат реакции хорошо заметен.
Для нагревания реакционной смеси пробирку погружают в кипящую водяную баню. Водяная баня может также служить для упаривания (выпаривания до небольшого объема) растворов. Выпаривание досуха обычно проводят в фарфоровой чашке, нагревая ее на пламени газовой горелки. Пока жидкость не выпарилась до конца, целесообразно ставить чашку на асбестированную сетку. Если остаток от выпаривания необходимо прокалить, чашку ставят на фарфоровый треугольник.
Для отделения осадка от раствора пробирку с осадком помещают в центрифугу.
3 Классификация анионов и групповые реагенты
Как известно из курса неорганической химии, к анионам относятся отрицательно заряженные частицы, состоящие из отдельных атомов или групп атомов различных элементов. Эти частицы могут нести один или несколько отрицательных зарядов. В отличие от катионов, которые в большинстве своем состоят из одного атома, анионы могут иметь сложный состав, состоящий из нескольких атомов.
Общепринятой классификации анионов не существует. Разными авторами предложены различные системы классификации их.
В настоящем руководстве принята наиболее часто применяемая классификация, по которой все анионы делятся на три аналитические группы в зависимости от растворимости их бариевых и серебряных селей.
В данном случае групповыми реагентами являются растворимые соли бария и серебра (таблица 1).
Источник: student-files.ru
Нитрат серебра является групповым реагентом для анионов
Анионы разделяют на аналитические группы. Групповые реагенты используются не для отделения групп анионов, а для того, чтобы сделать вывод: следует ли дальше проводить реакции для выявления каждого из ионов данной группы.
В основу классификации анионов положена разная растворимость солей бария и серебра. Все анионы можно разделить на три аналитические группы (табл.3).
Распределение анионов на аналитические группы
| Груп-па | Анионы | Групповой реагент | Характеристика группы |
| 1 | SO 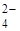 , CO , CO 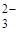 , PO , PO 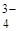 , SO3 2- , SiO3 2- , CrO4 2- , MnO4 — и др. , SO3 2- , SiO3 2- , CrO4 2- , MnO4 — и др. |
Хлорид бария в нейтральной или слабощелочной среде | Соли бария, которые мало растворяются в воде |
| 2 | CI  , Вr , Вr 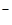 , I , I 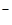 , S 2- , SCN — и др. , S 2- , SCN — и др. |
Нитрат серебра в присутствии азотной кислоты | Соли серебра, которые не растворяются в воде и разбавленной азотной кислоте |
| 3 | NO 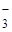 , CH
, CH  COO COO 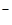 , NO2 — , NO2 — |
Группового реагента нет | Соли бария и серебра растворимы в воде |
К первой аналитической группе анионов относятся анионы: SO 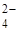 , CO
, CO  , PO
, PO 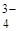 , SO3 2- , SiО3 2- , CrО4 2- , MnО4 — и т.п. Эти анионы образуют с катионом Ва
, SO3 2- , SiО3 2- , CrО4 2- , MnО4 — и т.п. Эти анионы образуют с катионом Ва 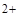 соли, которые мало растворяются в воде, но за исключением сульфата бария, хорошо растворяются в разбавленных минеральных кислотах. Поэтому выделять анионы этой группы в виде осадков групповым реагентом – хлоридом бария – можно только в нейтральной или слабощелочной среде. Анионы первой аналитической группы образуют с катионами серебра соли, которые растворяются в разбавленной азотной кислоте, а сульфат серебра растворяется даже в воде.
соли, которые мало растворяются в воде, но за исключением сульфата бария, хорошо растворяются в разбавленных минеральных кислотах. Поэтому выделять анионы этой группы в виде осадков групповым реагентом – хлоридом бария – можно только в нейтральной или слабощелочной среде. Анионы первой аналитической группы образуют с катионами серебра соли, которые растворяются в разбавленной азотной кислоте, а сульфат серебра растворяется даже в воде.
Ко второй аналитической группе анионов относятся ионы: CI 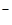 , Вr
, Вr  , I
, I  , S 2- , SCN — и т.п. Эти анионы образуют с катионами Ag
, S 2- , SCN — и т.п. Эти анионы образуют с катионами Ag  соли, которые не растворяются в воде и разбавленной азотной кислоте. Групповым реагентом второй группы анионов есть нитрат серебра в присутствии азотной кислоты (в этих условиях анионы первой группы не дают осадка с анионами Ag
соли, которые не растворяются в воде и разбавленной азотной кислоте. Групповым реагентом второй группы анионов есть нитрат серебра в присутствии азотной кислоты (в этих условиях анионы первой группы не дают осадка с анионами Ag  ). Хлорид бария с анионами второй группы осадков не дает.
). Хлорид бария с анионами второй группы осадков не дает.
К третьей группе анионов относятся ионы: NO 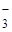 , CH
, CH  COO
COO 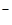 , NO2 — и т.п. Катионы Ba
, NO2 — и т.п. Катионы Ba 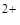 и Ag
и Ag 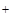 с анионами данной группы не образуют осадков, группового реагента на ионы третьей группы нет.
с анионами данной группы не образуют осадков, группового реагента на ионы третьей группы нет.
Перечень заданий контрольной работы (раздел 1)
47.На чем основан принцип аналитической классификации катионов? Сколько и каких аналитических групп катионов существуют в кислотно-щелочной классификации?
2. Разделите катионы Fe 2+ , Cu 2+ , Ba 2+ , Zn 2+ , Pb 2+ на аналитические группы, укажите групповые реагенты, составьте соответствующие уравнения реакций.
3. Что называют групповым реагентом? Какие реакции являются общими, а какие специфическими? Приведите примеры.
4. Распределите катионы Mn 2+ , Al 3+ , Ag + , Ba 2+ , Cu 2+ на аналитические группы, укажите групповые реагенты, составьте соответствующие уравнения реакций.
5. Какую реакцию называют аналитической (качественной)? Какие требования к ней предъявляются? Что такое чувствительность реакции?
6. По какому признаку катионы Ag + , Pb 2+ образуют отдельную аналитическую группу? Какова растворимость их хлоридов в воде и как это используется в анализе?
7. Разделите катионы Ni 2+ , Mn 2+ , Cr 3+ , Ca 2+ , Pb 2+ на аналитические группы, укажите групповые реагенты, составьте соответствующие уравнения реакций.
8. На чем основан принцип аналитической классификации анионов? Какие вы знаете аналитические группы анионов?
9. Распределите катионы Cr 3+ , Ca 2+ , Ni 2+ , Pb 2+ , Mn 2+ на аналитические группы, укажите групповые реагенты, составьте соответствующие уравнения реакций.
Какое значение для аналитических исследований сырья и материалов имеет определение рН? Определите рН раствора, концентрация ионов Н + которого равна 1·10 -3 моль/дм 3 .
Разделите катионы Fe 3+ , Ag + , Al 3+ , Co 2+ на аналитические группы, укажите групповые реагенты, составьте соответствующие уравнения реакций.
Какое значение имеют процессы гидролиза солей в качественном анализе?
13. Какое значение для аналитических исследований имеют процессы комплексообразования? Приведите примеры.
14. Напишите уравнения реакций, при помощи которых можно подтвердить наличие в растворе следующих анионов: PO  , CH
, CH  COO
COO  , CO
, CO  .
.
Раздел 2.Основы гравиметрического анализа
Гравиметрическим (весовым) называют метод количественного анализа, основанный, но точном измерении массы определяемого вещества,
выделенного в химически чистом виде или в виде малорастворимого соединения точно известного постоянного состава.
Гравиметрические методы основаны на законах сохранения массы вещества и постоянства состава веществ. Гравиметрический анализ отличается высокой точностью (до 0,2%) и хорошей воспроизводимостью.
Все многочисленные весовые определения можно разделить на три большие группы методов, а именно: методы выделения, отгонки и осаждения.
При изучении темы уясните основные требования, предъявляемые к осадкам, и способы получения возможно чистых осадков, особое внимание обратите на то, как влияют условия осаждения аморфных и кристаллических осадков, условия получения крупнокристаллических осадков. Изучите устройство весов (технохимических и аналитических), технику и правила взвешивания на них, обратите внимание на точность взвешивания и запись результатов. Ознакомьтесь с основными приемами гравиметрического
анализа и его основными операциями (взятие навески вещества, перевод ее в раствор, осаждение, фильтрование и промывание осадка, высушивание и взвешивание).
Обратите внимание на требования, предъявляемые к осаждаемой и весовой форме.
Требования, предъявляемые к осаждаемой форме:
малая растворимость – не более 1×10 -7 – 10 -8 моль/дм 3 ;
осадок должен быть крупнокристаллическим;
необходимо, чтобы осаждаемая форма достаточно легко и полно превращалась в весовую форму.
Учтите, что осаждаемая форма по своему составу на всегда совпадает с весовой формой.
Требования, предъявляемые к весовой форме:
точное соответствие химической формуле;
достаточная химическая устойчивость; она не должна поглощать оксид углерода (IV) воздуха, водяные пары, не окисляться кислородом воздуха, не разлагаться при высоких температурах;
Величина навески исследуемого вещества влияет на точность проведенного анализа. Чем больше величина навески, тем выше точность проведенного анализа. Однако не выгодно иметь слишком большое количество осадка, так как последний было бы трудно отмыть от примесей, возрастает время, необходимое для анализа.
В то же время применение слишком малых навесок может явиться причиной значительных относительных ошибок. Например, если общая масса осадка 0,5 г, а потери его 0,0005 г, то ошибка составит 0,1%. При массе осадка в 0,05 г при тех же потерях ошибка возрастает в 10 раз и будет равна 1%.
Таким образом, при уменьшении навески возрастает относительная ошибка анализа. Практикой установлено, что величина осадка в случае кристаллических осадков должна составлять около 0,5 г, а в случае аморфных осадков – около 0,2-0,3 г. Исходя из этого, можно рассчитать оптимальную величину навески и количество осадителя. Для полноты осаждения берут полуторный избыток рассчитанного количества осадителя.
Осадки бывают аморфные и кристаллические. Обратите внимание на условия образования таких осадков: концентрация раствора, температура растворов, скорость приливания осадителя и перемешивание. Так, например, осаждение из концентрированных растворов приводит к образованию аморфных осадков, поэтому для получения крупнокристаллических осадков осаждение ведут из относительно разбавленных горячих растворов при медленном приливании осадителя и при перемешивании.
Серьезное внимание обратите на расчеты, уясните понятие о факторе пересчета (аналитическом множителе).
Расчеты в количественном анализе основаны на стехиометрии уравнений реакций. Например, в реакции

соотношение между числом прореагировавших молекул нитрата серебра и хлорида натрия одинаково и не зависит от их исходных количеств. При избытке одного из веществ избыточное количество его остается без изменения.
Решение. Расчет следует вести, исходя из реакций:
Источник: findout.su
Аналитические реакции анионов

Общепринятой классификации анионов не существует. Чаще всего используется классификация анионов по растворимости их солей бария и серебра.
I Аналитическая группа анионов объединяет ионы SO4 2- , CO3 2- , PO4 3- , SiO3 2- , которые образуют малорастворимые соли бария. Групповым реагентом является раствор хлорида бария BaCl2.
II Аналитическая группа анионов включает ионы Cl — , Br — , I — , S 2- , которые образуют малорастворимые соли серебра. Групповым реагентом является раствор нитрата серебра AgNO3.
III Аналитическая группа анионов объединяет ионы NO3 — , CH3COO — , большинство солей которых хорошо растворимы в воде. Группового реагента нет.
Анализ анионов имеет свои особенности. Анионы открывают дробным методом в отдельных порциях исследуемого раствора. При выполнении характерных реакций на анионы следует обратить особое внимание на свойства и растворимость получаемых осадков солей бария и серебра (т.к. внешний вид осадков многих анионов практически одинаков).
1. Аналитическая реакция сульфат-иона, SO4 2-
1.1. Реакция с хлоридом бария. Анион SO4 2- с катионом Ba 2+ образует белый кристаллический осадок сульфата бария BaSO4 , нерастворимый в минеральных кислотах:
Выполнение реакции: поместить в пробирку 4-5 капель раствора любого сульфата (Na2SO4 , или K2SO4 , или (NH4)2SO4) и добавить к нему 2-3 капли раствора хлорида бария BaCl2. Полученный осадок разделить в две пробирки. В первую пробирку добавить 4-5 капель раствора CH3COOH (2 М), а в другую — 4-5 капель HCl (2М).
Записать наблюдение и уравнение реакции в молекулярном и ионно-молекулярном виде.
2. Аналитические реакции хлорид-иона, Cl —
2.1. Реакция с нитратом серебра, AgNO3. Ион серебра Ag + с хлорид-ионом Cl — образует белый творожистый осадок хлорида серебра AgCl, нерастворимый в воде и кислотах. Осадок хлорида серебра AgCl легко растворяется в растворе аммиака с образованием комплексного соединения [Ag(NH3)2]Cl. При действии азотной кислоты комплексный ион [Ag(NH3)2] + разрушается и снова выпадает осадок хлорида серебра AgCl:
Выполнение реакции: поместить в пробирку 4-5 капель раствора любого хлорида (NaCl, или KCl, или NH4Cl) и прибавить 2-3 капли раствора нитрата серебра AgNO3. К образовавшемуся осадку хлорида серебра AgCl прибавить по каплям раствор аммиака NH3 (25%) до полного растворения осадка. К полученному бесцветному раствору комплексного соединения добавить по каплям азотную кислоту до появления белого осадка (рН < 7).
Записать наблюдения и уравнения реакций в молекулярном и ионно-молекулярном виде.
3. Аналитическая реакция нитрат-иона, NO3 —
3.1 Реакция с дифениламином, (C6H5)2NH. (Работать с раствором дифениламина нужно осторожно, так как он приготовлен в концентрированной H2SO4). Дифениламин в присутствии концентрированной серной кислоты окисляется нитрат ионом NO3 — до соединения, имеющего темно-синюю окраску.
Выполнение реакции: внести в сухую пробирку (по стенке пробирки!) 1-2 капли раствора любого нитрата (NaNO3, или KNO3, или др.) и прибавить 1-2 капли раствора дифениламина (по стенке пробирки!). На стенке пробирки (в месте соприкосновения растворов) наблюдается темно-синее окрашивание.
Записать наблюдение в тетрадь.
Анализ смеси катионов I-III аналитических групп и анионов
Анализ смеси катионов I — III аналитических групп и анионов
Предварительные испытания
1. С помощью универсального индикатора определить рН раствора.
2. Провести реакцию открытия иона NH4 + (см. л.р.10).
1. Осаждение хлоридов катионов II аналитической группы групповым реагентом HCl (2 М)
1.1.Поместить в центрифужную пробирку 2-3 мл исследуемого раствора и прибавить к нему 8-10 капель 2 М раствора HCl. Перемешать смесь стеклянной палочкой и затем отделить осадок от раствора центрифугированием.
Проверить полноту осаждения. Для этого к раствору над осадком (центрифугату) прибавить еще 2-3 капли раствора HCl. Если при этом не происходит помутнение раствора, то осаждение полное.
Осадок 1 Центрифугат 1
1.2. Центрифугат 1 слить с осадка в отдельную пробирку и написать номер. Оставить этот раствор для дальнейшего анализа.
1.3. Работать с осадком 1.
Осадок промыть дистиллированной водой, содержащей 2-3 капли HCl. Отделить осадок от раствора центрифугированием, осторожно слить раствор с осадка в раковину. К промытому осадку добавить 2-3 мл дистиллированной воды, перемешать стеклянной палочкой и нагреть на водяной бане.
В горячей воде PbCl2 растворяется. В осадке останутся (если они есть) AgCl и Hg2Cl2 (осадок 2).
1.4.Отделить осадок 2 от раствора центрифугированием. Центрифугат 2 слить в отдельную пробирку и провести реакцию открытия Pb 2+ (реакцией с KI).
Осадок 2 Центрифугат 2
1.5. К оставшемуся в центрифужной пробирке осадку 2 прибавить 2-3 мл концентрированного раствора NH3, перемешать смесь стеклянной палочкой.
AgCl растворится в растворе аммиака с образованием бесцветного раствора аммиаката серебра [Ag(NH3)2]Cl (см. л.р. 10). Hg2Cl2 превращается в смесь [HgNH2]Cl и Hg — черного цвета. Отделить осадок 3 от раствора центрифугированием.
Источник: megaobuchalka.ru