Природный минерал алмаз: структура, физические и химические свойства

Алмаз — природный минерал, один из самых известных и дорогих. Вокруг него ходит множество домыслов и легенд, особенно что касается его стоимости и выявления подделок. Отдельной темой для изучения является связь алмаза и графита. Многие знают, что эти минералы схожи, но далеко не всем известно, чем именно. Да и на вопрос о том, чем они отличаются, тоже не каждый сможет ответить.
А что мы знаем о структуре алмаза? Или о критериях оценивания драгоценных камней?
Структура алмаза
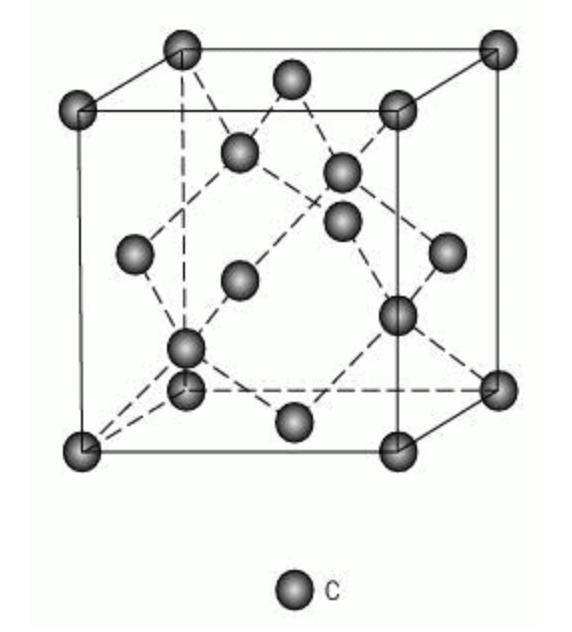
Алмаз — один из трех минералов, представляющих собой кристаллическую модификацию углерода. Два других — это графит и лонсдейлит, второй можно обнаружить в метеоритах либо создать искусственным путем. И если эти камни — гексагональные модификации, то тип кристаллической решетки алмаза — куб.
Окружающий мир 3 класс ч.1, тема урока «Самое главное вещество», с.62-65, Перспектива
В этой системе атомы углерода расположены таким образом: по одному на каждой вершине и в центре грани, и четыре внутри куба. Таким образом, получается, что атомы расположены в виде тетраэдров, и каждый атом находится в центре одного из них. Частицы связаны между собой самой прочной связью — ковалентной, благодаря чему алмаз и имеет высокую твердость.
Химические свойства
- азот;
- бор;
- алюминий;
- кремний;
- кальций;
- магний.
Также в состав могут входить кварц, гранаты, оливин, прочие минералы, окиси железа, вода и другие вещества. Зачастую эти элементы находятся в составе минерала в виде механических минеральных включений, но некоторые из них могут замещать углерод в структуре алмаза — это явление называется изоморфизмом. В таком случае включения могут значительно влиять на физические свойства минерала, на его цвет, отражение света, а включения азота придают ему люминесцентные свойства.
Физические свойства
Структура алмаза обуславливает его физические свойства, они оцениваются по четырем критериям:
- твердость;
- плотность;
- дисперсия и преломление света;
- кристаллическая решетка.
Твердость минералов оценивается по шкале Мооса, его оценка по этой системе равняется 10, это максимальный показатель. Следующий в списке корунд, его показатель — 9, однако его твердость меньше в 150 раз, что означает абсолютное первенство алмаза по этому показателю.
Однако твердость минерала вовсе не означает его прочность. Алмаз достаточно хрупкий и легко раскалывается, если ударить его молотком.
Удельный вес алмаза (плотность) определяется в промежутке от 3,42 до 3,55 гр/см 3 . Он определяется в соотношении веса минерала к весу воды того же объема.
Помимо твердости, он обладает и высокими показателями преломления света (2,417-2,421) и дисперсии (0,0574). Такое сочетание свойств позволяет алмазу быть самым драгоценным и идеальным ювелирным камнем.
Значение имеют также и другие физические свойства минерала, такие как теплопроводность (900-2300 Вт/м·К), также самая высокая из всех веществ. Можно также отметить способность минерала не растворяться в кислотах и щелочах, свойства диэлектрика, низкий коэффициент трения по металлу в воздухе и высокую температуру плавления 3700-4000 °C при давлении 11 ГПа.
Сходства и отличия алмаза и графита
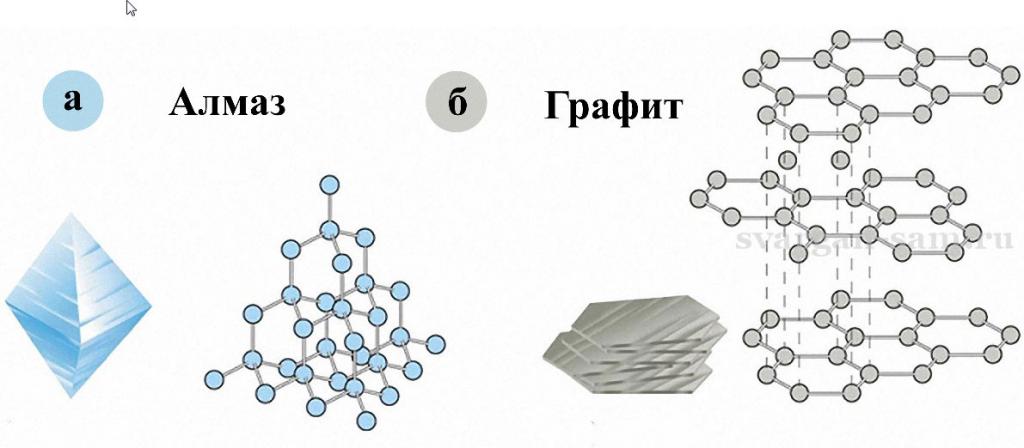
Углерод — один из самых распространенных элементов на Земле, он содержится во многих веществах, в особенности в живых организмах. Графит, как и алмаз, состоит из углерода, однако структуры алмаза и графита сильно отличаются.
Алмаз может превращаться в графит под действием высоких температур без доступа кислорода, но в нормальных условиях он способен бесконечно долго оставаться в неизменном виде, это называют метастабильностью, к тому же тип кристаллической решетки алмаза — куб. А вот графит — минерал слоистый, его структура выглядит как ряд пластов, расположенных в разных плоскостях. Эти пласты составляются из шестиугольников, формирующих систему, похожую на соты. Сильные связи образуются только между этими шестиугольниками, а вот между пластами они крайне слабые, это и обуславливает слоистость минерала. Помимо низкой твердости, графит поглощает свет и имеет металлический блеск, чем также сильно отличается от алмаза.
Эти минералы являются самым ярким примером аллотропии — явления, при котором вещества имеют разные физические свойства, хоть и состоят их одного химического элемента.
Происхождение алмаза
Нет однозначного мнения по поводу того, как образуются алмазы в природе, существуют магматическая, мантийная, метеоритная и прочие теории. Однако наиболее распространенной является магматическая. Считается, что алмазы образуются на глубине около 200 км под давлением в 50 000 атмосфер, а после выносятся на поверхность вместе с магмой во время формирования кимберлитовых трубок.
Возраст алмазов варьируется от 100 миллионов до 2,5 миллиарда лет. Также научно доказано, что алмазы могут образовываться при ударе метеорита о поверхность земли, а также находиться в самой метеоритной породе. Однако кристаллы такого происхождения имеют крайне мелкие размеры и редко подходят для обработки.
Месторождения алмазов
Первые месторождения, в которых были обнаружены и добывались алмазы, располагались в Индии, но уже к концу XIX века они были сильно истощены. Однако именно там были добыты самые известные, крупные и дорогостоящие образцы. А в XVII и XIX столетиях были обнаружены месторождения минерала в Бразилии и Южной Африке. История пестрит легендами и фактами об алмазной лихорадке, которые связаны именно с южноафриканскими рудниками. Последние обнаруженные месторождения алмазов находятся в Канаде, их освоение началось лишь в последнем десятилетии XX века.
Особенно интересны рудники Намибии, хотя добыча алмазов там является делом сложным и опасным. Залежи кристаллов сосредоточены под слоем грунта, что хоть и усложняет работу, но говорит о высоком качестве минералов. Алмазы, прошедшие путь в несколько сотен километров до поверхности при постоянном трении о прочие породы, являются высокосортными, менее качественные кристаллы просто не выдержали бы такого путешествия, а потому 95 % добытых камней — ювелирного качества. Также известные и богатые минералами кимберлитовые трубки есть в России, Ботсване, Анголе, Гвинее, Либерии, Танзании и других странах.

Обработка алмазов
Обработка алмазов требует огромного опыта, знаний и умений. Прежде чем приступать к работе, необходимо досконально изучить камень, чтобы впоследствии максимально сохранить его вес и избавиться от вкраплений. Наиболее распространенный тип огранки алмазов — круглый, он позволяет камню заиграть всеми красками и максимально выгодно отражать свет. Но такая работа является и самой сложной: круглый бриллиант имеет 57 плоскостей, и при его огранке важно соблюдать точнейшие пропорции. Также популярными типами огранки являются: овал, слеза, сердце, маркиза, изумрудная и другие. Выделяют несколько этапов обработки минералов:
- разметка;
- раскалывание;
- распиловка;
- закругление;
- огранка.
До сих пор считается, что после обработки алмаз теряет около половины своего веса.

Критерии оценивания алмазов
При добыче алмазов лишь 60 % процентов минералов пригодны для обработки, их называют ювелирными. Естественно, стоимость необработанных камней значительно уступает цене бриллиантов (более чем в два раза). Оценка стоимости бриллиантов проводится по системе 4C:
- Carat (вес в каратах) — 1 карат равен 0,2 г.
- Color (цвет) — чисто белых алмазов практически не встречается, большинство минералов имеют определенный оттенок. От окраски алмаза во многом зависит его стоимость, большинство встречающихся в природе камней имеют желтый или коричневый оттенок, реже можно обнаружить розовые, голубые и зеленые камни. Наиболее редкими, красивыми, а оттого и дорогими являются минералы насыщенных оттенков, их называют фантазийными. Наиболее редкие из них — зеленый, фиолетовый и черный.
- Clarity (чистота) — также важный показатель, который определяет присутствие дефектов в камне и значительно влияет на его стоимость.
- Cut (огранка) — от огранки сильно зависит внешний вид бриллианта. Преломление и отражение света, своеобразное «бриллиантовое» сияние делают этот камень столь ценным, а неправильная форма или соотношение пропорций при обработке могут напрочь его испортить.

Изготовление искусственных алмазов
Сейчас технологии позволяют «выращивать» алмазы, практически неотличимые от натуральных. Существует несколько способов синтеза:
- Создание HPHT-алмазов — наиболее близкая к природным условиям методика. Минералы создаются из графита и затравочного алмаза при температуре 1400 °С под давлением в 50 000 атмосфер. Этот метод позволяет синтезировать камни ювелирного качества.
- Создание CVD-алмазов (пленочный синтез) — изготовление камней в вакуумных условиях с использованием затравки и газов метана и водорода. Этот способ позволяет синтезировать чистейшие минералы, однако крайне маленьких размеров, потому в основном они имеют промышленное назначение.
- Взрывной синтез — это способ позволяет получить мелкие кристаллы алмаза посредством детонации взрывчатых веществ и последующего охлаждения.

Как отличить оригинал от подделки
Говоря о методах определения подлинности алмазов, стоит различать проверку подлинности бриллиантов и необработанных алмазов. Неопытный человек может спутать алмаз с кварцем, хрусталем, другими прозрачными минералами, и даже со стеклом. Тем не менее исключительные физические и химические свойства алмаза позволяют с легкостью определить подделку.
В первую очередь стоит вспомнить о твердости. Этот камень способен поцарапать любую поверхность, а вот на нем оставить следы может только другой алмаз. Также на натуральном кристалле не остается испарины, если на него подышать. На мокром камне будет след как от карандаша, если провести по нему алюминием.
Можно проверить его рентгеном: натуральный камень под излучением имеет насыщенный зеленый окрас. Или посмотреть сквозь него на текст: сквозь натуральный алмаз его будет невозможно разобрать. Отдельно стоит отметить, что натуральность камня можно проверить на преломление света: поднеся к источнику света подлинник, можно увидеть лишь светящуюся точку в центе.
Источник: fb.ru
О некотором веществе известно что оно является драгоценным камнем высокой твердости его структура
Опубликовано 29.09.2017 по предмету Химия от Гость >> Оцени ответ

Не нашёл ответ?
Если тебя не устраивает ответ или его нет, то попробуй воспользоваться поиском на сайте и найти похожие ответы по предмету Химия.
Самые новые вопросы
Гадать еще раз
- Алгебра

- Математика

- Русский язык

- Українська мова

- Информатика

- Геометрия

- Химия

- Физика

- Экономика

- Право

- Английский язык

- География

- Биология

- Другие предметы

- Обществознание

- История

- Литература

- Українська література

- Беларуская мова

- Қазақ тiлi

Показать ещё
Источник: nebotan.com
Какая кристаллическая решетка у алмаза и в чем ее уникальность
Кристаллической решеткой алмаза ученые заинтересовались давно. Благодаря ее характеристикам, камень имеет особые свойства и ценность. Существуют аллотропные модификации, используемые в промышленности, электронике, медицине, космонавтике, авиации. В настоящее время развивается отрасль по созданию искусственных алмазов, но она требует больших затрат.

Что такое кристаллическая решетка
Как известно, все вещества состоят из частиц — атомов, которые могут располагаться хаотично или в определенном порядке. У аморфных веществ частицы расположены беспорядочно, а у кристаллических они образуют определенную структуру. Эта структура называется кристаллической решеткой. Она определяет такие характеристики вещества, как твердость, хрупкость, температура кипения и/или плавления, пластичность, растворимость, электропроводность и т. д.

Кристаллическая решетка — это внутренняя структура кристалла, порядок взаимного расположения атомов, ионов или молекул. Точки, в которых находятся эти частицы, называются узлами решетки.
Частицы удерживаются на своих местах благодаря химическим связям между ними. В зависимости от того, какой вид связи удерживает атомы или ионы данного вещества, в химии выделяют основные типы кристаллических решеток:
- атомная (ковалентные связи),
- молекулярная (ковалентные связи и притяжение между молекулами),
- металлическая (металлические связи),
- ионная (ионные связи).
Важно!
Не путайте эти два понятия — кристаллическая решетка и химическая связь. Тип решетки говорит о том, как расположены атомы/ионы в молекуле вещества, а тип связи — по какому принципу они между собой взаимодействуют.

Различные вещества
Это интересно: как определить валентность по таблице Менделеева?
Строение и агрегатное состояние веществ
Выделяют три агрегатных состояния: твердое тело, жидкость и газ. Каждое из них предполагает определенное расположение частиц. Ниже мы расскажем подробнее, как связаны в химии кристаллическая решетка и агрегатное состояние вещества, а пока осветим общие закономерности.
- Если частицы хаотично движутся, а расстояние между ними многократно превышает их собственные размеры — это газ. За счет большой удаленности друг от друга молекулы и атомы в таком веществе слабо взаимодействуют между собой.
- Если частицы расположены все так же беспорядочно, но на небольшом расстоянии друг от друга — это жидкость. В жидком состоянии вещества его молекулы и атомы имеют более прочные связи, которые сложнее разорвать.
- Если частицы собраны близко друг к другу и в определенном порядке — это твердое тело. В таком состоянии связи между ними наиболее прочны. Частицы могут двигаться только в пределах своего расположения и почти не перемещаются в пространстве.
Большинство веществ могут находиться и в твердом, и в жидком, и газообразном состоянии, а в зависимости от давления и температуры легко переходить из одного в другое. Типичный пример — вода, которая при нагревании превращается в пар, а при остывании становится твердым льдом.

Способ образования
Алмаз – один из самых дорогих драгоценных камней уже много столетий. Вопросы о генезисе до недавнего времени были спорными. Ещё в 50-х годах прошлого столетия утверждалось об их растительном происхождении, причем монография Гепперта об этом была удостоена высших наград и признаний со стороны голландского ученого сообщества. Продолжалось такое положение дел совсем недолго, а именно, открытие воронок в Африке и метеоритов с алмазными вкраплениями изменило устоявшее суждения о происхождении этого камня.

Основной тип месторождений – трубки, образованные взрывом, их еще называют диатремы. Эти диатремы в основном сложены кимберлитами – брекчиевидными изверженными породами. Кимберлиты в своем составе содержат также и древние глубинные породы – ксенолиты. Существует предположение, что именно они слагают верхнюю мантию Земли.
Глубинные породы с алмазами, вынесенные взрывом на поверхность, а также минеральные включения, указывают образование последних под действием высокого давления и температуры. Эти два показателя говорят об определенной фации глубинности (110-135 км) при давлениях 4-4,3 Гпа. Если перевести в привычные «а, то получится приблизительно 40 тыс. атмосфер. На сегодня считается, что алмаз в трубках образовался на глубине 100-200 км при температурах 1300-1700oC и более высоких давлениях.
Несмотря на условия образования, алмаз на земной поверхности – неустойчивая стабильная углеродная модификация. По нашим представлениям он должен был преобразоваться в графит, но этого не произошло.
Атомная кристаллическая решетка
Согласно своему названию, атомная кристаллическая решетка — это структура, в узлах которой расположены атомы. Они взаимодействуют с помощью ковалентных связей, то есть один атом отдает другому свободный электрон или же электроны из разных атомов образуют общую пару. В кристаллах с атомной решеткой частицы прочно связаны, что обуславливает ряд физических характеристик.
Свойства веществ с атомной решеткой:
- прочность,
- твердость,
- неспособность к растворению в воде,
- высокая температура кипения и плавления.
К примеру, атомную кристаллическую решетку имеет алмаз — самый твердый минерал в мире.
Другие примеры: германий Ge, кремний Si, нитрид бора BN, карборунд SiC. Типичный представитель этой группы — обычный песок, который по сути является оксидом кремния SiO
Если нужно рассказать о свойствах веществ с атомной кристаллической решеткой, достаточно вспомнить песок и перечислить его характеристики.

Физические и химические свойства
Химическая формула минерала – C. Кристалл хорошо проводит тепло, но не проводит (или слабо проводит) электрический ток. Имеет хорошие преломляющие и отражающие свойства.
Плавится при температуре свыше 3700 градусов. Горит в сочетании с кислородом при температуре более 721 градуса. Устойчив к кислотам и щелочам.
- Цвет: бесцветный, прозрачный. Возможны оттенки голубого, желтого, синего, розового, красного, бурого, черного.
- Форма: кристалл с разным количеством граней.
- Блеск: сильный алмазный.
- Плотность: 3,5 г/см3.
- Твердость: абсолютная, 10 баллов. Но при этом камень очень хрупкий.
- Спайность: средняя.
- Электропроводность: слабая или отсутствует.
- Люминесцирует при ультрафиолете.
- Под действием рентгеновского излучения снижается прочность связей.
Молекулярная кристаллическая решетка
Как и в предыдущей группе, в этой находятся вещества с ковалентными связями между атомами. Но физические характеристики этих веществ совершенно иные — они легко плавятся, превращаются в жидкость, растворяются в воде. Почему так происходит? Все дело в том, что здесь кристаллы строятся не из атомов, а из молекул.
Молекулярная кристаллическая решетка — это структура, в узлах которой находятся не атомы, а молекулы.
Внутри молекул атомы имеют прочные ковалентные связи, но сами молекулы связаны между собой слабо. Поэтому кристаллы таких веществ непрочные и легко распадаются.
Молекулярная кристаллическая решетка характерна для воды. При комнатной температуре это жидкость, но стоит нагреть ее до температуры кипения (которая сравнительно низка), как она тут же начинает превращаться в пар, т. е. переходит в газообразное состояние.
Некоторые молекулярные вещества — например, сухой лед CO
2, способны преобразоваться в газ сразу из твердого состояния, минуя жидкое (данный процесс называется возгонкой).
Свойства молекулярных веществ:
- небольшая твердость;
- низкая прочность;
- легкоплавкость;
- летучесть;
- у некоторых — наличие запаха.
Помимо воды к веществам с молекулярной кристаллической решеткой относятся аммиак NH
3, гелий He, радон Rn, йод I, азот
N
2 и другие. Все благородные газы — молекулярные вещества. Также к этой группе принадлежит и большинство органических соединений (например, сахар).

Применение в промышленности
Алмаз не царапается ни одним из существующих элементов на Земле. Это замечательное свойство получило широкое распространение в области народного хозяйства. Два аллотропных состояния одного химического элемента углерода – графит и алмаз, а имеют столь разное применение. Графит наименьшей твердостью используется в качестве сухой смазки в механизмах трения, тогда как алмаз с наивысшей твердостью по шкале Мооса, применяется в качестве абразивного материала. Буровые коронки с алмазным напылением, шлифовальные круги – это малая часть орудий производства по обработке материалов.
Алмаз нашел своё применение и в изучении космоса в качестве теплоотводящего материала при экстремальных температурах.
Cтанция «Пионер», запущенная к Венере в 1978 году, была покрыта материалом из алмазной крошки.
Широкое применение технических образцов (искусственно полученных) известно в радиоэлектронике, оптических приборах, при производстве медицинских инструментов. Для нужд техники производится 500 млн карат искусственных алмазов, это 100 тонн ежегодно.
Ионная кристаллическая решетка
Как известно, в ходе ионной химической связи один атом отдает другому ионы и приобретает положительный заряд, в то время как принимающий атом заряжается отрицательно. В итоге появляются разноименно заряженные ионы, из которых и состоит структура кристалла.
Ионная решетка — это кристаллическая структура, в узловых точках которой находятся ионы, связанные взаимным притяжением.
Ионную кристаллическую решетку имеют практически все соли, типичным представителем можно считать поваренную соль NaCl. О ней стоит вспомнить, если нужно перечислить физические характеристики этой группы. Также ионную решетку имеют щелочи и оксиды активных металлов.
Свойства веществ с ионной структурой:
- твердость;
- хрупкость;
- тугоплавкость;
- нелетучесть;
- электропроводность;
- способность растворяться в воде.
Примеры веществ с ионной кристаллической решеткой: оксид кальция CaO, оксид магния MgO, хлорид аммония NH
4
Cl
, хлорид магния Mg
Cl
2, оксид лития
Li
2
O
и другие.

Синтетические алмазы
Открытие аллотропных модификаций дало ученым надежду на синтетическое произведение алмазов. И у них отчасти это получилось, хотя сам процесс нельзя назвать легким. С химической точки зрения, тот же графит, например, должен получить сигма-связи. Такие условия воссоздать можно только в самых мощных лабораториях под действием больших температур и давления.
- HPHT — тип алмаза получается из растворения графита и оседания его в катализаторе на затравочном минерале. После этого вещество начинает выстраивать необходимые связи.
- CVD тип — основывается на пленочном осаждении графита с использованием паров метана.
- Метод взрывного синтеза — наиболее естественный, с использованием углерода под высоким давлением.
Пока даже эти методы осуществляются с трудом, поэтому стоимость алмазов остается высокой. Но технологии продолжают развиваться в этом направлении.
Источник: emercity.ru
Свойства, твердость и структура алмаза
Многие знают, что алмаз самый твердый в мире природный материал. Некоторые слышали или, возможно, сталкивались с таким понятием, как алмазное напыление или алмазные головки режущих инструментов. Но что на самом деле представляет собой такое понятие, как твердость алмаза, и с чем она связана?

Понятие твердости и ее измерение долгое время оставалось довольно спорным вопросом. Очень долго не могли разработать методику, по которой можно было бы определить количество этого параметра. Пока Моос не придумал измерять этот параметр путем пробы поцарапать один минерал другими минералами. Если один из них поддавался царапанию другим, то ему автоматически присваивалось более низкое значение твердости. Приняв за каждую единицу какой-либо эталон, он разработал собственную шкалу твердости с показателями от 1 до 10.
За 10 баллов отвечала твердость алмаза, эталоном для одного балла твердости стал тальк. Другой распространенный драгоценный камень — корунд, который делится на рубины и сапфиры имеет показатель 9. Таким образом была закреплена такая самая распространенная шкала и соответствующие значения.
Почему алмаз имеет такой высокий показатель твердости? Как оказалось, химическая структура алмаза представляет собой чистый углерод. Тот же самый углерод, который в нормированном состоянии является графитом и твердость по шкале Мооса которого равняется единице.
Почему же тогда они имеют такие разные свойства, если состоят из одного и того же атома? Это происходит за счёт химических связей и строения решетки кристалла. Атомы углерода в этих двух веществах по-разному между собой связаны, что дает разное строение структуры.
Как известно, в природе нет материала, который был бы тверже алмаза. Но недавно учеными было разработано синтетическое вещество, которое, по их заявлению, имеет такой показатель на 58% больше. Это вещество получило название лонсдейлит. Лонсдейлит может выдержать давление, которое на 55 ГПа превышает давление, которое может выдержать самый твердый алмаз.
Его использование практически невозможно из-за высокой стоимости. В применении такого материала особой необходимости нет.
Другие характеристики
Если алмаз самый твердый минерал, означает ли это, что если его невозможно сломать? К сожалению, это не так. Дело в том, что в разных направлениях кристалла его твердость неодинакова. На этом свойстве как раз и основана его огранка, шлифовка и распиловка.
Поэтому прочность алмаза невелика, от сильного удара он может расколоться на части. Это несколько ограничивает его применение. Высокая твердость обуславливает его высокую износостойкость и сопротивление стиранию, но не гарантирует, что алмаз не сломается.
Кажется, что если алмаз имеет такую высокую твердость то как минимум должен быть очень плотным. На самом деле его плотность составляет всего около 3,5 грамма на сантиметр кубический. Это в три раза больше, чем воды, но, например, в шесть раз меньше, чем у золота.
Тем не менее для камня такая плотность является достаточной, можно даже сказать большой, что также влияет на его прочность. Бриллианты имеют характерный блеск и игру цвета, которые объясняются таким параметром, как показатель преломления. Показатель преломления бриллиантов составляет примерно 2,4, что является наибольшим значением для драгоценного камня. Еще одним важным параметром является дисперсия. Дисперсия представляет собой различие показателей преломления в зависимости от длины волны применяемого освещения.

Шкала Мооса
Чем больше показатель дисперсии, тем сильнее выражена игра цветов. У алмазов этот показатель высокий, что и дает ему уникальное сияние. Сочетание преломления и дисперсии, а также твердости минерала, которая позволяет отполировать его без малейшего изъяна или трещины, составляют вместе тот необходимый набор, который делает этот камень самым дорогим в мире.
Алмаз имеет еще одно интересное свойство — он характеризуется самой высокой теплопроводностью, которая является наибольшей среди всех твердых тел. Это позволяет рассматривать его в качестве перспективного полупроводника для применения в электронике. Однако это возможно только при условии, что научатся синтезировать дешевые алмазы. Кремниевые полупроводники могут работать при температуре до 100 градусов по Цельсия в то время, как микросхема на алмазах будет выдерживать намного большие температуры.
Алмаз не растворяется в кислотах и щелочах. Обладает низким коэффициентом трения в воздухе, что происходит за счёт образования пленок абсорбера на поверхности камня. Температура плавления составляет 3500-4000 градусов Цельсия при определенных условиях давления. Если он находится на воздухе при температуре около 860 градусов, начинается процесс горения. Если его нагревать до высокой температуры без доступа кислорода, он переходит в углерод за несколько минут.
Структура кристаллической решетки
В конце XVIII века была обнаружено, из чего состоит алмаз. После этого было сделано огромное количество попыток, чтобы получить его в лабораторных условиях. Для этого были проведены эксперименты с техническими условиями, так как долго не могли понять при каких именно он образуется.
Как оказалось, алмаз состоит из атомов углерода, которые соединяются между собой в пространстве в особом порядке. Такой порядок называется кристаллической решеткой. Расположение частиц и тип такой решетки как раз и задают плотность алмаза и его твердость. Каждая ячейка имеет форму куба, поэтому кристаллическая решетка называется кубической.
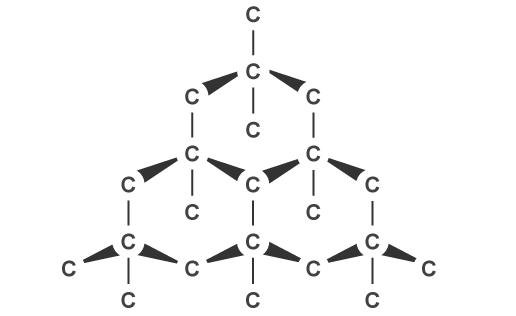
Атомы расположены в порядке тетраэдра, между которыми действуют ковалентные связи. Каждый атом связан с четырьмя другими и поэтому имеет наивысший возможный показатель валентности для углерода. Последнее приводит к тому, что все связи заняты и не взаимодействуют со сторонними веществами. Именно такой тип решетки и объясняет высокую твердость алмазов.
Ещё известны две разновидности кристаллического вещества, которые состоят из атомов углерода: углерод и лонсдейлит, который был описан выше. Такой минерал встречается в останках метеорита. Графит же можно увидеть на каждом шагу. Отличия в кристаллической решетке между графитом и алмазом приводит к тому, что графит имеет очень мягкую структуру и легко слоится, тогда как алмаз почти ничем нельзя поцарапать.
У графита решетка имеет гексагональный характер. Частицы углерода расположены слоями, дистанция между которыми больше, чем между атомами в одном слое. Это обуславливает такие основные свойства графита, как электропроводность и поглощение света.
Расстояние между атомами кубической решетки алмаза везде имеет одинаковое значение — этим объясняется прозрачность минерала и его способность оказывать сопротивление и не проводить электрический ток. В минерале могут содержаться такие металлы в виде примесей:
- магний;
- алюминий;
- кремний;
- гранит;
- кальций.
Часто встречаются кристаллы с включением воды, углекислоты или других газообразных веществ.
Примеси неравномерно распределяются и больше всего их наблюдается на периферии кристалла. Такой тип кристаллической структуры встречается и у других элементов 4 группы с такой валентностью. Однако по мере увеличения атомной массы расстояние между ними растет и прочность ковалентной связи падает. Поэтому алмаз имеет самую высокую прочность, так как его атомы расположены ближе всего.
Благодаря своей прочности, алмаз находит применение не только в ювелирном деле, но и в промышленности. Например, используются в строительстве и когда нужно просверлить что-нибудь или обрезать в сложных конструкциях из бетона и стали. Кроме того, алмазные конструкции используются в ремонте для резки по граниту, мрамору и другим твердым материалам.
Используется минерал в точном приборостроении и для изготовления инструмента начиная от любительских пил и ножниц по металлу, стеклорезов, фрез, шлифовальных кругов и заканчивая инструментами хирурга и космическими носителями.
Строительство тоннелей и прокладка кабелей невозможны без этого материала. Проходческий комбайн, ножи которого покрыты тонким напылением алмазной крошки, применяются там, где невозможно построить туннель другим способом. В медицине применяются скальпели из алмаза, где невозможно использовать обычный. Ведутся активные разработки медицинского лазера, в котором он будет использоваться в качестве полупроводника.
В телекоммуникациях и электронике алмаз используют для прохождения сигналов разных частот по одному кабелю. В качестве защитного элемента используется в лабораторном оборудовании для физических и химических научных исследований.
Постоянно ведутся новые разработки возможности получения синтетических алмазов высокого качества и небольшой цены для того, чтобы широко использовать его во всех сферах промышленности. Твердость этого камня также влияет на его высокие показатели износостойкости при использовании в ювелирном деле.
Источник: okaratah.com