Смесь бромида и хлорида калия массой 0,4934 г растворили в воде и обработали раствором нитрата серебра до полного осаждения бромида и хлорида серебра. Полу ченный осадок восстановили с образованием металлического серебра и высушили до постоянного веса. Масса полученного серебра составила 0,5494 г. Каков процентный состав исходной смеси (по массе)?
В смеси содержалось $x$ г $KBr$ и $y$ г $KCl$. При добавлении раствора нитрата серебра выпал осадок галогенидов серебра
$KBr + AgNO_3 = AgBr + KNO_3$, $KCl + AgNO_3 = AgCl + KNO_3$.
При восстановлении галогенидов было получено металлическое серебро
$2AgBr + Zn = 2Ag + ZnBr_2$,
$2AgCl + Zn = 2Ag + ZnCl_2$.
1 моль $KBr$ ($M = l19,01$) образует 1 моль $AgBr$, который при восстановлении дает 1 моль серебра ($A = 107,88$), следовательно, из $x$ г $KBr$ будет получено $m_1 = (NULL,88 cdot x)/119,01$ г $Ag$.
1 моль $KCl$ ($M = 75,58$) образует 1 моль $AgCl$, из которого получается 1 моль $Ag$ ($A = 107,88$), отсюда
Смесь нитрата меди(II) и нитрата серебра по 0,1 М и объемом по 400 мл была подвергнута электролизу
$m_2 = (NULL,88 cdot y)/74,01$ г $Ag$.
Составляем систему алгебраических уравнений
$begin x + y = 0,4934 (: масса : смеси : галогенидов) \ frac + frac = 0,5494 (: масса : серебра) end$, $x = 0,4934 — y$.
$frac + frac = 0,5494$, $y = 0,1868 : г KCl$, $x = 0,3066 : г KBr$.
(Составление и решение системы упрощается, если массу серебра выразить в молях: $(NULL,5494 : 107,88) = 0,005$, тогда
$left . begin 119,01x + 74,01y = 0,4934 \ x + y = 0,005 end right | begin ~ \ cdot 74,1 end$
$119,01x + 74,01y = 0,4934$
$-$
$underline$
$45x = 0,1165$
$x = 0,0259$ моля, или $0,0259 cdot 119,01 = 0,31$ г, $KBr$.)
Источник: calcsbox.com
Количественное осаждение хлорида калия нитратом серебра
Задача 137.
Написать уравнения реакции осаждения, рассчитать объём осадителя, необходимый для проведения количественного осаждения, и описать условия осаждения. Исследуемое вещество KCl, навеска массой 1,50г; осадитель AgNO3, концентрация 10%.
Решение:
Схема реакции осаждения:
Так как вещества реагируют в химических реакциях равным числом грамм-эквивалентов, то
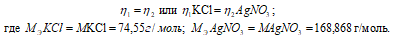
Согласно закону равенства эквивалентов:

Рассчитаем массу AgNO3:
m(AgNO3) = MЭ(AgNO3) . n(AgNO3) = (74,55 . 0,02) = 1,5г.
Теперь рассчитаем объём раствора AgNO3, теоретически необходимый для осаждения 1,50г KCl из пропорции:
100 : 10 = х : 1,5;
х = (1,5 . 100)/10 = 15см 3 .
Для полного осаждения необходимо брать полуторный избыток раствора осадителя от теоретически расчётного, т.е. объём (BaCl2 . 2H2O, необходимый для осаждения:
V(BaCl2 . 2H2O) = (1,5 . 15) = 22,5см3.
Смесь растворов нитрата меди(II) и нитрата серебра по 0,1 М и объемом по 400 мл была подвергнута
Условия осаждения:
Определение осложняется тем, что AgCl склонен к образованию очень мелких кристаллов, проходящих через поры фильтра, что затрудняет фильтрование и приводит к потерям. Поэтому в начале осаждения создают условия, обеспечивающие получение крупных кристаллов:
- медленно прибавляют осадитель, что необходимо также и для получения более чистого осадка;
- повышают температуру раствора, что, в свою очередь, также повышает растворимость осадка.
Для обеспечения полноты осаждения в конце процесса добавляют избыток осадителя, фильтрование осадка проводят после охлаждения раствора.
Ответ: V(AgNO3) = 22,5см 3 .
Задача 138.
Написать уравнения реакции осаждения, рассчитать объём осадителя, необходимый для проведения количественного осаждения, и описать условия осаждения. Исследуемое вещество KCl, навеска массой 0,90г; осадитель AgNO3, концентрация 0,2N.
Решение:
Схема реакции осаждения:
Так как вещества реагируют в химических реакциях равным числом грамм-эквивалентов, то
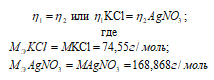
Согласно закону равенства эквивалентов:
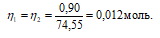
Теперь рассчитаем объём раствора AgNO3, теоретически необходимый для осаждения 0,90г KCl из пропорции:
1000 : 0,2 = х : 0,012;
х = (0,012 . 1000)/0,2 = 60см 3 .
Для полного осаждения необходимо брать полуторный избыток раствора осадителя от теоретически расчётного, т.е. объём (BaCl2 . 2H2O, необходимый для осаждения:
V(BaCl2 . 2H2O) = (1,5 . 60) = 90см 3 .
Условия осаждения:
Определение осложняется тем, что AgCl склонен к образованию очень мелких кристаллов, проходящих через поры фильтра, что затрудняет фильтрование и приводит к потерям. Поэтому в начале осаждения создают условия, обеспечивающие получение крупных кристаллов:
- медленно прибавляют осадитель, что необходимо также и для получения более чистого осадка;
- повышают температуру раствора, что, в свою очередь, также повышает растворимость осадка.
Для обеспечения полноты осаждения в конце процесса добавляют избыток осадителя, фильтрование осадка проводят после охлаждения раствора.
Ответ: V(AgNO3) = 90см 3 .
- Вы здесь:
- Главная

- Задачи

- Аналитическая химия

- Определение веществ в образце суперфосфата. Задачи 66 — 67
Источник: buzani.ru
В результате взаимодействия растворов нитрата серебра и хлорида калия, взятого в избытке, выпал осадок массой 2,87 г. Вычислите массу
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
- Обратная связь
- Правила сайта
Источник: www.soloby.ru