Пример 15. При сгорании магния массой 6 г образовалось 9,945 г оксида. Чему равна молярная масса эквивалента магния?
Решение. По закону эквивалентов: m1/m2 = mЭ1/mЭ2, где m1 и m2 –массы взаимодействующих веществ, mЭ1 и mЭ2 – молярные массы эквивалентов этих веществ. Подставляем данные: 6/(9,945-6) = mЭ(Mg)/8, Отсюда
mЭ(Mg) = 6·8/3,945 = 12,2 г/моль ( 8 г/моль – молярная масса эквивалента кислорода).
Ответ: mЭ(Mg) = 12,2 г/моль.
Пример 16. Вычислите молярную массу эквивалента KHSO4 в следующих реакциях:
Решение. Значение эквивалента вещества зависит от того, в какой конкретной реакции участвует это вещество.
Молярная масса эквивалента основания может быть вычислена как частное от деления молярной массы основания на его кислотность, определяемую числом вступающих в реакцию гидроксильных групп.
Для вычисления молярной массы эквивалента кислоты необходимо молярную массу кислоты разделить на ее основность, которая определяется числом атомов водорода, замещающихся на атомы металла.
Реакция серебра и азотной кислоты
Для того чтобы вычислить молярную массу эквивалента соли, надо молярную массу соли разделить на произведение числа атомов металла в молекуле соли на его степень окисления.
В реакции (1) 1 моль KHSO4 взаимодействует с 1 моль BaCl2, а эквивалент KHSO4 – c эквивалентом BaCl2. Молярная масса эквивалента BaCl2 равна половине его молярной массы, следовательно, молярная масса эквивалента KHSO4 равна половине его молярной массы:
В реакции (2) 1 моль KHSO4 взаимодействует с 1 моль КОН, а эквивалент KHSO4 – с эквивалентом КОН. Молярная масса эквивалента КОН равна его молярной массе, а, значит, молярная масса эквивалента KHSO4 равна его молярной массе, т.е. 136 г/моль.
Пример 17. На нейтрализацию 0,728 г щелочи израсходовано 0,535 г HNO3. вычислить молярную массу эквивалента щелочи.
Решение. Молярная масса эквивалента HNO3 равна ее молярной массе 63 г/моль. В соответствии с законом эквивалентов:
mЭ(щелочи) = 0,728·63/0,535 = 85,7 г/моль.
Ответ: mЭ(щелочи) = 85,7 г/моль.
Задания
1. Сколько граммов оксида ртути потребуется для получения 10 моль кислорода?
2. Даны 40 мл газа при температуре 7 0 С и давлении 96 кПа. При каком давлении объем газа достигнет 60 мл, если температура возросла до 17 0 С?
3. Определить молярные массы газов, если:
а) 0,29 л газа при температуре 27 °С и давлении 1,064 10 5 Па имеют массу 0,32 г;
б) 1,56 л газа при температуре 27° С и давлении 1,037 10 5 Па имеют массу 2,86 г.
4. Вычислить молярную массу эквивалента олова, если при нагревании 0,92 г его в токе кислорода образуется 1,17 г оксида олова.
5. Избытком гидроксида калия подействовали на растворы: а) дигидрофосфата калия; б) нитрата дигидроксовисмута(III). Напишите уравнения реакций этих веществ с КОН и определите количество вещества эквивалента и молярные массы эквивалента.
6. Определить массу сульфида железа, которая получится при нагревании 7 г железа с 7 г серы.
Особенности серной и азотной кислот | Химия ЕГЭ, ЦТ
7. Найти формулу кристаллогидрата хлорида бария, зная, что 36,6 г соли при прокаливании теряют в массе 5,4 г.
8. Составьте уравнения реакций, с помощью которых можно осуществить указанные превращения:
1. В какой массе азота содержится 10 24 молекул? Определите массу (в граммах) 3 молей атомов и 3 молей азота.
2. Какой объем при Р = 1,013 10 5 Па и Т == О °С займет 1 кг смеси газов, имеющих состав [в % (масс.)]: 20% NO: 40% N2 и 40% CO2.
3. Вычислите объем кислорода (н. у.), образующегося при разложении 2 моль воды.
4. Вычислить молярную массу эквивалента олова, если при восстановлении 1,17 г оксида олова водородом получено 0,16 г воды.
5. Определите количество вещества эквивалента и молярную массу эквивалентов фосфора, кислорода и брома в соединениях РН3, Н2О, HBr.
6. Воспламенилась смесь, состоящая из 4 мл водорода и 4 мл кислорода. Какой газ был в избытке? Каков его объем?
7. При прокаливании 2,94 г кристаллогидрата хлорида кальция выделилось 1,45 г воды. Составить формулу данного кристаллогидрата.
8. Составьте уравнения реакций, с помощью которых можно осуществить указанные превращения:
1. Сколько молей составляют: а) 0,8 кг СuО, б) 212 кг Na2CO3, в) 8 г NaOH?
2. В закрытом баллоне находится газ под давлением в 405,2 кПа. Какую часть газа следует выпустить из баллона, чтобы давление в нем достигло 152 кПа?
3. Из скольких атомов состоят молекулы: а) паров серы при температуре 950 0 С, если плотность их по воздуху равна 2,2; б) паров сурьмы при 2000 0 С, если плотность их по водороду равна 60,88?
4. Вычислить молярную массу эквивалента магния, если при нагревании в токе кислорода масса его увеличилась на 66,7 %.
5. Избытком соляной кислоты подействовали на растворы: а) гидрокарбоната кальция; б) дихлорида гидроксоалюминия. Напишите уравнения этих реакций и определите количество вещества эквивалента и молярные массы эквивалента.
- Для реакции взяли 22 г сульфида железа и соляную кислоту. Сколько литров сероводорода выделится при н.у. в результате реакции?
- Определите простейшую формулу соединения алюминия с углеродом, если известно, что массовая доля алюминия в нем составляет 75%.
- Составьте уравнения реакций, с помощью которых можно осуществить указанные превращения: Zn → K2ZnO2; S → H2SO3.
Источник: studfile.net
Решебник по химии за 9 класс к дидактическому материалу А.М.Радецкий
Все главы
Начните вводить часть условия (например, могут ли , чему равен или найти ):
Тема I. Электролитическая диссоциация. Работа 1. Электролитическая диссоциация веществ и реакции ионного обмена
Тема I. Электролитическая диссоциация. Работа 3. Химические свойства кислот, солей и оснований в свете теории электролитической диссоциации
Тема I. Электролитическая диссоциация. Работа 4. Расчеты по уравнениям реакций, если одно из реагирующих веществ дано в избытке
- 1. Рассчитайте массу осадка, который образуется при сливании растворов, один из которых содержит 280 г нитрата бария, а другой — 220 г сульфата калия.
- 2. К раствору, в котором находится нитрат алюминия массой 42,6 г, прилили раствор, содержащий 16 г гидроксида натрия. Рассчитайте массу образовавшегося осадка. (Ответ: 10.4 г.)
- 3. Какой объем газа (н. у.) выделится, если к раствору, содержащему 53 г карбоната натрия, прилить раствор азотной кислоты массой 400 г с массовой долей кислоты 20%? (Ответ: 11,2 л.)
- 4. Рассчитайте массу нитрата магния, образующегося при взаимодействии 20 г оксида магния с раствором, содержащим 94.5 г азотной кислоты. (Ответ: 74 г.)
- 5. К раствору, содержащему 40 г сульфата меди(II), прибавили 12 г железных стружек. Рассчитайте, останется ли в растворе сульфат меди(II) после того, как закончится реакция.
- 6. Рассчитайте массу осадка, который образуется при сливании 15 г 5%-ного раствора хлорида бария и 10 г 8%-ного раствора сульфата натрия.
- 7. К 400 г 5%-ного раствора сульфата железа(III) прилили 200 г 3%-ного раствора гидроксида натрия. Вычислите массу образовавшегося осадка.
- 8. К раствору, содержащему 16 г сульфата меди(II), прибавили 12 г железных стружек. Рассчитайте массу меди, выделившейся при этом.
- 9. Рассчитайте массу осадка, образующегося при сливании 200 г 20%-ного раствора гидроксида натрия с раствором, содержащим 3 моль сульфата меди(II).
- 10. Рассчитайте объем газа (н. у.), который выделится при сливании 150 г 30%-ной соляной кислоты с раствором карбоната натрия, содержащим 0,5 моль этой соли.
- 11. Слили 40 г 10%-ного раствора серной кислоты с раствором нитрата бария, содержащим 2,61 г соли. Рассчитайте массу образовавшегося осадка.
- 12. 10 г оксида магния обработали раствором, содержащим 40 г азотной кислоты. Рассчитайте массу образовавшейся соли.
- 13. Рассчитайте массу сульфата бария, образующегося при взаимодействии 200 г 7%-ного раствора серной кислоты с раствором хлорида бария, содержащим 2 моль этой соли.
- 14. Рассчитайте массу нитрата цинка, который образуется при взаимодействии 16,2 г оксида цинка с раствором, содержащим 30 г азотной кислоты.
- 15. К раствору, содержащему 39 г сульфида натрия, прилили раствор, содержащий 80 г хлорида цинка. Рассчитайте массу образовавшегося осадка.
- 16. К раствору, содержащему 32 г сульфата меди(II), прибавили 28 г железных стружек. Рассчитайте массу выделившейся меди.
- 17. 5 г оксида магния обработали раствором, содержащим
- 31,5 г азотной кислоты. Рассчитайте массу образовавшейся соли.
- 18. К раствору, содержащему 20 г гидроксида натрия, прилили раствор, содержащий 73 г хлороводорода. Рассчитайте массу образовавшейся соли.
- 19. Цинк массой 6,5 г поместили в раствор, содержащий 49 г серной кислоты. Рассчитайте массу выделившегося водорода.
Тема I. Электролитическая диссоциация. Работа 5. Итоговая по теме I
Тема II. Подгруппа кислорода. Основные закономерности течения химических реакций. Работа 1. Кислород. Сера. Серная кислота
Тема II. Подгруппа кислорода. Основные закономерности течения химических реакций. Работа 2. Скорость химических реакций. Химическое равновесие.
Тема II. Подгруппа кислорода. Основные закономерности течения химических реакций. Работа 3. Итоговая по теме II
Тема III. Подгруппа азота. Работа 1. Азот. Аммиак. Соли аммония
Тема III. Подгруппа азота. Работа 2. Азотная кислота и ее соли
Тема III. Подгруппа азота. Работа 3. Фосфор и его соединения
Тема III. Подгруппа азота. Работа 4. Расчеты по определению массовой или объемной доли выхода продукта реакции от теоретически возможного и обратные задачи
- 1. На гидроксид натрия, взятый в необходимом количестве, подействовали раствором, содержащим 252 г азотной кислоты. Вычислите массу полученной соли, если массовая доля выхода составляет 90%. (Ответ: 306 г.)
- 2. Вычислите объем аммиака (н. у.), который можно получить при нагревании 20 г хлорида аммония с избытком гидроксида кальция, если объемная доля выхода аммиака составляет 98%.
- 3. Из 28 г оксида кальция получили 76 г нитрата кальция. Вычислите массовую долю выхода соли. (Ответ: 92,7%.)
- 4. Рассчитайте массу аммиака, который можно получить, нагревая смесь 20 г хлорида аммония и 20 г оксида кальция, приняв, что массовая доля выхода аммиака составляет 98%. (Ответ: 6,2 г.)
- 5. При нагревании нитрита аммония NH4NO2 образуются азот и вода. Вычислите объем азота (н. у.), который можно получить при разложении 128 г нитрита аммония, если объемная доля выхода азота составляет 90%. (Ответ: 40,3 л.)
- 6. Азот объемом 56 л (н. у.) прореагировал с водородом, взятым в избытке. Массовая доля выхода аммиака составила 50%. Рассчитайте массу и объем полученного аммиака. (Ответ: 42,5 г; 56 л.)
- 7. При разложении хлорида аммония массой 107 г получен аммиак объемом 38 л (н. у.). Вычислите объемную долю выхода аммиака. (Ответ: 84,8%.)
- 8. Вычислите массу фосфора, необходимого для получения 200 кг фосфорной кислоты, если массовая доля выхода кислоты составляет 90%. (Ответ: 70,3 кг.)
- 9. Какой объем аммиака (н. у.) можно получить, нагревая смесь 33 г сульфата аммония с избытком гидроксида кальция, если объемная доля выхода аммиака составляет 85%? (Ответ: 9,5 л.)
- 10. Рассчитайте массу меди, вступившей в реакцию с избытком концентрированной азотной кислоты, если получили 4 л оксида азота(IV) (н. у.), объемная доля выхода которого составила 96%. (Ответ: 5,9 г.)
- 11. Вычислите объем аммиака (н. у.), который можно получить, нагревая 30 г хлорида аммония с избытком гидроксида кальция, если объемная доля выхода аммиака составляет 94%. (Ответ: 11,8 л.)
- 12. Вычислите массу азотной кислоты, которую можно получить из 20,2 г нитрата калия при его взаимодействии с концентрированной серной кислотой, если массовая доля выхода азотной кислоты составляет 98%. (Ответ: 12,4 г.)
- 13
- 14
Тема III. Подгруппа азота. Работа 5. Итоговая по теме III
Тема IV. Подгруппа углерода. Работа 1. Углерод. Оксиды углерода
Тема IV. Подгруппа углерода. Работа 2. Угольная кислота и ее соли
Тема IV. Подгруппа углерода. Работа 3. Кремний и его соединения
Тема IV. Подгруппа углерода. Работа 4. Вычисление массы или объема продукта реакции по известной массе или по объему исходного вещества, содержащего примеси
Тема IV. Подгруппа углерода. Работа 5. Итоговая по теме IV
Тема V. Общие свойства металлов. Работа 1. Способы получения металлов
Тема V. Общие свойства металлов. Работа 2. Химические свойства металлов
Тема V. Общие свойства металлов. Работа 3. Электролиз. Коррозия металлов
Тема V. Общие свойства металлов. Работа 4. Щелочные и щелочно-земельные металлы
Тема V. Общие свойства металлов. Работа 5. Алюминий и его соединения
Тема V. Общие свойства металлов. Работа 6. Итоговая по теме V
Тема VI. Железо. Металлургия. Работа 1. Железо и его соединения
Тема VI. Железо. Металлургия. Работа 2. Способы промышленного получения металлов
- 1. Гидроксид натрия может быть получен известковым способом при нагревании раствора соды Na2CO3 с гашеной известью Са(ОН)2. Рассчитайте массу соды, содержащей 2% примесей, которая потребуется для получения 10 кг гидроксида натрия. Как выделить гидроксид н
- 2. В природе ртуть чаще всего встречается в виде киновари HgS. Для получения ртути киноварь обжигают, при этом образуются ртуть и оксид серы(IV). Пары ртути конденсируются в охлажденном приемнике. Рассчитайте массу ртути, образовавшейся при обжиге 600 кг
- 3. Человек ежедневно употребляет с пищей в среднем 3 г калия. Рассчитайте массу картофеля, содержащего 0,6% этого элемента, который удовлетворит суточную потребность человека в калии. (Ответ: 500 г.)
- 4. Поваренная соль, поступающая в торговую сеть, состоит из хлорида натрия и примесей — воды и нерастворимого осадка. Какова массовая доля примесей в соли с массовой долей натрия 38%? Массовая доля натрия в чистом хлориде натрия составляет 39,3%. (Ответ:
- 5. Технический марганец можно получить алюминотермическим способом: 3Mn3O4 + 8Al = 9Mn + 4Al2О3 + 2500 кДж. Рассчитайте массу образовавшегося марганца и количество выделившейся теплоты, если в реакцию вступил Mn3O4 массой 458 г. (Ответ: 330 г; 1666,7 кДж.
- 6. В чистом виде золото и серебро — мягкие металлы. Для повышения механической прочности их сплавляют с медью. Число частей золота или серебра, приходящееся на 1000 частей сплава, называют пробой. Рассчитайте массу: а) золота в сплаве 750-й пробы массой 8
- 7. Кальцинированную соду используют в производстве стекла. Рассчитайте массу кальцинированной соды, необходимой для получения 1 т стекла с массовой долей оксида натрия 17%. (Ответ: 291 кг.)
- 8. Практическое значение имеет реакция пероксида натрия с оксидом углерода(IV): На этой реакции основано применение пероксида натрия (вместе с K2O4) для регенерации воздуха в изолированных помещениях. Рассчитайте объем оксида углерода(IV) (н. у.), котор
- 9. Рассчитайте массу известняка с массовой долей карбоната кальция 95%, которая израсходуется на производство гашеной извести массой 60 кг с массовой долей гидроксида кальция 86%. (Ответ: 73,4 кг.)
- 10.
Источник: 5terka.com
Готовимся к углубленному изучению химии
В отличие от других элементов азот образует большое число оксидов: N2O, NO, N2O3, NO2, N2O4, N2O5. Все оксиды азота термодинамически неустойчивы к распаду на простые вещества, однако при 700 °С реакция разложения оксидов кинетически заторможена. Рассмотрим свойства оксидов.
Оксид азота (I) N2O
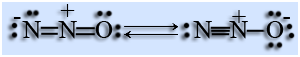
Строение молекулы
Молекула N2O линейная, малополярная, её строение описывается при помощи двух резонансных структур. Связь между атомами азота равна 0,113 нм, она сравнима с длиной тройной связи.
Физические свойства
При комнатной температуре оксид азота (I) N2O – бесцветный газ, без запаха, сладковатый на вкус, растворим в воде, при 0 °С 1 объем газа растворяется в 1 объеме воды. Температура плавления -91 °С, температура кипения -89 °С. При вдыхании вызывает судорожный смех, поэтому имеет название «веселящий газ».
Химические свойства
Оксид азота (I) не взаимодействует с водой. Несолеобразующий оксид. Проявляет окислительные свойства, в нем, как и в кислороде, вспыхивает тлеющая лучина и ярко горит сера.
При нагревании выше 600 °С разлагается со взрывом:
2N2O = 2N2 + O2.
Взаимодействует с водородом:
N2O + H2 = N2 + H2O.
При поджигании смеси оксида азота (I) и аммиака происходит взрыв:
3N2O + 2NH3 = 4N2 + 3H2O.
При взаимодействии с сильными окислителями проявляет восстановительные свойства:
5N2O + 2KMnO4 + 3H2SO4 = 10NO + 2MnSO4 + K2SO4 + 3H2O.
Получение
Оксид азота (I) получают термическим разложением нитрата аммония при температуре около 200 °С:
NH4NO3 = N2O + 2H2O,
нагревание нужно проводить очень осторожно, перегрев и использование больших количеств нитрата может привести к взрыву.
Оксид азота (II) NO
Строение молекулы
Молекула NO малополярная, линейная, длина связи составляет 0,115 нм, её строение описывается двумя резонансными структурами, обе формы имеют один неспаренный электрон, поэтому молекула является радикалом, но при обычных условиях не склонна к димеризации.

Физические свойства
При комнатной температуре оксид азота (II) NO – бесцветный газ, без вкуса и запаха. Растворим в воде, при 0 °С 5 мл газа растворяется в 100 мл воды. Температура плавления -164,4 °С, температура кипения -152,2 °С.
Химические свойства
Оксид азота (II) не взаимодействует с водой. Несолеобразующий оксид. Проявляет восстановительные свойства.
Он легко окисляется кислородом:
2NO + O2 = 2NO2.
Взаимодействует с перманганатом калия в кислой среде:
5NO + 3KMnO4 + 2H2SO4 = 2MnSO4 + 3KNO3 + Mn(NO3)2 + 2H2O.
С хорошими восстановителями проявляет окислительные свойства, и восстанавливается до азота:
Реагирует с сернистым газом:
2NO + 2SO2 = 2SO3 + N2.
При использовании родиевого катализатора окисляет угарный газ в углекислый:
2NO + 2CO = 2CO2 + N2,
такие катализаторы устанавливаются в выхлопных трубах автомобилей.
Не реагирует с кислотами, при взаимодействии с расплавленной щелочью диспропорционирует:
6NO + 4KOH = N2 + 4KNO2 + 2H2O.
Получение
В лаборатории получают действием на медь разбавленной азотной кислоты:
3Cu + 8HNO3 = 2NO + 3Cu(NO3)2 + 4H2O.
В промышленности получают каталитическим окислением аммиака на платино-родиевом катализаторе при 700 °С:
4NH3 + 5O2 = 4NO + 6H2O.
В атмосфере образуется из простых веществ в грозовых разрядах:
N2 + O2 = 2NO.
Оксид азота (III) N2O3
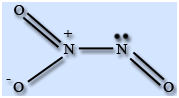
Строение молекулы
Молекула N2O3 плоская и состоит из фрагментов ON – NO2 c непрочной связью N – N. У атома азота имеется неподеленная пара электронов. Твердый оксид азота (III) – ионное соединение.
Физические свойства
Оксид азота (III) N2O3 – крайне неустойчивое соединение и существует только при низких температурах, выше 0 °С оно разлагается. Температура плавления -100 °С, температура кипения -40 °С. В твердом и жидком состоянии окрашен в синий цвет.
Химические свойства
Оксид азота (III) – типичный кислотный оксид, взаимодействует с водой с образованием азотистой кислоты:
N2O3 + H2O = 2HNO2.
При взаимодействии со щелочами образуются соли азотной кислоты – нитриты:
N2O3 + 2NaOH = 2NaNO2 + H2O.
Получение
1. Образуется при охлаждении до -36 °С смеси оксидов азота (II) и (IV):
NO + NO2 = N2O3.
2. При взаимодействии 50 %-ной азотной кислоты с оксидом мышьяка (III) при низкой температуре:
2HNO3 + As2O3 + 2H2O = 2H2AsO4 + N2O3.
3. При обезвоживании азотистой кислоты:
NaNO2 + H2SO4 = NaHSO4 + HNO2;
2HNO2 = N2O3 + H2O.
Оксид азота (IV) NO2 и N2O4
Строение молекулы
Оксид азота (IV) в широком интервале температур существует в виде равновесной смеси мономера NO2 и димера N2O4.
Молекула NO2 имеет угловую форму, предполагается, что атом азота находится в состоянии sp 2 -гибридизации, длина связи N – O равна 0,119 нм, что соответствует полуторной связи.
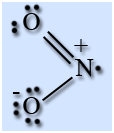
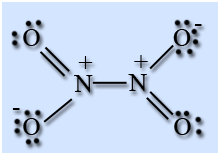
На атоме азота имеется неспаренный электрон, поэтому он легко димеризуется с образованием димера N2O4. Молекула N2O4 плоская и состоит из фрагментов2ON – NO2 c непрочной связью N – N.
Физические свойства
Оксид азота (IV) NO2 – бурый газ, с резким удушливым запахом, ядовит, N2O4 – бесцветен. Твердый оксид азота (IV) бесцветен и состоит только из молекул N2O4. При его нагревании до температуры плавления -12,8 °С появляется бурая окраска, которая усиливается при повышении температуры и увеличения доли мономера в смеси. Температура кипения 21,5 °С.
Химические свойства
Оксид азота, и мономер, и димер, хорошо растворим в воде, и взаимодействует с ней:
2NO2 + H2O = HNO3 + HNO2,
при этом происходит диспропорционирование на азотную и азотистую кислоты.
При температуре выше 0 °С реакция протекает по другому:
3NO2 + H2O = 2HNO3 + NO.
Если через воду пропускать смесь оксида азота (IV) и воздуха, то образуется только азотная кислота:
4NO2 + 2H2O + О2 = 4HNO3.
Диоксид азота – сильный окислитель, в его атмосфере горят углерод и сера:
С + 2NO2 = CO2 + 2NO;
S + 2NO2 = SO2 + 2NO.
Получение
В лаборатории образуется при взаимодействии меди с горячей концентрированной азотной кислотой:
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O;
при термическом разложении высушенных нитратов тяжелых металлов:
2Pb(NO3)2 = 2PbO + 4NO2 + O2.
В промышленности окисление оксида азота (II) кислородом:
2NO + O2 = 2NO2,
реакция является обратимой.
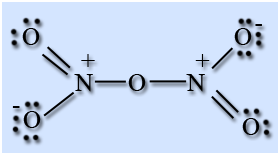
Оксид азота (V) N2O5
Строение молекулы
Оксид азота (V) – ангидрид азотной кислоты, построен из ионов NO2 + и NO3 — , в газовой фазе и растворе состоит из молекул N2O5.
Физические свойства
Азотный ангидрид – бесцветные гигроскопичные кристаллы, температура сублимации 32,3 °С. Неустойчив и в течение нескольких часов распадается, при нагревании – со взрывом.
Химические свойства
Разложение:
2N2O5 = 4NO2 + O2.
При растворении в воде образует азотную кислоту:
N2O5 + H2O = 2HNO3.
Является сильным окислителем:
N2O5 + I2 = I2O5 + N2.
Получение
1. Образуется при пропускании азотной кислоты через колонку с оксидом фосфора (V):
2HNO3 + P2O5 = N2O5 + 2HPO3,
реакция протекает при -10 °С.
2. Получается при окислении оксида азота (IV) озоном:
2NO2 + O3 = N2O5 + O2.
HNO3 — Азотная кислота
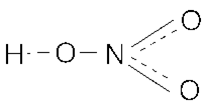
Опытным путём доказано, что в молекуле азотной кислоты между двумя атомами кислорода и атомом азота две химические связи абсолютно одинаковые – полуторные связи. Степень окисления азота +5, а валентность равна IV .
Физические свойства
Азотная кислота HNO 3 в чистом виде — бесцветная жидкость с резким удушливым запахом, неограниченно растворимая в воде; t°пл.= -41°C; t°кип.= 82,6°С, r = 1,52 г/см 3 . В небольших количествах она образуется при грозовых разрядах и присутствует в дождевой воде.
Под действием света азотная кислота частично разлагается с выделением N О2 и за c чет этого приобретает светло-бурый цвет:
N 2 + O 2 грозовые эл.разряды → 2 NO
2NO + O2 → 2NO2
4Н N О3 свет → 4 N О2↑(бурый газ) + 2Н2О + О2
Азотная кислота высокой концентрации выделяет на воздухе газы, которые в закрытой бутылке обнаруживаются в виде коричневых паров (оксиды азота). Эти газы очень ядовиты, так что нужно остерегаться их вдыхания. Азотная кислота окисляет многие органические вещества. Бумага и ткани разрушаются вследствие окисления образующих эти материалы веществ.
Концентрированная азотная кислота вызывает сильные ожоги при длительном контакте и пожелтение кожи на несколько дней при кратком контакте. Пожелтение кожи свидетельствует о разрушении белка и выделении серы (качественная реакция на концентрированную азотную кислоту – жёлтое окрашивание из-за выделения элементной серы при действии кислоты на белок – ксантопротеиновая реакция). То есть – это ожог кожи. Чтобы предотвратить ожог, следует работать с концентрированной азотной кислотой в резиновых перчатках.
Источник: himiy88.blogspot.com