Большинство веществ обладает ограниченной растворимостью в воде. На практике часто приходится встречаться с системами, в которых в состоянии равновесия находятся осадок и насыщенный раствор электролита. В таких случаях скорость процесса растворения осадка будет совпадать со скоростью кристаллизации, и, соответственно, между раствором и осадком наступит динамическое равновесие:  . Константа равновесия данного процесса, как и любой другой гетерогенной реакции, определяется только произведением активностей ионов в растворе и не зависит от активности твердого компонента:
. Константа равновесия данного процесса, как и любой другой гетерогенной реакции, определяется только произведением активностей ионов в растворе и не зависит от активности твердого компонента: 
 . Произведение растворимости соли
. Произведение растворимости соли  (табл. 7). Выразим концентрацию ионов I- через концентрацию ионов свинца, тогда
(табл. 7). Выразим концентрацию ионов I- через концентрацию ионов свинца, тогда  . Отсюда концентрация ионов свинца
. Отсюда концентрация ионов свинца  моль/л, а концентрация ионов иода
моль/л, а концентрация ионов иода  моль/л. Пример 2. Растворимость Ag3PO4 в воде при 20 0 С равна 0,0065 г/л. Рассчитайте значение произведения растворимости. Решение. Найдем молярную концентрацию фосфата серебра:
моль/л. Пример 2. Растворимость Ag3PO4 в воде при 20 0 С равна 0,0065 г/л. Рассчитайте значение произведения растворимости. Решение. Найдем молярную концентрацию фосфата серебра:  = 3107,86 + 31 + 416 = 418,58 г/моль.
= 3107,86 + 31 + 416 = 418,58 г/моль. 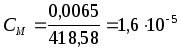 моль/л. При диссоциации одного моля ортофосфата серебра образуется 1 моль фосфат-ионов, PO43- и 3 моля ионов серебра, Ag+ . Поэтому концентрация иона PO43- равна CМ, а концентрация Ag+ в 3 раза больше, т. е.
моль/л. При диссоциации одного моля ортофосфата серебра образуется 1 моль фосфат-ионов, PO43- и 3 моля ионов серебра, Ag+ . Поэтому концентрация иона PO43- равна CМ, а концентрация Ag+ в 3 раза больше, т. е.  Произведение растворимости Ag3PO4
Произведение растворимости Ag3PO4 . Пример 3. Смешаны равные объемы 0,01 М растворов хлорида кальция и сульфата натрия. Образуется ли осадок сульфата кальция? Решение. Найдем произведение концентрации ионов Ca2+ и SO42- и сравним его с произведением растворимости сульфата кальция. Так как при смешивании исходных растворов общий объем раствора вдвое возрастает, то концентрации
. Пример 3. Смешаны равные объемы 0,01 М растворов хлорида кальция и сульфата натрия. Образуется ли осадок сульфата кальция? Решение. Найдем произведение концентрации ионов Ca2+ и SO42- и сравним его с произведением растворимости сульфата кальция. Так как при смешивании исходных растворов общий объем раствора вдвое возрастает, то концентрации  и вдвое уменьшаются по сравнению с исходными. Поэтому
и вдвое уменьшаются по сравнению с исходными. Поэтому =
= = 510 -3 моль/л. Находим произведение концентраций ионов:
= 510 -3 моль/л. Находим произведение концентраций ионов: 
 = (510 -3 ) 2 = 2,510 -5 . По данным табл. 7
= (510 -3 ) 2 = 2,510 -5 . По данным табл. 7  . Найденное значение произведения концентраций ионов меньше этой величины, следовательно, раствор будет ненасыщенным относительно сульфата кальция, и осадок не образуется. ЗАДАЧИ
. Найденное значение произведения концентраций ионов меньше этой величины, следовательно, раствор будет ненасыщенным относительно сульфата кальция, и осадок не образуется. ЗАДАЧИ
 при 25 0 С равно 110 -25 . Рассчитайте концентрации ионов Ca2+ и PO43- в насыщенном растворе Ca3(PO4)2 при этой температуре.
при 25 0 С равно 110 -25 . Рассчитайте концентрации ионов Ca2+ и PO43- в насыщенном растворе Ca3(PO4)2 при этой температуре.- Насыщенный раствор Ag2Cr2O7 объемом 5 л содержит 0,5 моль Na2Cr2O7. Найдите концентрацию ионов Ag+ в этом растворе, если
 и
и  .
. - Определите растворимость Ag2CO3 в воде;
 .
. - Насыщенный при комнатной температуре раствор PbSO4 объемом 3 л содержит 0,132 г соли. Вычислите
 .
.  при 18 0 С составляет 3,210 -8 . Какое количество свинца содержится в 0,4 л насыщенного раствора? Какая масса свинца в виде ионов содержится в 5 л этого раствора?
при 18 0 С составляет 3,210 -8 . Какое количество свинца содержится в 0,4 л насыщенного раствора? Какая масса свинца в виде ионов содержится в 5 л этого раствора?- Раствор содержит ионы SO42- и CrO42- . Концентрация какого иона должна быть больше и во сколько раз, чтобы осаждение сульфата и хромата серебра началось одновременно
 ;
;  .
. - Насыщенный раствор AgIO3 объемом 3 л содержит в виде ионов 0,176 г серебра. Вычислите
 .
. - Какова должна быть минимальная концентрация KBr, чтобы прибавление к его раствору равного объема 0,003 н AgNO3 вызвало появление осадка?
 . Степень диссоциации этих электролитов примите равной единице.
. Степень диссоциации этих электролитов примите равной единице. - Растворимость CaCO3 при 35 0 С равна 6,910 -5 моль/л. Вычислите произведение растворимости этой соли.
- В 500 мл воды при 18 0 С растворяется 0,0166 г Ag2CrO4. Чему равно произведение растворимости этой соли?
- Для растворения 1,16 г PbI2 потребовалось 2 л воды. Рассчитайте произведение растворимости соли.
- Вычислите массу серебра, находящегося в виде ионов в 1 л насыщенного раствора AgBr.
- Образуется ли осадок сульфата серебра, если к 0,02 М раствору AgNO3 добавить равный объем 1 н раствора H2SO4?
- Образуется ли осадок хлорида свинца, если к 0,1 н раствору Pb(NO3)2 добавить равный объем 0,4 н раствора NaCl?
- Вычислите растворимость (в моль/л) CaF2 в воде и в 0,05 М растворе CaCl2. Во сколько раз растворимость во втором случае меньше, чем в первом?
- К 50 мл 0,001 н раствора HCl добавили 450 мл 0,0001 н раствора AgNO3. Выпадет ли осадок хлорида серебра?*
381. Значение ПР для AgCl и Ag2CrO4 равны соответственно 1,6·10 -10 и 1,04 10 -12 . Какое соединение будет осаждаться первым при добавлении одной капли раствора, содержащего Ag + к раствору, состоящему из 0,1М раствора NaCl и 0,1М раствора Na2CrO4. Когда начнет образовываться осадок ионного состава при добавлении раствора, содержащего Ag + (допустим 0,1 М раствор).
Гетерогенное равновесие в системе осадок — насыщенный раствор малорастворимого сильного электролита
Выпадение и растворение осадков солей бария / Precipitation and dissolution of barium salts
Источник: studfile.net
Решение задач по химии на вычисление растворимости солей
Задача 567.
Во сколько раз растворимость S (в молы/л) Fe(OH)2 в воде больше растворимости Fe(OH)3 при 25 °С?
Решение:
Вычислим сначала растворимость Fe(OH)2. Обозначим искомую растворимость Fe(OH)2 через S моль/л. Тогда в
насыщенном растворе Fe(OH)2 содержится 1 S моль/л ионов Fe 2+ и 2 Sмоль/л ионов OH — .
Выражение произведения растворимости гидроксида железа (II) можно записать как
ПР[Fe(OH)2] = [Fe 2+ ] . [OH — ] 2 = S . (2S) 2 = 4S 3 .
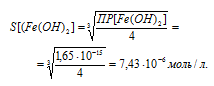
Теперь рассчитаем растворимость Fe(OH)3, обозначив её через S’ моль/л. Тогда в насыщенном растворе Fe(OH)3 содержится S’ моль/л ионов Fe 3+ и 3S’ моль/л ионов OH — .
Выражение произведения растворимости гидроксида железа (III) можно записать как
ПР[Fe(OH)3] = [Fe 3+ ] . [OH — ] 3 = S . (3S) 3 = 27S’ 4 .
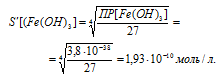
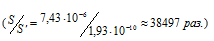
Ответ: в 38497 раз.
Задача 568.
Образуется ли осадок сульфата серебра, если к 0,02 М раствору AgNO3 добавить равный объем 1 н. раствора H2SO4?
Решение:
ПР[Ag2SO4] = 2 . 10 -5 .
При смешении растворов AgNO 3 и H 2 SO 4 происходит реакция, при которой образуется малорастворимое соединение Ag 2 SO 4 . Реакция протекает по схеме:
При смешении растворов AgNO3 и H2SO4 объём смеси увеличится в 2 раза, следовательно, концентрации всех веществ уменьшатся в 2 раза и становятся равными:

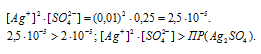
Так как произведение концентраций ионов больше величины произведения растворимости, то осадок соли образуется.
Ответ: Да.
Задача 569.
К 50 мл 0,001 н. раствора НСI добавили 450 мл 0,0001 н. раствора AgNO3. Выпадет ли осадок хлорида серебра?
Решение:
Уравнение реакции имеет вид:
Находим количество HCl в 50 мл 0,001 н раствора из пропорции:
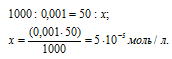
Теперь рассчитаем концентрацию HCl в 500 мл после разбавления водой раствора из пропорции:
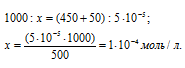
Рассчитаем количество AgNO3, содержащееся в 450 мл 0,0001 н раствора его из пропорции:
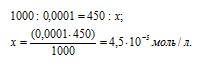
Теперь рассчитаем концентрацию AgNO3 в 500 мл после разбавления водой раствора из пропорции:
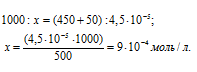
Таким образом, концентрации ионов Ag + и Cl — в 1 л раствора, получим:
[Cl — ] = [HCl] = 1 . 10 -4 моль/л;
[Ag + ] = [AgNO3] = 9 . 10 -4 моль/л.
[Ag + ] . [Cl — ] = (1 . 10 -4 ) . (9 . 10 -4 ) = 9 . 10 -8
Осадок образуется так как [Ag + ] . [Cl — ] > ПР(AgCl); (9 . 10 -4 ) > (1 . 10- 4 ).
Ответ: Да.
Задача 570.
Образуется ли осадок хлорида свинца, если к 0,1 н. раствору Pb(NO3)2 добавить равный объем 0,4 н. раствора NaCl?
Решение:
ПР(PbCl2) = 2,12 . 10 -5 .
Уравнение реакции имеет вид:
При смешивании равных объёмов растворов Pb(NO3)2 и NaCl объём смеси увеличится в 2 раза, следовательно, концентрации веществ уменьшатся в 2 раза и становятся равными:
[Pb 2+ ] =1/2 1/2[Pb(NO3)2] = 0,2/2 = 0,1 моль/л;
[Cl — ] = 1/2[NaCl] = 0,4/2 = 0,2 моль/л.
[Pb 2+ ] . [Cl — ] 2 = 0,1 . (0,2) 2 = 4 . 10 -3 .
Осадок образуется так как [Pb 2+ ] . [Cl — ] 2 > ПР(PbCl2); = (4 . 10 -3 ) > (2,12 . 10 -5 ).
Ответ: Да.
- Вы здесь:
- Главная

- Задачи

- Химия-Глинка

- Растворимость солей | Задачи 567 — 570
Источник: buzani.ru
Образуется ли осадок сульфата серебра, если к 0,02 М раствору AgNO3 добавить равный объем 1 н. раствора H2SO4?


⚡ Условие + 37% решения:
Образуется ли осадок сульфата серебра, если к 0,02 М раствору AgNO3 добавить равный объем 1 н. раствора H2SO4?
Решение: Записываем уравнение реакции образования сульфата серебра 2AgNO3 H2 SO4 2HNO3 Ag2 SO4 В насыщенном растворе малорастворимого сильного электролита устанавливается равновесие между перешедшими в раствор ионами и твердой фазой (осадком). 2 Ag2 SO4 2Ag SO4 Произведение [ ] [ ] 2 4 2 Ag SO является величиной постоянной при данной температуре и носит название произведения растворимости. 2 5 4 2 ( 2 4 ) [ ] [ ] 1,2 10 ПР Ag SO Ag SO В водном растворе нитрат серебра нацело диссоциирует на ионы серебра и нитрат ионы AgNO3 Ag NO3 Молярная концентрация ионов серебра равна молярной концентрации нитрата серебра. С учетом того, что при смешивании равных объемов концентрации каждого из веществ в смеси уменьшаются в 2 раза, молярная концентрация ионов серебра равна М C AgNO Ag M 0,01 2 0,02 2 ( ) [ ] 3
Готовые задачи по химии которые сегодня купили:
- 6 г смеси, состоящей из порошков алюминия и меди, обработали избытком соляной кислоты, при этом выделилось 3,7 л водорода (н.у.).
- Назовите средние соли в соответствии с международной номенклатурой. 19 – Na2SnO3
- Напишите уравнения диссоциации двух данных веществ.
- Для Fe2O3 + 3CO ↔ 2Fe + 3CO2 напишите выражение закона действующих масс для прямой и обратной реакции.
- Железное изделие покрыто никелем. Какое это покрытие – катодное или анодное ?
- Для реакции 4HCl + O2 ↔ 2H2O + 2Cl2 равновесные концентрации равны, соответственно, моль/л: [H2O] = [Cl2] = 0,14; [HCl]=0,26; [O2]=0,38.
- Напишите эмпирические и графические формулы следующих солей: 19 – силиката кальция
- При «растворении» в соляной кислоте 12,9 г сплава, состоящего из меди и цинка, получили 2,24 л водорода (н.у.).
- Напишите в молекулярной и ионной формах уравнения ре-акций гидролиза солей NaCN и FeSO4 , укажите значения рН растворов этих солей (больше или меньше семи).
- При серебрении пластинки площадью 450 см2 получили слой серебра толщиной 0,01 мм





















































Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
Источник: lfirmal.com