Вопрос по химии:
Ребят помогите пожалуйста пропустила тему теперь не знаю что делать.
вопрос: окислительные свойства могут проявлять катионы
1 бериллия
2 серебра
3 лития
4 алюминия
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок — бесплатно!
- bookmark_border
- 18.08.2017 01:34
- Химия
- remove_red_eye 9732
- thumb_up 43
Ответы и объяснения 1
ptlufulds258
Все може (як і твоя мамка)
- 19.08.2017 08:19
- thumb_up 45
Знаете ответ? Поделитесь им!
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете правильный ответ;
- Писать подробно, чтобы ответ был исчерпывающий и не побуждал на дополнительные вопросы к нему;
- Писать без грамматических, орфографических и пунктуационных ошибок.
Этого делать не стоит:
ВСЯ ХИМИЯ за 8 класс в 1 уроке + таймкоды
- Копировать ответы со сторонних ресурсов. Хорошо ценятся уникальные и личные объяснения;
- Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не знаю» и так далее;
- Использовать мат — это неуважительно по отношению к пользователям;
- Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует? Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи — смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
Источник: online-otvet.ru
Общие закономерности изменения свойств простых веществ. Диагональное сходство элементов
Задача 773.
Чем объясняется отличие свойств элементов 2-го периода от свойств их электронных аналогов в последующих периодах?
Решение:
Отличие свойств элементов 2-го периода от свойств их электронных аналогов в последующих периодах объясняется
тем, что атомы элементов 2-го периода во внешнем электронном слое не содержат d-подуровень. Например, элементы главной подгруппы VI группы: О, S, Se, Te, Po являются электронными аналогами, так как их атомы содержат на внешнем электронном слое по шесть электронов, два на s- и четыре на р- подуровне. Электронная конфигурация их валентного слоя имеет вид: ns2np4. Атом кислорода отличается от атомов других элементов подгруппы отсутствием d-подуровня во внешнем электронном слое:
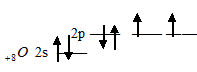
Делаем пиротехнический состав и другие опыты с щелочноземельными металлами
Такая электронная структура атома кислорода не позволяет атому распаривать электроны, поэтому ковалентность кислорода, как правило, равна 2 (число неспаренных валентных электронов). Здесь возрастание числа неспаренных электронов возможно только путём перевода электрона на следующий энергетический уровень, что, естественно, сопряжено с большой затратой энергии. Атомы элементов последующих периодов +16S, +34Se, +52Te и +84Po на валентном электронном слое имеют свободные d-орбитали:
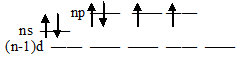
Такая электронная структура атомов позволяет атомам данных элементов распаривать электроны, поэтому в возбуждённом состоянии число неспаренных электронов увеличивается за счёт перевода s- и р- электронов на свободные d-орбитали. В связи с этим указанные элементы проявляют ковалентность равную не только 2, но и 4, и 6:

а) (ковалентность – 4)
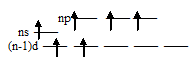
б) (ковалентность – 4)
Поэтому в отличие от атома кислорода атомы серы, селена и теллура могут участвовать в образовании не только двух, но также четырёх или шести ковалентных связей. Аналогично ведут себя атомы других периодов, также обладающие незанятыми d- орбиталями, могут переходить в возбуждённое состояние и образовывать дополнительное число неспаренных электронов.
Диагональное сходство элементов
Задача 774.
В чем проявляется диагональное сходство элементов? Какие причины его вызывают? Сравнить свойства бериллия, магния и алюминия.
Решение:
Диагональное сходство — сходство между собой элементов, находящихся в Периодической системе элементов по диагонали друг от друга, а также соответствующих им про-стых веществ и соединений. Диагональ из левого верхнего угла к нижнему правому объединяет отчасти сходные элементы.
Это объясняется приблизительно одинаковым увеличением неметаллических свойств в периодах и металлических свойств в группах. Диагональная аналогия может проявляться в двух формах: сходстве общего химического характера элементов, проявляющемся во всех однотипных соединениях.
Диагональная аналогия в широком смысле обусловлена близостью энергетических и размерных характеристик элементов-аналогов. В свою очередь, это определяется немонотонным изменением, например, электроотрицательности и орбитальных радиусов элементов по горизонтали (в периоде) и по вертикали (в группе). В силу этой немонотонности и оказывается возможной такая ситуация, когда различие между характеристиками элементов по диагонали оказывается меньше, чем по горизонтали и по вертикали, что и приводит к большему химическому сходству диагонально расположенных элементов в соседних группах по сравнению с групповой аналогией. Сходство моэно объяснить близкими отношениями заряд/радиус иона.
Диагональное сходство наблюдается у пар элементов Li и Mg, Be и Al, B и Si и др. Эта закономерность обусловлена тенденцией смены свойств по вертикали (в группах) и их изменением по горизонтали (в периодах).
Она связана с возрастание неметаллических свойств в периодах слева направо и в группах снизу вверх. Поэтому литий похож на магний, бериллий на алюминий, бор на кремний, углерод на фосфор. Так, литий и магний образуют много алкильных и арильных соединений, которые часто используют в органической химии. Бериллий и алюминий имеют сходные значения окислительно-восстановительных потенциалов. Бор и кремний образуют летучие, весьма реакционноспособные молекулярные гидриды.
Химические свойства бериллия во многом похожи на свойства магния (Mg) и, особенно, алюминия (Al). Близость свойств бериллия и алюминия объясняется почти одинаковым отношением заряда катиона к его радиусу для ионов Be 2+ и Al 3+ . Ве – проявляет, подобно алюминию, амфотерные свойства.
У бериллия и алюминия отношение радиуса иона к заряду, 1/нм соответственно равны 45,4 и 41,7 гораздо больше, чем у магния — 24.4. У магния гидроксид среднее основание, а у бериллия и алюминия — амфотерные основания. У магния кристаллическая решётка хлорида ионная, а у бериллия и алюминия — молекулярная (безв.); ионная (кристаллогидрат). Гидрид магния ионное соединение, а гидриды бериллия и алюминия — полимеры.
Физические и химические свойства простых веществ элементов главных подгрупп
Задача 775.
Каковы общие закономерности изменения физических и химических свойств простых веществ, образуемых элементами главных подгрупп периодической системы элементов: а) в периоде; б) в группе?
Решение:
а) в периоде.
В периодах (слева направо) — заряд ядра возрастает, число электронных уровней не меняется и равно номеру периода, число электронов на внешнем слое возрастает, радиус атома уменьшается, восстановительные свойства уменьшаются, окислительные свойства возрастают, высшая степень окисления растет от +1 до +7, низшая степень окисления растет от -4 до +1, металлические свойства веществ ослабевают, неметаллические свойства — усиливаются. Это связано с увеличением числа электронов на последнем слое. В периодах слева направо у высших оксидов и их гидратов основные свойства уменьшаются, а кислотные увеличиваются.
б) в группе.
В главных подгруппах (сверху вниз) — заряд ядра возрастает, число электронных уровней возрастает, число электронов на внешнем слое не меняется и равно номеру группы, ради-ус атома увеличивается, восстановительные свойства увеличиваются, окислительные свойства уменьшаются, высшая степень окисления постоянна и равна номеру группы, низшая степень окисления не изменяется и равна (- №группы), металлические свойства веществ усиливаются, неметаллические свойства — ослабевают.. Общими для элементов главных и побочных подгрупп являются формулы высших оксидов (и их гидратов). У высших оксидов и их гидратов элементов I — III групп (кроме бора) преобладают основные свойства, с IV по VIII — кислотные. В каждой главной подгруппе ( кроме VIII) сверху вниз усиливается основной характер оксидов и гидроксидов, кислотные же свойства ослабевают.
Это связано с увеличением числа электронных слоёв, а следовательно с уменьшением сил притяжения электронов последнего слоя к ядру.
Кислотно-основные свойства оксидов и гидроксидов элементов
Задача 776.
Как изменяются кислотно-основные и окислительно-восстановительные свойства высших оксидов и гидроксидов элементов с ростом заряда их ядер: а) в пределах периода; б) в пределах группы?
Решение:
а) В пределах периода с ростом заряда ядер атомов элементов кислотно-основные свойства их высших оксидов изменяются следующим образом, уменьшается способность к образованию кислот. Изменение кислотно-основных свойств по периоду хорошо можно проследить на примере следующих соединений элементов третьего периода:
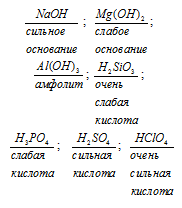
Окислительно-восстановительные свойства по периодам с ростом зарядов атомов элементов изменяются следующим образом, ослабевают восстановительные и усиливаются окислительные свойства элементов. Например, в третьем периоде восстановительная способность уменьшается в последовательности: Na2O, MgO, Al2O3, SiO2, P2O5, а окислитель-ная способность растёт в последовательности: NaOH, Mg(OH)2, Al(OH)3, H3PO4, H2SO4, HClO4. Кислотно-восстановительные свойства элементов зависят от числа проявленных ими степеней окисления. По периоду число проявленных элементами степеней окисленности закономерно возрастают: Na проявляет две степени окисленности (0 и +1), Cl – семь (0, -1, +1, +3, +4, +5, +6, +7).
б) В группах с ростом зарядов ядер атомов элементов кислотно-основные свойства оксидов и гидроксидов элементов изменяются следующим образом, усиливаются основные свойства и ослабевают кислотные. Например, в группах электроположительных элементов нарастает сила оснований: Ве(ОН)2 является амфотерным соединением, а Ва(ОН)2 — сильное основание. По группам с ростом зарядов атомов элементов восстановительная способность высших оксидов и гидроксидов элементов нарастает, а окислительная — уменьшается, например, у элементов VII-й группе (HClO4, HBrO4, HIO4) самый сильный восстановитель HClO4, а самый слабый — HIO4. Во II-й группе (ВеО, MgO, CaO, SrO, BaO) самым сильным восстановителем является ВаО, а самым слабым – ВеО.
- Вы здесь:
- Главная

- Задачи

- Химия-Глинка

- Свойства элементов. Задачи 773 — 776
Источник: buzani.ru
Периодический закон
Периодический закон — это фундаментальный закон, который был сформулирован Д.И. Менделеевым в 1869 году.
В формулировке Дмитрия Ивановича Менделеева периодическ ий закон звучал так: « Свойства элементов, формы и свойства образуемых ими соединений находятся в периодической зависимости от величины их атомной массы .» Периодическое изменение свойств элементов Менделеев связывал с атомной массой. Понимание периодичности изменения многих свойств позволило Дмитрию Ивановичу определить и описать свойства веществ, образованных еще не открытыми химическими элементами, предсказать природные рудные источники и даже места их залегания.

Более поздние исследования показали, что свойства атомов и их соединений зависят в первую очередь от электронного строения атома. А электронное строение определяется свойствами атомного ядра. В частности, зарядом ядра атома .
Поэтому современная формулировка периодического закона звучит так:
« Свойства элементов, форма и свойства образованных ими соединений находятся в периодической зависимости от величины заряда ядер их атомов «.
Следствие периодического закона – изменение свойств элементов в определенных совокупностях, а также повторение свойств по периодам, т.е. через определенное число элементов. Такие совокупности Менделеев назвал периодами.
Периоды – это горизонтальные ряды элементов с одинаковым количеством заполняемых электронных уровней. Номер периода обозначает число энергетических уровней в атоме элемента. Все периоды (кроме первого) начинаются щелочным металлом ( s -элементом), а заканчиваются благородным газом.
Группы – вертикальные столбцы элементов с одинаковым числом валентных электронов, равным номеру группы. Различают главные и побочные подгруппы. Главные подгруппы состоят из элементов малых и больших периодов, валентные электроны которых расположены на внешних ns— и np— подуровнях.
1. Периодическая система химических элементов Д.И. Менделеева
Периодическая система элементов Д. И. Менделеева состоит из семи периодов, которые представляют собой горизонтальные последовательности элементов, расположенные по возрастанию заряда их атомного ядра.
Каждый период (за исключением первого) начинается атомами щелочных металлов (Li, Na, К, Rb, Cs, Fr) и заканчивается благородными газами (Ne, Ar, Kr, Xe, Rn), которым предшествуют типичные неметаллы.
В периодах слева направо возрастает число электронов на внешнем уровне.
В периодах слева направо постепенно ослабевают металлические и усиливаются неметаллические свойства.
1) Li 2) Ca 3) Cs 4) N 5) S
Ответ: 154
1) Be 2) Ba 3) Mg 4) N 5) F
Ответ: 541
В первом периоде имеются два элемента – водород и гелий. При этом водород условно размещают в IA или VIIA подгруппе, так как он проявляет сходство и со щелочными металлами, и с галогенами. Как и щелочные металлы, водород является восстановителем. Отдавая один электрон, водород образует однозарядный катион H + . Как и галогены, водород – неметалл, образует двухатомную молекулу H2 и может проявлять окислительные свойства при взаимодействии с активными металлами:
2Na + H2 → 2NaH
В четвертом периоде вслед за Са расположены 10 переходных элементов (от скандия Sc до цинка Zn), за которыми находятся остальные 6 основных элементов периода ( от галлия Ga до криптона Кr). Аналогично построен пятый период. Переходными элементами обычно называют любые элементы с валентными d– или f–электронами.
Шестой и седьмой периоды имеют двойные вставки элементов. За элементом Ва расположены десять d–элементов (от лантана La — до ртути Hg), а после первого переходного элемента лантана La следуют 14 f–элементов — лантаноидов (Се — Lu). После ртути Hg располагаются остальные 6 основных р-элементов шестого периода (Тl — Rn).
В седьмом (незавершенном) периоде за Ас следуют 14 f–элементов- актиноидов (Th — Lr). В последнее время La и Ас стали причислять соответственно к лантаноидам и актиноидам. Лантаноиды и актиноиды помещены отдельно внизу таблицы.
В Периодической системе каждый элемент расположен в строго определенном месте, которое соответствует его порядковому номеру .
Элементы в Периодической системе разделены на восемь групп (I – VIII), которые в свою очередь делятся на подгруппы — главные , или подгруппы А и побочные , или подгруппы Б. Подгруппа VIIIБ-особая, она содержит триады элементов, составляющих семейства железа (Fе, Со, Ni) и платиновых металлов (Ru, Rh, Pd, Os, Ir, Pt).
Внутри каждой подгруппы элементы проявляют похожие свойства и схожи по химическому строению. А именно:
В главных подгруппах сверху вниз усиливаются металлические свойства и ослабевают неметаллические.
В зависимости от того, какая энергетическая орбиталь заполняется в атоме последней, химические элементы можно разделить на s-элементы, р-элементы, d- и f-элементы.
У атомов s-элементов заполняются s-орбитали на внешних энергетических уровнях. К s-элементам относятся водород и гелий, а также все элементы I и II групп главных подгрупп (литий, бериллий, натрий и др.). У p-элементов электронами заполняются p-орбитали. К ним относятся элементы III-VIII групп, главных подгрупп. У d-элементов заполняются, соответственно, d-орбитали.
К ним относятся элементы побочных подгрупп.
Номер периода соответствует числу заполняемых энергетических уровней.
Номер группы, как правило, соответствует числу валентных электронов в атоме (т.е. электроном, способных к образованию химической связи).
Номер группы, как правило, соответствует высшей положительной степени окисления атома. Но есть исключения!
О каких же еще свойствах говорится в Периодическом законе?
Периодически зависят от заряда ядра такие характеристики атомов, как орбитальный радиус, энергия сродства к электрону, электроотрицательность, энергия ионизации, степень окисления и др.
2. Радиус атома
Рассмотрим, как меняется атомный радиус . Вообще, атомный радиус – понятие довольно сложное и неоднозначное. Различают радиусы атомов металлов и ковалентные радиусы неметаллов.
Радиус атома металла равен половине расстояния между центрами двух соседних атомов в металлической кристаллической решетке. Атомный радиус зависит от типа кристаллической решетки вещества, фазового состояния и многих других свойств.