Фосфор образует несколько оксидов. Важнейшим из них является оксид фосфора (V) P4O10 (Рис.4). Часто его формулу пишут в упрощенном виде – P2O5. В структуре этого оксида сохраняется тетраэдрическое расположение атомов фосфора.
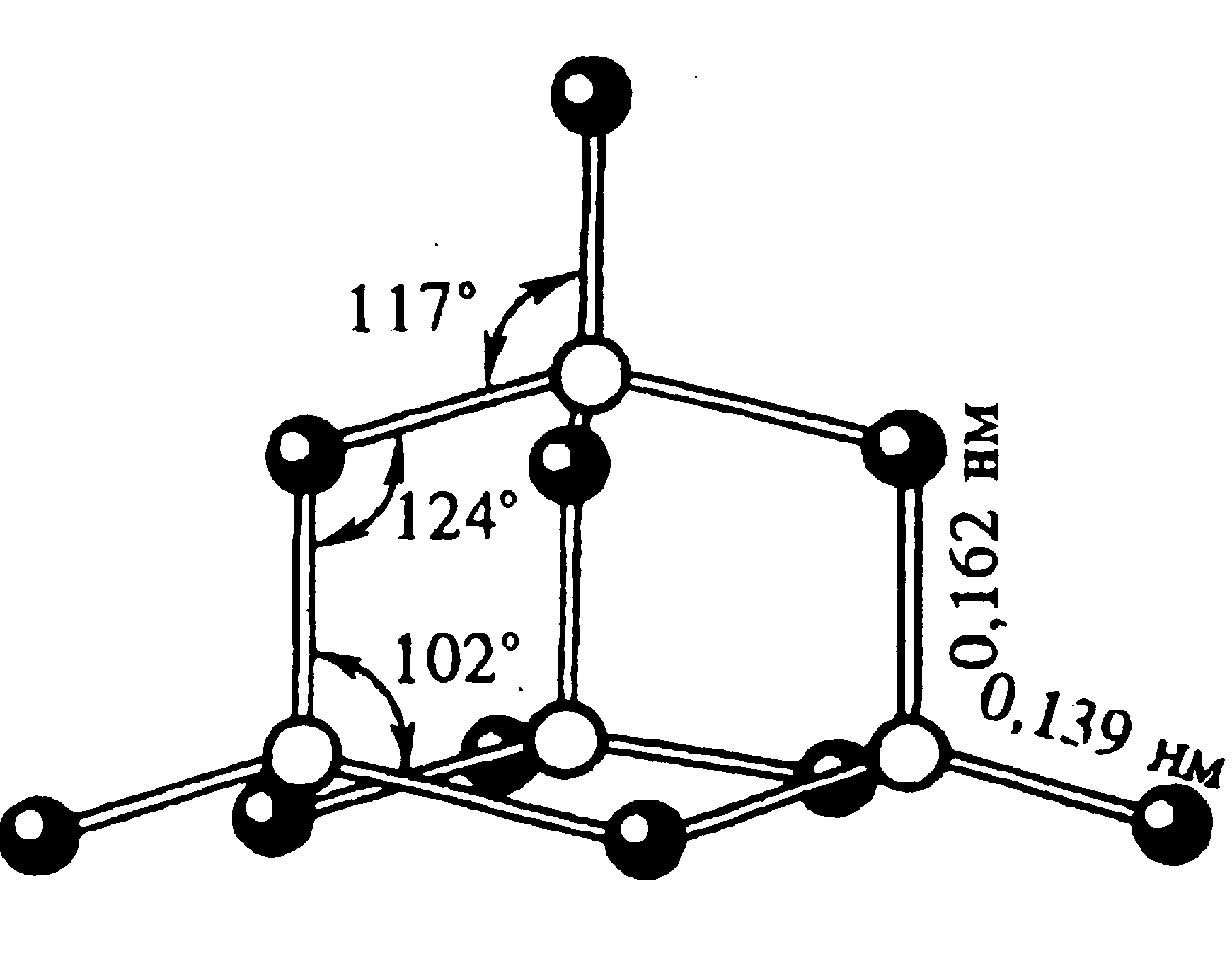
P2+5O5 Фосфорный ангидрид (оксид фосфора (V))
Белые кристаллы, t 0 пл.= 570 0 С, t 0 кип.= 600 0 C, = 2,7 г/см 3 . Имеет несколько модификаций. В парах состоит из молекул P4H10, очень гигроскопичен (используется как осушитель газов и жидкостей).
Получение
Химические свойства
Все химические свойства кислотных оксидов: реагирует с водой, основными оксидами и щелочами
1) P2O5 + H2O 2HPO3 (метафосфорная кислота)
P2O5 + 2H2O H4P2O7 (пирофосфорная кислота)
P2O5 + 3H2O 2H3PO4 (ортофосфорная кислота)
2) P2O5 + 3BaO Ba3(PO4)2
В зависимости от избытка щелочи образует средние и кислые соли:
В7 РТ 20-21 этап 1. Оксид фосфора (V). Тесты по химии
гидрофосфат натрия
дигидрофосфат натрия
Благодаря исключительной гигроскопичности оксид фосфора (V) используется в лабораторной и промышленной технике в качестве осушающего и дегидратирующего средства. По своему осушающему действию он превосходит все остальные вещества. От безводной хлорной кислоты отнимает химически связанную воду с образованием ее ангидрида:
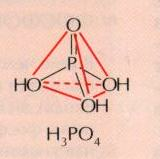
О ртофосфорная кислота. Известно несколько кислот, содержащих фосфор. Важнейшая из них — ортофосфорная кислота Н3РО4 (Рис.5).
Безводная ортофосфорная кислота представляет собой светлые прозрачные кристаллы, при комнатной температуре расплывающиеся на воздухе. Температура плавления 42,35 0 С. С водой фосфорная кислота образует растворы любых концентраций.
Ортофосфорной кислоте соответствует следующая структурная формула:
В лаборатории ортофосфорную кислоту получают окислением фосфора 30%-ной азотной кислотой:
В промышленности ортофосфорную кислоту получают двумя способами: экстракционным и термическим.
1. В основе экстракционного метода лежит обработка измельченных природных фосфатов серной кислотой:
Ортофосфорная кислота затем отфильтровывается и концентрируется упариванием.
2. Термический метод состоит в восстановлении природных фосфатов до свободного фосфора с последующим его сжиганием до Р4О10 и растворением последнего в воде. Производимая по данному методу ортофосфорная кислота характеризуется более высокой чистотой и повышенной концентрацией (до 80% массовых).
Физические свойства. Ортофосфорная кислота — твердое, бесцветное, кристаллическое вещество, хорошо растворимое в воде.
Химические свойства ортофосфорной кислоты представлены в табл.2:
Химические свойства ортофосфорной кислоты
Общие с другими кислотами
1. Водный раствор кислоты изменяет окраску индикаторов. Диссоциация происходит ступенчато:
Опыты по химии. Взаимодействие оксида фосфора (V) с водой
Легче всего идет диссоциация по первой ступени и труднее всего – по третьей
2. Реагирует с металлами, расположенными в вытеснительном ряду до водорода:
3. Реагирует с основными оксидами:
4. Реагирует с основаниями и аммиаком; если кислота взята в избытке, то образуются кислые соли:
гидрофосфат натрия
дигидрофосфат натрия
5. Реагирует с солями слабых кислот:
- При нагревании постепенно превращается в метафосфорную кислоту:
двуфосфорная
2. При действии раствора нитрата серебра (I) появляется желтый осадок:
3. Ортофосфорная кислота играет большую роль в жизнедеятельности животных и растений. Ее остатки входят в состав аденозинтрифосфорной кислоты АТФ.
При разложении АТФ выделяется большое количество энергии.
Ортофосфаты. Ортофосфорная кислота образует три ряда солей. Если обозначить атомы металлов буквами Me, то можно изобразить в общем виде состав ее солей (табл.3).
Химические формулы ортофосфатов, содержащих металлы
Источник: studfile.net
Фосфор и его соединения

Фосфор расположен в III периоде, в 5 группе главной подгруппе «А», под порядковым номером №15. Относительная атомная масса Ar(P) = 31 .
1 S 2 2 S 2 2 P 6 3 S 2 3 P 3 , фосфор: p – элемент, неметалл

Валентные возможности фосфора шире, чем у атома азота, так как в атоме фосфора имеются свободные d -орбитали. Поэтому может произойти распаривание 3 S 2 – электронов и один из них может перейти на 3 d – орбиталь. В этом случае на третьем энергетическом уровне фосфора окажется пять неспаренных электронов и фосфор сможет проявлять валентность V .
АЛЛОТРОПИЯ ФОСФОРА
В свободном состоянии фосфор образует несколько аллотропных видоизменений: белый, красный и чёрный фосфор
Нахождение в природе
БИОЛОГИЧЕСКАЯ РОЛЬ СОЕДИНЕНИЙ ФОСФОРА
Фосфор присутствует в живых клетках в виде орто- и пирофосфорной кислот, входит в состав нуклеотидов, нуклеиновых кислот, фосфопротеидов, фосфолипидов, коферментов, ферментов. Кости человека состоят из гидроксилапатита 3Са3(РО4)3·CaF2. В состав зубной эмали входит фторапатит.
Основную роль в превращениях соединений фосфора в организме человека и животных играет печень. Обмен фосфорных соединений регулируется гормонами и витамином D. Суточная потребность человека в фосфоре 800-1500 мг. При недостатке фосфора в организме развиваются различные заболевания костей.
ТОКСИКОЛОГИЯ ФОСФОРА
·Красный фосфор практически нетоксичен. Пыль красного фосфора, попадая в легкие, вызывает пневмонию при хроническом действии.
·Белый фосфор очень ядовит, растворим в липидах. Смертельная доза белого фосфора — 50-150 мг. Попадая на кожу, белый фосфор дает тяжелые ожоги.
Острые отравления фосфором проявляются жжением во рту и желудке, головной болью, слабостью, рвотой. Через 2-3 суток развивается желтуха. Для хронических форм характерны нарушение кальциевого обмена, поражение сердечно-сосудистой и нервной систем. Первая помощь при остром отравлении — промывание желудка, слабительное, очистительные клизмы, внутривенно растворы глюкозы.
При ожогах кожи обработать пораженные участки растворами медного купороса или соды. ПДК паров фосфора в воздухе 0,03 мг/м³.
ПОЛУЧЕНИЕ ФОСФОРА
Фосфор получают из апатитов или фосфоритов в результате взаимодействия с коксом и кремнезёмом при температуре 1600 °С:
Образующиеся пары белого фосфора конденсируются в приёмнике под водой. Вместо фосфоритов восстановлению можно подвергнуть и другие соединения, например, метафосфорную кислоту:
ХИМИЧЕСКИЕ СВОЙСТВА ФОСФОРА
Восстановитель
Фосфиды разлагаются кислотами и водой с образованием газа фосфина
Источник: www.yoursystemeducation.com
Оксид фосфора v реагирует с
Скажите оксид фосфора v реагирует с какими веществами? Запишите уравнения реакций. Вступает ли фосфорный ангидрид в реакцию взаимодействия с водой? При каких условиях. Укажите основные области его применения.
Xumuk Админ. ответил 5 лет назад
Оксид фосфора (V) чрезвычайно жадно присоединяет воду. Реакция сопровождается сильным разогреванием (292 кДж/моль) и приводит к образованию сложной смеси, состоящей из метафосфорных кислот разного состава, которые при кипячении гидролизуются до ортофосфорной кислоты . При осторожном добавлении небольших порций гексагонального в ледяную воду удается получить раствор циклотетраметафосфорной кислоты .
![]()
![]()
Оксид фосфора (V) по химическим свойствам сходен с другими кислотными оксидами (оксид фосфора v реагирует с): реагирует со щелочами, легко галогенируется, восстанавливается фосфором.
![]()
![]()
![]()
В лабораторной практике фосфорный ангидрид находит широкое применение как осушитель и дегидратирующий агент.
Основной способ получения оксида фосфора (V) — сжигание фосфора в избытке кислорода или воздуха:
Источник: ru.solverbook.com