Окси́д серебра́(I,III) (окси́д серебра́(III)-серебра́(I), моноокси́д серебра́, диоксид дисеребра) — Ag + Ag 3+ O2 или Ag2O2, неорганическое бинарное соединение кислорода и серебра, проявляющего смешанную валентность позиционного типа: +1 и +3. Часто соединению ошибочно приписывают формулу AgO, однако она не отражает истинный характер связи в веществе. Другой ошибкой является встречающееся название пероксид серебра — связь O—O в этом соединении отсутствует.
Используется для изготовления серебряно-цинковых щелочных источников тока и в качестве окислителя в органическом синтезе.
- 1 Физические свойства
- 2 Получение и химические свойства
- 3 Применение
- 4 Примечания
Физические свойства
Получение и химические свойства
Получают из серебра или оксида серебра(I) действием сильного окислителя: пероксодисульфата калия или озона; из серебра анодным окислением в разбавленной серной кислоте [4] . Сильный окислитель. При нагревании (~100 °C) разлагается с выделением кислорода. В присутствии неорганических кислот способен воспламенять гексан, диэтиловый эфир и другие легковоспламеняемые органические соединения [4] . Растворяется в щелочах, а также азотной и хлорной кислотах: [math]displaystyle < mathsf>[/math]
Применение
Используется как окислитель в серебряно-цинковом аккумуляторе.
Примечания
- ↑ 1,01,1CRC Handbook of Chemistry and Physics / D. R. Lide (Ed.). — 90th edition. — CRC Press; Taylor and Francis, 2009. — 2828 p. — ISBN 1420090844.
- ↑Brese N.E. , O’Keeffe M. , Ramakrishna B.L. , Von Dreele R.B.Low-temperature structures of CuO and AgO and their relationships to those of MgO and PdO // Journal of Solid State Chemistry. — 1990. — Ноябрь ( т. 89 , № 1 ). — С. 184—190 . — ISSN0022-4596. — doi:10.1016/0022-4596(90)90310-T. [исправить]
- ↑Jean D’Ans, Ellen Lax. Taschenbuch für Chemiker und Physiker (неопр.). — Springer DE, 1997. — С. 288f. — ISBN 3-540-60035-3.
- ↑ 4,04,1 Серебра оксид // Химический энциклопедический словарь / гл. ред. И. Л. Кнунянц . — М. : Советская энциклопедия, 1983. — С. 522. — 792 с. — 100 000 экз.
| H2O | ||||||||||||||||
| Li2O LiCoO2 Li3PaO4 Li5PuO6 Ba2LiNpO6 LiAlO2 Li3NpO4 Li2NpO4 Li5NpO6 LiNbO3 |
BeO | B2O3 | С3О2 C12O9 CO C12O12 C4O6 CO2 |
N2O NO N2O3 N4O6 NO2 N2O4 N2O5 |
O | F | ||||||||||
| Na2O NaPaO3 NaAlO2 Na2PtO3 |
MgO | AlO Al2O3 NaAlO2 LiAlO2 AlO(OH) |
SiO SiO2 |
P4O P4O2 P2O3 P4O8 P2O5 |
S2O SO SO2 SO3 |
Cl2O ClO2 Cl2O6 Cl2O7 |
||||||||||
| K2O K2PtO3 KPaO3 |
CaO Ca3OSiO4 CaTiO3 |
Sc2O3 | TiO Ti2O3 TiO2 TiOSO4 CaTiO3 BaTiO3 |
VO V2O3 V3O5 VO2 V2O5 |
FeCr2O4 CrO Cr2O3 CrO2 CrO3 MgCr2O4 |
MnO Mn3O4 Mn2O3 MnO(OH) Mn5O8 MnO2 MnO3 Mn2O7 |
FeCr2O4 FeO Fe3O4 Fe2O3 |
CoFe2O4 CoO Co3O4 CoO(OH) Co2O3 CoO2 |
NiO NiFe2O4 Ni3O4 NiO(OH) Ni2O3 |
Cu2O CuO CuFe2O4 Cu2O3 CuO2 |
ZnO | Ga2O Ga2O3 |
GeO GeO2 |
As2O3 As2O4 As2O5 |
SeOCl2 SeOBr2 SeO2 Se2O5 SeO3 |
Br2O Br2O3 BrO2 |
| Rb2O RbPaO3 Rb4O6 |
SrO | Y2O3 YOF YOCl |
ZrO(OH)2 ZrO2 ZrOS Zr2О3Сl2 |
NbO Nb2O3 NbO2 Nb2O5 Nb2O3(SO4)2 LiNbO3 |
Mo2O3 Mo4O11 MoO2 Mo2O5 MoO3 |
TcO2 Tc2O7 |
Ru2O3 RuO2 Ru2O5 RuO4 |
RhO Rh2O3 RhO2 |
PdO Pd2O3 PdO2 |
Ag2O Ag2O2 |
Cd2O CdO |
In2O InO In2O3 |
SnO SnO2 |
Sb2O3 Sb2O4 Hg2Sb2O7 Sb2O5 |
TeO2 TeO3 |
I2O4 I4O9 I2O5 |
| Cs2O Cs2ReCl5O |
BaO BaPaO3 BaTiO3 BaPtO3 |
HfO(OH)2 HfO2 |
Ta2O TaO TaO2 Ta2O5 |
WO2Br2 WO2 WO2Cl2 WOBr4 WOF4 WOCl4 WO3 |
Re2O ReO Re2O3 ReO2 Re2O5 ReO3 Re2O7 |
OsO Os2O3 OsO2 OsO4 |
Ir2O3 IrO2 |
PtO Pt3O4 Pt2O3 PtO2 K2PtO3 Na2PtO3 PtO3 |
Au2O AuO Au2O3 |
Hg2O HgO (Hg3O2)SO4 Hg2O(CN)2 Hg2Sb2O7 Hg3O2Cl2 Hg5O4Cl2 |
Tl2O Tl2O3 |
Pb2O PbO Pb3O4 Pb2O3 PbO2 |
BiO Bi2O3 Bi2O4 Bi2O5 |
PoO PoO2 PoO3 |
At | |
| Fr | Ra | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | |
| ↓ | ||||||||||||||||
| La2O2S La2O3 |
Ce2O3 CeO2 |
PrO Pr2O2S Pr2O3 Pr6O11 PrO2 |
NdO Nd2O2S Nd2O3 NdHO |
Pm2O3 | SmO Sm2O3 |
EuO Eu3O4 Eu2O3 EuO(OH) Eu2O2S |
Gd2O3 | Tb | Dy2O3 | Ho2O3 Ho2O2S |
Er2O3 | Tm2O3 | YbO Yb2O3 |
Lu2O2S Lu2O3 LuO(OH) |
||
| Ac2O3 | UO2 UO3 U3O8 |
PaO PaO2 Pa2O5 PaOS |
ThO2 | NpO NpO2 Np2O5 Np3O8 NpO3 |
PuO Pu2O3 PuO2 PuO3 PuO2F2 |
AmO2 | Cm2O3 CmO2 |
Bk2O3 | Cf2O3 | Es | Fm | Md | No | Lr |
Химические свойства солей серебра #1 получение Ag2O
Источник: xn--h1ajim.xn--p1ai
Структура оксида серебра (Ag2O), свойства, номенклатура и применение
оксид серебра неорганическое соединение, чья химическая формула Ag2О. Сила, которая объединяет его атомы, имеет полностью ионную природу; следовательно, он состоит из ионного твердого тела, в котором существует соотношение двух катионов Ag + электростатически взаимодействуя с анионом О 2- .
Оксид-анион, О 2- , это происходит в результате взаимодействия атомов серебра на поверхности с кислородом окружающей среды; очень похоже на железо и многие другие металлы. Серебряное изделие или украшение вместо того, чтобы краснеть и рассыпаться в ржавчину, становится черным, характерным для оксида серебра.

Например, на изображении выше вы можете увидеть ржавую серебряную чашку. Обратите внимание на его почерневшую поверхность, хотя он все еще сохраняет некоторый декоративный блеск; поэтому даже ржавые серебряные предметы можно считать достаточно привлекательными для декоративного использования.
Свойства оксида серебра таковы, что они не портят, на первый взгляд, первоначальную металлическую поверхность. Это сформировано при комнатной температуре простым контактом с кислородом в воздухе; и что еще интереснее, он может разлагаться при высоких температурах (выше 200 ° C).
Это означает, что если удерживать стекло изображения и применять тепло интенсивного пламени, оно восстановит свой серебристый блеск. Следовательно, его образование является термодинамически обратимым процессом..
Оксид серебра также имеет другие свойства и, помимо своей простой формулы Ag2Или это охватывает сложные структурные организации и богатое разнообразие твердых веществ. Тем не менее, Ag2Или это возможно, рядом с Ag2О3, самый представительный из оксидов серебра.
- 1 Структура оксида серебра
- 1.1 Изменения в количестве Валенсии
- 2.1 Молекулярный вес
- 2.2 Внешний вид
- 2.3 Плотность
- 2.4 Точка плавления
- 2,5 кпс
- 2.6 Растворимость
- 2.7 Ковалентный характер
- 2.8 Разложение
- 3.1 Валенсия I и III
- 3.2 Систематическая номенклатура сложных оксидов серебра
Структура оксида серебра
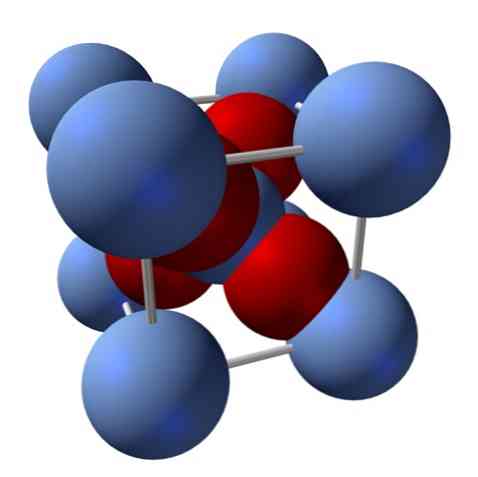
Как его структура? Как уже упоминалось в начале: это ионное тело. По этой причине в его структуре не может быть ковалентных связей Ag — O и Ag = O; поскольку, если бы они были, свойства этого оксида резко изменились бы. Именно тогда ионы Ag + и O 2- в соотношении 2: 1 и испытывает электростатическое притяжение.
Структура оксида серебра определяется, следовательно, тем, как ионные силы распределяют в пространстве ионы Ag. + и O 2- .
Например, на верхнем изображении у вас есть элементарная ячейка для кубической кристаллической системы: катионы Ag + серебристо-синие сферы, а O 2- красноватые сферы.
Если вы посчитаете количество сфер, вы обнаружите, что на первый взгляд есть девять серебристо-голубых и четыре красных цвета. Однако принимаются во внимание только фрагменты сфер, содержащихся в кубе; считая их, как доли от общего количества сфер, нужно соблюдать соотношение 2: 1 для Ag2О.
Повторяя структурную единицу тетраэдра AgO4 в окружении четырех других Ag + , все черное тело построено (устранение пробелов или неровностей, которые могут иметь эти кристаллические структуры).
Изменения в количестве Валенсии
Сосредоточение теперь не на тетраэдре AgO4 но в линии AgOAg (обратите внимание на вершины верхнего куба) будет показано, что твердое вещество оксида серебра состоит, с другой точки зрения, из множества ионных слоев, расположенных линейно (хотя и наклонно). Все это в результате «молекулярной» геометрии вокруг Ag + .
Вышесказанное было подтверждено несколькими исследованиями его ионной структуры.
Серебро работает преимущественно с валентностью +1, поскольку при потере электрона его электронная конфигурация равна [Kr] 4d. 10 , который очень стабилен. Другие валентности, такие как Ag 2+ и Ag 3+ они менее стабильны, так как теряют электроны от орбиталей, почти полностью заполненных.
Ag ион 3+ , однако он относительно менее нестабилен по сравнению с Ag 2+ . На самом деле, он может сосуществовать в компании Ag + Химически обогащает структуру.
Его электронная конфигурация [Kr] 4d 8 , с неспаренными электронами таким образом, что дает ему некоторую стабильность.
В отличие от линейной геометрии вокруг ионов Ag + , было обнаружено, что это из ионов Ag 3+ Это квадратная квартира. Следовательно, оксид серебра с ионами Ag 3+ будет состоять из слоев, состоящих из квадратов AgO4 (не тетраэдры), электростатически связанные линиями AgOAg; Таков случай Ag4О4 или Ag2O ∙ Ag2О3 с моноклинной структурой.
Физико-химические свойства

Если вы поцарапаете поверхность серебряного стакана основного изображения, вы получите твердое тело, которое не только черного цвета, но также имеет коричневые или коричневые тона (верхнее изображение). Некоторые из его физических и химических свойств, о которых сообщают моменты, следующие:
Молекулярный вес
231 735 г / моль
внешний вид
Твердый черный коричневый в виде порошка (обратите внимание, что, несмотря на то, что он является ионным твердым веществом, он не имеет кристаллического вида). Он не имеет запаха и смешан с водой, придает ему металлический привкус
плотность
Точка плавления
277-300 ° С Конечно, он плавится в твердое серебро; то есть он, вероятно, разрушается до образования жидкого оксида.
КПС
1,52 ∙ 10 -8 в воде при 20 ° С Поэтому это соединение плохо растворимое в воде.
растворимость
Если вы внимательно посмотрите на изображение его структуры, вы обнаружите, что сферы Ag 2+ и O 2- Они не расходятся почти по размеру. В результате только небольшие молекулы могут проникать внутрь кристаллической решетки, делая ее нерастворимой почти во всех растворителях; за исключением тех, где он реагирует, таких как основания и кислоты.
Ковалентный персонаж
Хотя неоднократно говорилось, что оксид серебра является ионным соединением, некоторые свойства, такие как его низкая температура плавления, противоречат этому утверждению..
Конечно, рассмотрение ковалентного характера не нарушает того, что объясняется для его структуры, было бы достаточно, чтобы добавить его к структуре Ag2Или модель сфер и стержней для обозначения ковалентных связей.
Также тетраэдры и квадратные плоскости AgO4, как и линии AgOAg, они будут связаны ковалентными (или ковалентными ионными) связями.
Имея это в виду, Ag2Или это на самом деле полимер. Тем не менее, рекомендуется рассматривать его как ионное твердое вещество с ковалентным характером (характер связи до сих пор остается проблемой).
разложение
Сначала было упомянуто, что его образование является термодинамически обратимым, поэтому он поглощает тепло, чтобы вернуться в свое металлическое состояние. Все это можно выразить двумя химическими уравнениями для таких реакций:
Где Q представляет тепло в уравнении. Это объясняет, почему огонь, сжигающий поверхность ржавой серебряной чашки, возвращает свой серебристый блеск.
Поэтому трудно предположить, что существует Ag2O (l), так как оно мгновенно разлагается под воздействием тепла; если только давление не является слишком высоким для получения указанной коричневой черной жидкости.
номенклатура
Когда появилась возможность введения ионов Ag 2+ и Ag 3+ помимо общего и преобладающего Ag + , термин «оксид серебра» начинает казаться недостаточным для обозначения Ag2О.
Это потому, что ион Ag + является более распространенным, чем другие, поэтому Аг2Или как единственный оксид; что совсем не правильно.
Если вы считаете, Ag 2+ так как практически не существует, учитывая его нестабильность, то будут присутствовать только ионы с валентностями +1 и +3; то есть Ag (I) и Ag (III).
Валенсия I и III
Поскольку Ag (I) является наименее валентным, его называют путем добавления суффикса -oso к его имени. Argentum. Итак, Аг2Или это: окись аргентозо или, согласно систематической номенклатуре, окись диплата.
Если Ag (III) полностью игнорируется, то его традиционная номенклатура должна быть: оксид серебра вместо оксида аргентина.
С другой стороны, Ag (III), являющийся большей валентностью, добавляет к своему имени суффикс -ico. Итак, Аг2О3 это: оксид серебра (2 Ag ионы) 3+ с тремя O 2- ). Кроме того, его название в соответствии с систематической номенклатурой будет: диплат триоксид.
Если структура Ag наблюдается2О3, можно предположить, что это продукт окисления озоном, ИЛИ3, вместо кислорода. Следовательно, его ковалентный характер должен быть больше, поскольку он представляет собой ковалентное соединение со связями Ag-O-O-O-Ag или Ag-O.3-Ag.
Систематическая номенклатура сложных оксидов серебра
AgO, также написано как Ag4О4 или Ag2O ∙ Ag2О3, это оксид серебра (I, III), так как он имеет обе валентности +1 и +3. Его название в соответствии с систематической номенклатурой будет: тетраплат тетраоксид.
Эта номенклатура очень помогает, когда речь идет о других стехиометрически более сложных оксидах серебра. Например, предположим, что два твердых вещества 2Ag2O ∙ Ag2О3 и Ag2O ∙ 3Ag2О3.
Написание первого более подходящим способом будет следующим: Ag6О5 (считая и добавляя атомы Ag и O). Его имя тогда будет гексаплатной пятиокисью. Обратите внимание, что этот оксид имеет состав серебра менее богатый, чем Ag2О (6: 5
Источник: ru.thpanorama.com
Оксид серебра (I)

Оксид серебра(I) — химическое соединение с формулой Ag2O.
1S/2Ag.O/q2*+1;-2
NDVLTYZPCACLMA-UHFFFAOYSA-N
Получение
Оксид может быть получен взаимодействием нитрата серебра с щёлочью в водном растворе:
Это связано с тем, что образующийся в ходе реакции гидроксид серебра(I) быстро разлагается на оксид и воду:
Более чистый оксид серебра(I) может быть получен в результате анодного окисления металлического серебра в дистиллированной воде.
Свойства
Ag2O практически нерастворим в большинстве известных растворителей, исключая те, с которыми он взаимодействует химически. В воде он образует незначительное число ионов Ag(OH)2 − . Ион Ag + гидролизуется очень слабо (1:40,000); в водном растворе аммиака разлагается с образованием растворимых производных.
Свежий осадок Ag2O легко взаимодействует с кислотами:
где HX = HF, HCl, HBr, HI или CF3COOH. Также Ag2O реагирует с растворами хлоридов щелочных металлов, образуя хлорид серебра(I) и соответствующую щёлочь.
Обладает фоточувствительностью. При температуре выше 280 °C разлагается.
Источник: chemicalportal.ru