Оксид серы (VI) – это кислотный оксид. При обычных условиях – бесцветная ядовитая жидкость. На воздухе «дымит», сильно поглощает влагу.
Способы получения. Оксид серы (VI) получают каталитическим окислением оксида серы (IV) кислородом.
Сернистый газ окисляют и другие окислители, например , озон или оксид азота (IV):
Еще один способ получения оксида серы (VI) – разложение сульфата железа (III):
Химические свойства оксида серы (VI)
1. Оксид серы (VI) активно поглощает влагу и реагирует с водой с образованием серной кислоты:
2. Серный ангидрид является типичным кислотным оксидом , взаимодействует с щелочами и основными оксидами.
Например , оксид серы (VI) взаимодействует с гидроксидом натрия. При этом образуются средние или кислые соли:
Еще пример : оксид серы (VI) взаимодействует с оксидом оксидом (при сплавлении):
SO3 + MgO → MgSO4
3. Серный ангидрид – очень сильный окислитель , так как сера в нем имеет максимальную степень окисления (+6). Он энергично взаимодействует с такими восстановителями, как йодид калия, сероводород или фосфор:
Оксид серы. Способы получения и химические свойства | Химия
4. Растворяется в концентрированной серной кислоте, образуя олеум – раствор SO3 в H2SO4.
Источник: chemege.ru
4.6. Кислородосодержащие соединения серы
Соединений серы с кислородом очень много. Мы рассмотрим лишь оксиды серы(IV) и (VI), сернистую и серную кислоты, а также их соли.

Оксид серы (IV). Диоксид серы (сернистый газ) содержит серу, у которой кислород «забрал» четыре электрона из шести валентных.

Отдавая оставшиеся 2 е серы, активно проявляет восстановительные свойства, например:

.
Окисляется диоксид серы также бромом. И даже кислородом воздуха:
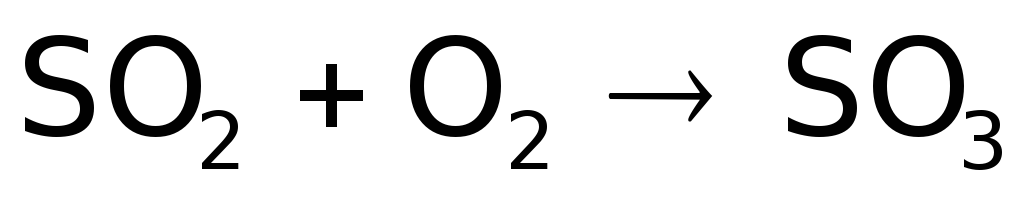
.
Оксид серы (VI). Триоксид серы (серный ангидрид) является жидкостью (б/ц). Ее т.кип. (44,8°С) выше, чем у  (–37°C), из-за большего числа атомов в молекуле
(–37°C), из-за большего числа атомов в молекуле  .
.
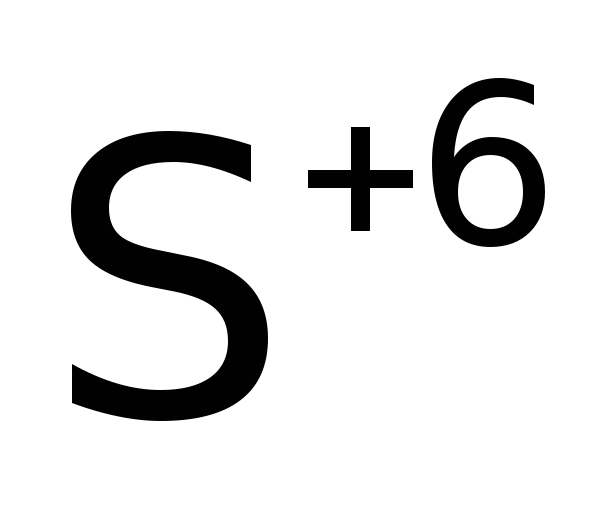
Оксид серы(VI) проявляет окислительные свойства. Например, при нагревании его до 600°C начинает забирать электроны у собственного кислорода, т.е. равновесие реакции смещается влево.
Получение кислот. Отношение  и
и  к воде очень различно. Сернистый газ растворяется в ней ограниченно (40 л в 1 л), образуя при этом, в основном, гидраты
к воде очень различно. Сернистый газ растворяется в ней ограниченно (40 л в 1 л), образуя при этом, в основном, гидраты 
 .
.
Серный ангидрид, напротив, жадно поглощает воду, полностью переходя в серную кислоту. И даже 100%  (жидкость) растворяет до 65% (масс.)
(жидкость) растворяет до 65% (масс.) 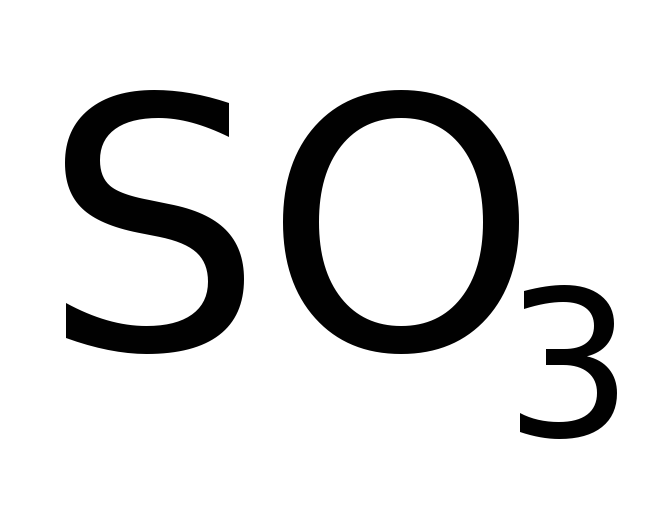 , давая т.н. олеум:
, давая т.н. олеум: 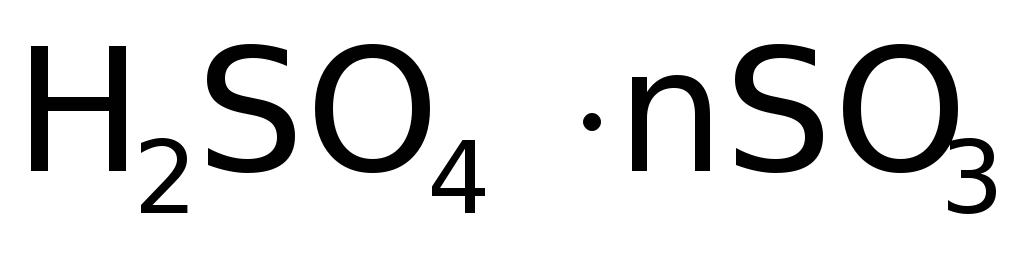 .
.
Процесс образования олеума – это третья стадия производства серной кислоты. Олеум затем разбавляют до 98%-ной кислоты, получая т.о. товарный продукт (представляет собой тяжелую маслообразную жидкость).
Зависимость свойств кислот и их солей от ст.ок. серы. Гидроксиды серы (IV) и (VI) тоже (как и оксиды) значительно отличаются друг от друга. Так, сернистая кислота настолько нестабильна, что в свободном состоянии не выделена и существует только в виде разбавленного водного раствора, но даже из него SO2 улетучивается при об.у.
Серная же кислота (даже 98%-ая) устойчива: разлагается (на SO3 и Н2O) лишь при температуре кипения (338°С). Являясь нелетучей, вытесняет из солей летучие кислоты.

Рис. 2 Графические формулы сернистой (а) и серной (б) кислот
роме того,  – слабая кислота (Кd1=1,7·10 -2 ), a
– слабая кислота (Кd1=1,7·10 -2 ), a  – сильная (Кd1=1·10 3 ). Такая разница объясняется большим числом оксочастиц (=О) в молекуле H2SO4 по сравнению с
– сильная (Кd1=1·10 3 ). Такая разница объясняется большим числом оксочастиц (=О) в молекуле H2SO4 по сравнению с  (при равном числе гидроксогрупп Н–О–). А поскольку частицы (=О) гораздо электрофильнее (то есть «сильнее любят» е, чем Н–О–), то смещают электроны к себе от связей Н–О. И очевидно, что две оксочастицы осуществляют такое смещение гораздо в большей степени, чем одна. (На рисунке 2 это отражено более жирными стрелками.)
(при равном числе гидроксогрупп Н–О–). А поскольку частицы (=О) гораздо электрофильнее (то есть «сильнее любят» е, чем Н–О–), то смещают электроны к себе от связей Н–О. И очевидно, что две оксочастицы осуществляют такое смещение гораздо в большей степени, чем одна. (На рисунке 2 это отражено более жирными стрелками.)
Как следствие, связь Н–О в молекуле серной кислоты слабее и, к тому же, более ионная, чем в случае сернистой, а значит, легче разрывается на ионы под действием молекул воды.
То же и по той же причине наблюдается и для солей данных кислот, т.е. в решетке сульфатов ХС более ионные, чем в сульфитах. Поэтому из сульфитов растворимы лишь соли ЩМ, а сульфаты большинства металлов хорошо растворимы. Исключение составляют сульфаты бария, стронция, кальция и свинца.
Взаимодействие серной кислоты с М. Разбавленная (разб.) H2SO4 относится к металлам в соответствии с рядом напряжений, т.е. реагирует, например, с Zn, но не с Cu.
Однако Pb, хотя и стоит в ряду левее Н, не растворятся в разб. H2SO4 (поэтому ее хранят в свинцовой таре). Дело в том, что данный М уже в первые моменты взаимодействия с кислотой покрывается плотной пленкой малорастворимого продукта (сульфата свинца). Эта пленка защищает его от дальнейшей реакции, т.е. пассивирует (делает пассивным).
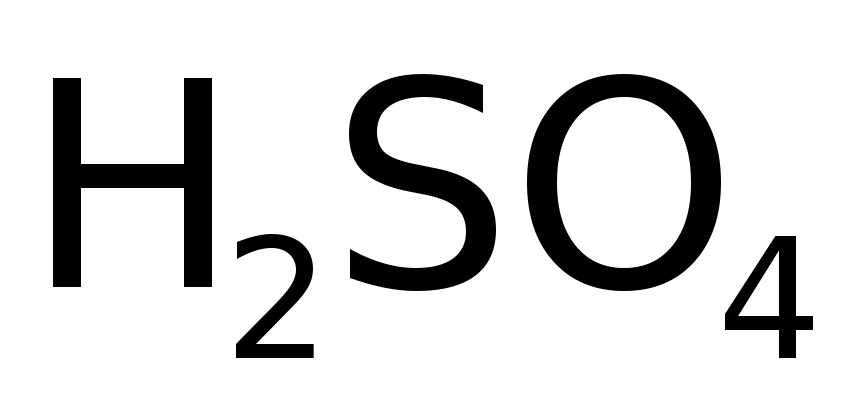
Концентрированная (конц.) при действии на металлы способна (из-за окисляющего действия S +6 ) отщеплять атомарный кислород, образующий с М (даже с серебром) оксиды. Далее оксиды растворяются в кислоте как результат образования очень прочного соединения – Н2О. Например, взаимодействие с медью состоит из следующих стадий:

1). «O», 2). Сu+«О»= СuО,
(Данная реакция используется для получения SO2 в лаборатории.)
Однако, если под действием конц. 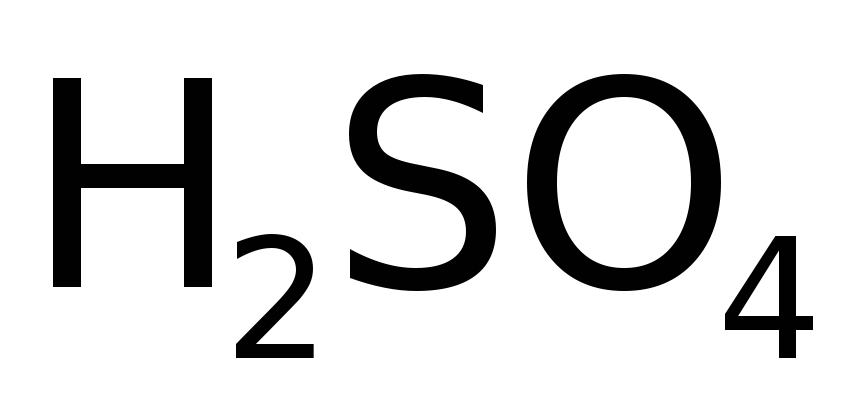 на поверхности металла формируется очень плотная пленка его оксида, то глубже реакция не идет, т.е. М пассивируется. Это происходить в случае таких активных металлов, как Cr, Al и Fe (что используется на практике – конц.
на поверхности металла формируется очень плотная пленка его оксида, то глубже реакция не идет, т.е. М пассивируется. Это происходить в случае таких активных металлов, как Cr, Al и Fe (что используется на практике – конц. 

Гидратация серной кислоты. Особенностью концентрированной серной кислоты является ее способность жадно поглощать воду, т.к. она образует прочные гидраты: H2SO4·H2O и H2SO4·2H2O. Поэтому конц. применяют для осушки газов (если они не реагируют с данной кислотой). Она отнимает даже химически связанную воду, обугливая (делая углем) древесину, бумагу и т.п., в частности, сахар:

.

Аналогичный процесс происходит и в том случае, когда конц. попадает на кожу, вызывая химический ожог. Поэтому кислоту надо сразу же стереть сухой тряпочкой, а кожу обильно промыть струей воды из-под крана.
Практическое применение. Соединения S широко используются на практике. Так, сернистым газом (который убивает плесень и микробы) окуривают сырые хранилища (сжигая серу); а также фрукты и ягоды перед их транспортировкой.
Кроме того,  обесцвечивает многие красители, присоединяясь к их молекулам – это «мягкое» отбеливание. Его используют в случае шерсти, шелка, древесины, соломы, бумаги. Поскольку данные материалы разрушаются при «жестком» отбеливании окислителями, например, хлорной воды,
обесцвечивает многие красители, присоединяясь к их молекулам – это «мягкое» отбеливание. Его используют в случае шерсти, шелка, древесины, соломы, бумаги. Поскольку данные материалы разрушаются при «жестком» отбеливании окислителями, например, хлорной воды, 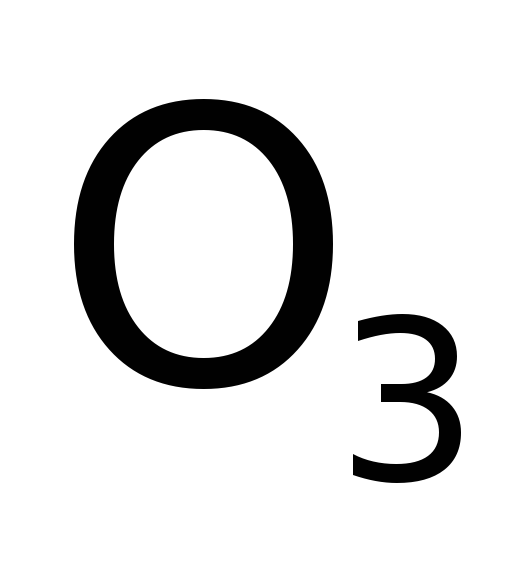
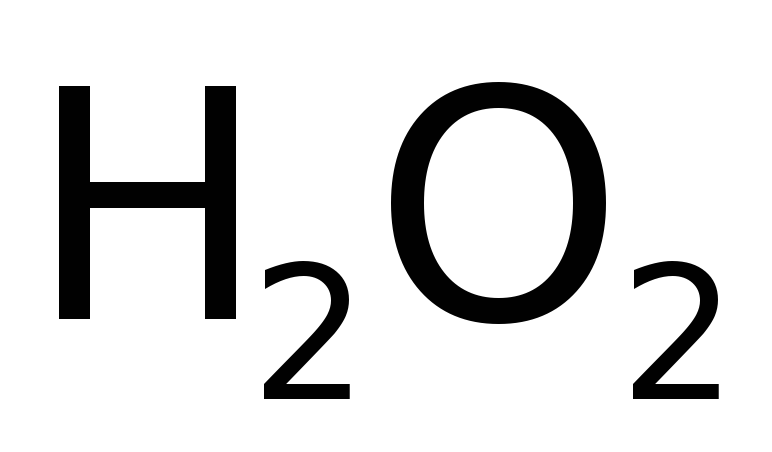 .
.

Однако «мягкое» отбеливание недолговечно: при нагревании или на свету молекулы постепенно отщепляются, и изделия из указанных материалов желтеют (восстанавливается окраска красителей). Чтобы вернуть белизну, нужно повторить обработку сернистым газом.
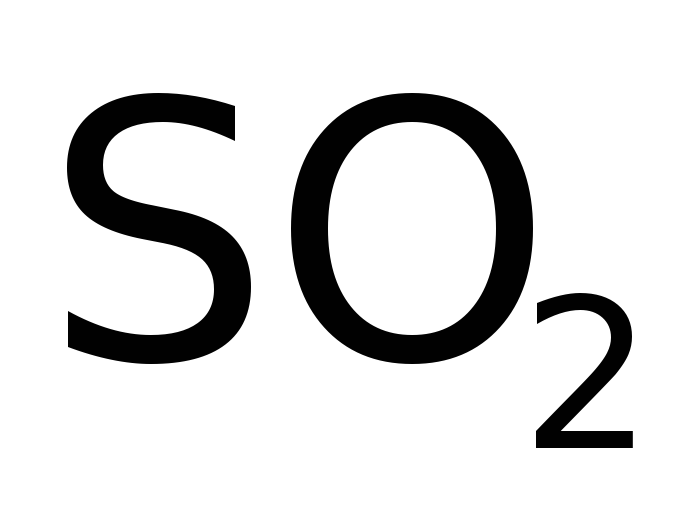
Основная доля промышленного идет на производство серной кислоты. Среди всех реактивов, выпускаемых химическими предприятиями, она занимает первое место по практическому использованию. Причем в самых разных областях. Серная кислота необходима при переработке нефти (для очистки бензина от органических примесей, которые H2SO4 окисляет до СО2 и Н2О); при никелировании изделий (перед покрытием поверхность М очищают кислотой от оксидов), при выделке кожи; в производстве моющих средств, пластмасс, красок, удобрений, взрывчатых веществ, ядохимикатов, лекарств, косметики, и мн. др.
Широко используются и соли серной кислоты. В частности, купоросы 20 (кристаллогидраты): медный  и железный
и железный  , – применяют в сельском хозяйстве (от болезней растений).
, – применяют в сельском хозяйстве (от болезней растений).
Источник: studfile.net
Оксид серы 6 реагирует с серебром
ХИМИЯ – это область чудес, в ней скрыто счастье человечества,
величайшие завоевания разума будут сделаны
именно в этой области.(М. ГОРЬКИЙ)
Таблица
Менделеева
Периодическая система химических элементов
Универсальная таблица растворимости
кислот, солей и оснований в воде
Коллекция таблиц к урокам по химии
Информационные и справочноинструктивные
Оксид серы (VI). Серная кислота и её соли
I. Оксид серы (VI) (серный ангидрид, триокись серы, серный газ)

SO3 — высший оксид серы, тип химической связи: ковалентная полярная химическая связь.
1. Физические свойства
Бесцветная летучая маслянистая жидкость, t°пл. = 17°C; t°кип. = 66°С; на воздухе «дымит», сильно поглощает влагу (хранят в запаянных сосудах).
SO3 хорошо растворяется в 100%-ной серной кислоте, этот раствор называется олеумом.
2. Получение
3. Химические свойства
Серный ангидрид — кислотный оксид. Его химическая активность достаточно велика.
1) Взаимодействие с водой
При растворении в воде дает сильную двухосновную серную кислоту:
2) Взаимодействие со щелочами
3) Взаимодействие с основными оксидами
4) SO3 — сильный окислитель
II. Серная кислота и ее соли
Серная кислота H2SO4 — сильная двухосновная кислота, отвечающая высшей степени окисления серы (+6).


В XVIII—XIX веках серу для пороха производили из серного колчедана (пирит) на купоросных заводах. Серную кислоту в то время называли «купоросным маслом» (как правило это был кристаллогидрат, по консистенции напоминающий масло), очевидно отсюда происхождение названия её солей (а точнее именно кристаллогидратов) — купоросы.
1. Физические свойства
Тяжелая маслянистая жидкость («купоросное масло»); r = 1,84 г/см 3 ; нелетучая, хорошо растворима в воде – с сильным нагревом; t°пл. = 10,3°C, t°кип. = 296°С, очень гигроскопична, обладает водоотнимающими свойствами (обугливание бумаги, дерева, сахара).
Помните!
Кислоту вливать малыми порциями в воду, а не наоборот!
2. Производство серной кислоты
Макет производсва серной кислоты
1-я стадия. Печь для обжига колчедана
- измельчение железного колчедана (пирита)
- метод «кипящего слоя»
- 800°С; отвод лишнего тепла
- увеличение концентрации кислорода в воздухе
2-я стадия. Контактный аппарат
После очистки, осушки и теплообмена сернистый газ поступает в контактный аппарат, где окисляется в серный ангидрид (450°С – 500°С; катализатор V2O5):
3-я стадия . Поглотительная башня
Воду использовать нельзя из-за образования тумана. Применяют керамические насадки и принцип противотока.
3. Химические свойства разбавленной серной кислоты
H2SO4 — сильная двухосновная кислота, водный раствор изменяет окраску индикаторов (лакмус и универсальный индикатор краснеют).
H2SO4 образует два ряда солей — средние (сульфаты) и кислые (гидросульфаты)
1) Диссоциация протекает ступенчато:
H2SO4→ H + + HSO4 — (первая ступень, образуется гидросульфат – ион)
HSO4 — → H + + SO4 2- (вторая ступень, образуется сульфат – ион)
H2SO4 образует два ряда солей — средние (сульфаты) и кислые (гидросульфаты)
2) Взаимодействие с металлами:
Разбавленная серная кислота растворяет только металлы, стоящие в ряду напряжений левее водорода:
Zn 0 + 2H + → Zn 2+ + H2 0 ↑
3) Взаимодействие с основными и амфотерными оксидами:
CuO + 2H + → Cu 2+ + H2O
4) Взаимодействие с основаниями:
Если кислота в избытке, то образуется кислая соль:
5) Обменные реакции с солями:
Качественная реакция на сульфат-ион:
Образование белого осадка BaSO4 (нерастворимого в кислотах) используется для идентификации серной кислоты и растворимых сульфатов.
образование газа — как сильная нелетучая кислота серная вытесняет из солей другие менее сильные кислоты, например, угольную
4. Применение серной кислоты
- в производстве минеральных удобрений;
- как электролит в свинцовых аккумуляторах;
- для получения различных минеральных кислот и солей;
- в производстве химических волокон, красителей, дымообразующих веществ и взрывчатых веществ;
- в нефтяной, металлообрабатывающей, текстильной, кожевенной и др. отраслях промышленности;
- в пищевой промышленности — зарегистрирована в качестве пищевой добавкиE513(эмульгатор);
- в промышленном органическом синтезе в реакциях:
- дегидратации (получение диэтилового эфира, сложных эфиров);
- гидратации (получение этанола);
- сульфирования (получение СМС и промежуточные продукты в производстве красителей);
- и др.
Самый крупный потребитель серной кислоты — производство минеральных удобрений. На 1 т P₂O₅ фосфорных удобрений расходуется 2,2-3,4 т серной кислоты, а на 1 т (NH₄)₂SO₄ — 0,75 т серной кислоты. Поэтому сернокислотные заводы стремятся строить в комплексе с заводами по производству минеральных удобрений.
Это интересно
История серной кислоты (материал взят с сайта alhimikov.net)
Вы все, наверное, знакомы с медным купоросом, кристаллогидратом сульфата меди (II). Купоросами называют кристаллогидраты двухвалентных металлов. Купоросы изучались еще с древних времен. Так, в некоторых работах конца-начала новой эры обсуждались свойства купоросов и их происхождение.
Они упоминаются в трудах греческого врача Диоскорида, римского исследователя природы Плиния Старшего. Об использовании купоросов в металлургии рассказано в работах древнегреческих алхимиков Зосимы из Панополиса. Древний лекарь Ибн Сина использовал различные вещества-купоросы в медицине.
Самым первым способом получения был процесс нагревания алюмокалиевых квасцов . Сведения об этом способе содержатся в алхимической литературе XIII века. Но алхимики не знали сути процесса и состава квасцов. А целенаправленно химическим синтезом серной кислоты стали заниматься в XV веке. Алхимики обрабатывали смесь сульфида сурьмы(III) Sb2S3 и серы при нагревании с азотной кислотой.
Серную кислоту средневековые европейские алхимики называли «купоросным маслом», в последствии купоросной кислотой. Алхимики получали небольшие количества, которые использовались для проведения экспериментов. В XVII веке Иоганн Глаубер получил серную кислоту в результате горения самородной серы с калийной селитрой( нитратом калия) в присутствии паров воды.
Селитра окисляла серу до оксида серы (VI, который впоследствии реагировал с парами воды, в результате чего образовывалась серная кислота. В 30-е годы XVIII века лондонский фармацевт Уорд Джошуа использовал эту реакцию для промышленного производства серной кислоты. Потребности в серной кислоте в средние века исчислялись всего несколькими десятками килограммов.
Она использовалась для аптечных нужд и алхимических опытов. Небольшое количество концентрированной серной кислоты шло производство спичек, которые содержали бертолетовую соль. количество концентрированной кислоты шло для производства особых спичек, содержащих бертолетову соль. На Руси купоросная кислота появилась в семнадцатом веке.
В 1746 г. Джон Робак в английском Бирмингеме наладил производство, адаптировав этот способ для производства серной кислоты, используя освинцованные камеры, которые были прочными , дешевыми более крупными чем стеклянные контейнеры.
 Джон Робак |
Этот способ использовался в промышленности в течение почти двух столетий. В камерах получали кислоту с концентрацией около 65 %, впоследствии усовершенствовав сам процесс (Это сделали французский химик Гей-Люссак и английский Гловер), концентрацию довели до 78%. Однако этих концентраций для некоторых химических процессов, например, при производстве красителей не хватало.
Лишь в 1831 г. британский торговец уксусной кислотой Перегрин Филипс запатентовал экономичный процесс для производства оксида серы (VI) и концентрированной серной кислоты, который известен нам в настоящее время как контактный способ получения серной кислоты.
В 1864 году стали производить суперфосфат. В восьмидесятые годы XIX века производство серной кислоты достигло в Европе 1 млн. тонн. Основными производителями были Англия и Германия, на долю которых приходилось более 72% от мирового объема производства.
5. Применение солей серной кислоты

Железный купорос FеSО4•7Н2O применяли раньше для лечения чесотки, гельминтоза и опухолей желез, в настоящее время используют для борьбы с сельскохозяйственными вредителями.

Медный купорос CuSO4•5Н2O широко используют в сельском хозяйстве для борьбы с вредителями растений.

«Глауберова соль» (мирабилит) Nа2SO4•10Н2O была получена немецким химиком И. Р. Глаубером при действии серной кислоты на хлорид натрия, в медицине ее используют как слабительное средство.

«Бариевая каша» BaSO4 обладает способностью задерживать рентгеновские лучи в значительно большей степени, чем ткани организма. Это позволяет рентгенологам при заполнении «бариевой кашей» полых органов определить в них наличие анатомических изменений.

Гипс СаSO4•2Н2O находит широкое применение в строительном деле, в медицинской практике для накладывания гипсовых повязок, для изготовления гипсовых скульптур.
III. Тренажеры
IV. Задания для закрепления
№1. Осуществите превращения по схеме:
№2. Закончите уравнения практически осуществимых реакций в полном и кратком ионном виде:
№3. Запишите уравнения реакций взаимодействия разбавленной серной кислоты с магнием, гидроксидом железа (III), оксидом алюминия, нитратом бария и сульфитом калия в молекулярном, полном и кратком ионном виде.
Источник: kardaeva.ru