Каждый химический элемент периодической системы и образованные им простые и сложные вещества уникальны. Они имеют неповторимые свойства, а многие вносят неоспоримо значимый вклад в жизнь человека и существование в целом. Не исключение и химический элемент олово.
Знакомство людей с эти металлом уходит в глубокую древность. Этот химический элемент сыграл решающую роль в развитии человеческой цивилизации, по сей день свойства олова находят широкое применение.
Олово в истории
Первые упоминания о данном металле, имеющем, как люди считали раньше, даже некоторые магические свойства, можно найти в библейских текстах. Решающее значение для улучшения жизни олово сыграло в период «бронзового» века. На то время самым прочным металлическим сплавом, которым обладал человек, была бронза, её можно получить, если в медь добавить химический элемент олово. На протяжении нескольких веков из этого материала изготовляли всё, начиная от орудий труда и заканчивая ювелирными изделиями.
Олово — Металл, РАЗРУШАЮЩИЙ САМ СЕБЯ!

После открытия свойств железа сплав олова не перестал использоваться, конечно, он применяется не в прежних масштабах, но бронза, а также многие другие его сплавы активно задействованы сегодня человеком в промышленности, технике и медицине, наравне с солями этого металла, например, таким как хлорид олова, который получают взаимодействием олова с хлором, данная жидкость кипит при 112 градусах Цельсия, хорошо растворяется в воде, образует кристаллогидраты и дымит на воздухе.
Положение элемента в таблице Менделеева
Химический элемент олово (латинское название stannum – «станнум», записывается символом Sn) Дмитрий Иванович Менделеев по праву расположил под номером пятьдесят, в пятом периоде. Имеет ряд изотопов, самый распространённый – изотоп 120. Этот металл также находится в главной подгруппе из шестой группы, вместе с углеродом, кремнием, германием и флеровием. Его расположение предсказывает амфотерность свойств, в равной степени олову присущи и кислотные, и основные характеристики, которые более детально будут описаны ниже.
В таблице Менделеева также указана атомная масса олова, которая равняется 118,69. Электронная конфигурация 5s 2 5p 2 , что в составе сложных веществ позволяет металлу проявлять степени окисления +2 и +4, отдавая два электрона только с р-подуровня или же четыре с s- и р-, полностью опустошая весь внешний уровень.

Электронная характеристика элемента
В соответствии атомному номеру околоядерное пространство атома олова содержит целых пятьдесят электронов, они располагаются на пяти уровнях, которые, в свою очередь, расщеплены на ряд подуровней. Первые два имеют только s- и р-подуровни, а начиная с третьего идёт троекратное расщепление на s-, p-, d-.
Рассмотрим внешний электронный уровень, так как именно его строение и заполнение электронами определяют химическую активность атома. В невозбуждённом состоянии элемент проявляет валентность, равную двум, при возбуждении происходит переход одного электрона с s-подуровня на вакантное место р-подуровня (он максимально может содержать три неспаренных электрона). В этом случае олово проявляет валентность и степень окисления – 4, так как спаренных электронов нет, а значит в процессе химического взаимодействия на подуровнях их ничто не удерживает.
Простое вещество металл и его свойства
Простое вещество олово представляет собой металл серебряного цвета, относится к группе легкоплавких. Металл мягкий, сравнительно легко поддаётся деформации. Ряд особенностей присущ такому металлу, как олово.
Температура ниже 13,2 градуса Цельсия является границей перехода металлической модификации олова в порошкообразную, что сопровождается изменением цвета с серебристо-белого на серый и уменьшением плотности вещества. Плавится олово при 231,9 градуса, а кипит при 2270 градусах Цельсия. Кристаллическая тетрагональная структура белого олова объясняет характерное похрустывание металла при его изгибе и нагреве в месте перегиба трением кристаллов вещества друг об друга. Серое олово имеет кубическую сингонию.

Химические свойства олова имеют двойственную суть, оно вступает как в кислотные, так и основные реакции, проявляя амфотерность. Металл взаимодействует с щелочами, а также кислотами, такими как серная и азотная, проявляет активность при реакции с галогенами.
Сплавы олова

На сегодняшний день известно большое количество сплавов такого металла, как олово (цена на них колеблется в широких пределах), рассмотрим самые популярные и применяемые (о применении тех или иных сплавов речь пойдёт в соответствующем разделе). В общем, сплавы станнума имеют следующие характеристики: высокая пластичность, низкая температура плавления, небольшая твёрдость и прочность.
Некоторые примеры сплавов

Важнейшие природные соединения
Олово образует ряд природных соединений – руд. Металл образует 24 минеральных соединения, самое важное значение для промышленности имеет оксид олова – касситерит, а также станин – Cu2FeSnS4. Олово рассеяно в земной коре, а соединения, образованные им, имеют магнетическое происхождение. В промышленности также используются соли полиоловянных кислот и силикаты олова.
Олово и организм человека
Важно отметить, что избыточное накопление данного металла может привести к общему отравлению организма, а более длительное воздействие — даже к неблагоприятным генным мутациям. В последнее время эта проблема довольно актуальна, так как экологическое состояние окружающей среды оставляет желать лучшего. Большая вероятность интоксикации оловом у жителей мегаполисов и районов, близлежащих около промышленных зон. Чаще всего отравление происходит путем накопления в легких солей олова, например, таких как хлорид олова и других. В то же время недостаток микроэлемента может спровоцировать замедление роста, потерю слуха и выпадение волос.

Применение
Металл имеется в продаже на многих металлургических заводах и компаниях. Выпускается в виде чушек, прутков, проволоки, цилиндров, анодов, изготовленных из чистого простого вещества, такого как олово. Цена колеблется от 900 до 3000 рублей за кг.
Олово в чистом виде применяется редко. В основном используются его сплавы и соединения – соли. Олово для пайки применяется в случае скрепления деталей, которые не подвергаются воздействию высоких температур и сильных механических нагрузок, выполненных из медных сплавов, стали, меди, но не рекомендуется для изготовленных из алюминия или его сплавов. Свойства и характеристики оловянных сплавов описаны в соответствующем разделе.
Припои используют для пайки микросхем, в этой ситуации также идеально подходят сплавы на основе такого металла, как олово. Фото изображает процесс применения оловянно-свинцового сплава. С помощью него можно выполнить достаточно тонкие работы.
Ввиду высокой стойкости олова к коррозии его применяют для изготовления луженого железа (белой жести) – жестяных банок для пищевых продуктов. В медицине, в частности в стоматологии, олово задействовано для выполнения пломбирования зубов. Оловом покрыты домовые трубопроводы, из его сплавов изготовлены подшипники. Неоценимо важен вклад данного вещества и в электротехнику.

Водные растворы таких солей олова, как фторбораты, сульфаты, а также хлориды, используют в качестве электролитов. Оксид олова – это глазурь для керамики. Путём введения в пластические и синтетические материалы различных производных олова представляется возможным уменьшить их возгораемость и выделение вредоносных дымов.
Источник: fb.ru
Химический элемент олово (Sn) — свойства, получение и применение металла

Вещество представляет собой пластичный ковкий металл, который легко плавится и поддается пайке. Химический элемент олово — нетоксичное покрытие, трудно поддающееся коррозии. Металл серебристо-белого цвета используется в чистом виде или с примесью других веществ. В основном олово применяется при изготовлении пищевой тары, домашних трубопроводов, припоев в электронике, подшипников и других деталей.

Общее описание
Люди начали добывать руду металла еще в IV веке до нашей эры. Древние греческие и римские предметы изготавливались из оловянистой бронзы, которая была в обиходе в те времена. Сплавы содержали также примесь свинца и меди, а чистый металл научились получать только в VII веке.

Редкий элемент занимает 46-е место по распространенности в коре земли. Он залегает в виде касситерита, в массе которого содержится до 78% олова. Реже встречается оловянный колчедан с примесью меди и железа. Олово относится к группе амфотерных веществ. Элемент способен к проявлению основных и кислотных характеристик.
Металл образует отдельные кварц-касситеритовые жилы благодаря тесной связи кислородных соединений олова с ангидритами гранита. Щелочные свойства проявляются в образовании различных соединений сульфидов, вплоть до возникновения интерметаллических слияний и самородного сплава олова в основных породах.
Белое и серое олово
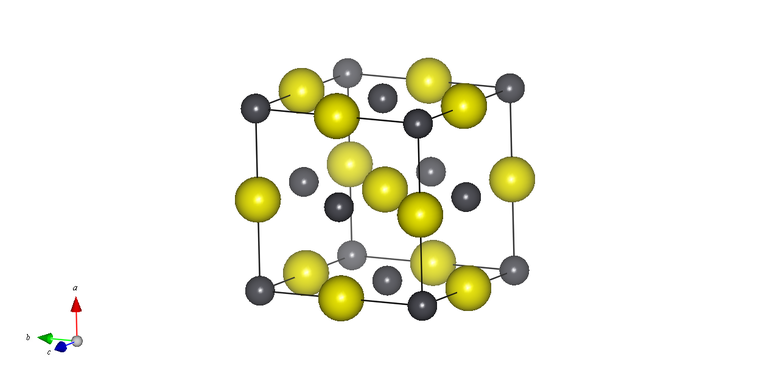
Различают несколько аллотропных модификаций олова. В обычных условиях существует белое олово, которое является устойчивым при температуре свыше +13,3˚С. Это мягкий металл, образующий кристаллы с элементарными ячейками, где два одинаковых вектора и третий отличный от них располагаются строго перпендикулярно друг другу. Характерный хруст слышится при сгибании прутка. Звук возникает при трении кристаллов.
Охлаждение вещества ведет к образованию серого олова. При этом возникают кубические кристаллы, отличающиеся алмазной структурой. Ионизирующее излучение также способствует переходу из одной модификации в другую и кристаллизации по карбонатному типу.

- удельный объем увеличивается;
- плотность олова уменьшается;
- металл становится порошкообразным.
Электрофизические свойства двух вариаций разнятся из-за отличия структурных решеток и валентности. Белое олово относится к группе металлов, а серое получает характеристики ковалентного кристалла алмазной структуры. Соприкосновение двух модификаций ведет к ускорению электронного фазового перехода, так как зарождаются новые формы кристаллов.
Такое явление получило наименование оловянной чумы. Используется стабилизатор (например, висмут) для предотвращения этого процесса. Катализатор гексахлорстаннат аммония, наоборот, ускоряет переход.
Изотопы элемента
Олово в природе содержит 10 неизменных нуклидов с определенным суммарным числом нейтронов, протонов и электронов в молекуле. Атомный заряд также является постоянным и соответствует порядковому номеру элемента в таблице Менделеева в химии.
Массовые числа нуклидов с изменением содержания в массе:

- 112 — 0,96% в смеси.
- 114 — 0,66%.
- 115 — 0,35%.
- 116 — 14,3%.
- 117 — 7,61%.
- 118 — 24,03%.
- 119 — 8,58%.
- 120 — 32,85%.
- 122 — 4,72%.
- 124 — 5,94%.
Некоторые элементы могут подвергаться энергетическому двойному распаду, но такое явление до сегодняшнего дня не наблюдалось из-за величины теоретического времени распада, равного 10 20 лет. У олова выделяется самое большее количество стабильных изотопов. Они заполняют протонную капсулу и увеличивают устойчивость ядра.
Свойства металла

Олово относится к безопасным для человека веществам. В организм человека оно ежедневно попадает с пищей в минимальных пропорциях (0,25−3,4 мг). В теле содержится около (1−2) . 10 -4 % металла. Самая высокая концентрация выявляется в кишечнике. Регулярное вдыхание паров или воздушных частиц может нанести вред и привести к легочным заболеваниям.
Людям, работающим с органическими сплавами олова, рекомендуется надевать защитные костюмы.
Причиной отравления может стать употребление старых консервов, в которых органические продукты реагируют с внутренним покрытием из олова, происходит окисление, при этом выделяется оловянистый водород. Роль вещества в организме человека практически не изучена. Металлическое олово считается нетоксичным для человека, поэтому применяется для покрытия жестяных тар для продуктов.
Физические характеристики
Плотность металла в твердой фракции при обычной температуре (+ 20−22˚С) составляет 7,3 г/см 3 , повышение показателей до температуры плавления олова (+231,8˚С) снижает плотность жидкого металла до 6,97 г/см 3 . Процесс кипения начинается в условиях температуры +2615˚С.
Другие факты:

- Показатель линейного расширения составляет 1,99 . 10 -5 К -1 (при 0˚С), а при температуре +100˚С равняется 2,38 . 10 -5 К -1 .
- Удельная теплоемкость твердого вещества в обычном состоянии — 225 Дж/кг . К, а в жидком —в пределах 269 Дж/кг . К.
- Молярная теплоемкость белого олова — 27,1Дж/моль . К, серой модификации — 25,8 Дж/моль . К.
- Показатель плавления составляет 7,2 кДж/моль.
- Для испарения требуется 296 кДж/моль.
- Удельное сопротивление электричеству — 0,115−0,128 мкОм . м в условиях температуры +25˚С.
Упругость материала снижается при повышении температуры, при 0˚С модуль равен 55 Гпа, а при +100˚С — 48 Гпа. Временное сопротивление на разрыв равняется 20 Мпа, относительное удлинение при этом составляет 40%. Модуль сдвига находится в пределах 16,9−8,2 Гпа.
Химические показатели
Металл проявляет устойчивость к действию окружающего воздуха или влаги в условиях комнатной температуры. Инертность материала объясняется появлением оксидной пленки на поверхности. Олово начинает окисляться на воздухе при увеличении температуры свыше +150˚С. Металл обладает двумя окислительными степенями, +2 и +4. Первая имеет меньшую устойчивость.
Формулы характерных химических реакций:
- Холодная азотистая кислота реагирует с оловом, формула следующая: 4 Sn + 10 HNO 3 = NH 4 NO 3 + 4 Sn (NO 3) 2 + 3 H 2 O).
- В случае нагревания с концентрированной формой HN О 3 используется свойство окисления олова, при этом выделяется осадок с переменной гидратацией — 3 Sn + n H 2 O + 4 HNO 3 = 4 NO + 3 H 2 S n O 3 . n H 2 O.
- Нагревание олова в насыщенном щелочном растворе имеет обозначение по формуле 2 KOH + Sn + 4 H 2 O = 2 H 2 + K 2 (Sn (OH) 6).
Этапы производства
При получении олова рудная порода касситерит дробится в мельницах до появления частиц размером около 1 см. Следующий этап — отделение вещества от пустой породы путем вибрации на гравитационных столах. Затем используется метод очистки и обогащения руды для повышения олова в составе до 45−72%.
Последующий обжиг удаляет мышьяк и серу, а полученный концентрат поступает на обжиг в печи. В жерле древесный уголь укладывается вперемежку с образцами руды и алюминием. Чистый металл полупроводниковой чистоты получают способом расплавления твердых веществ или методом очистки под действием электролиза.
Основные месторождения находятся на юго-востоке Азии и Китае, крупные добычи находятся в Австралии и Америке. Россия славится залежами олова в Хабаровском и Приморском крае, Чукотском АО, Якутии и других регионах.

Нахождение в природе
Чаще всего олово содержится в горных породах в виде рассеянных форм. Но в кислых образованиях руда встречается в виде минеральных вкраплений и залежей касситерита, который является интересным для производства в промышленных масштабах.
Формы содержания вещества в природе:
- минеральные вкрапления;
- окисные соединения;
- коллоидные формы;
- жидкие фазы.

Рассеянные залежи не отличаются конкретной формой содержания. Наблюдается изоморфно разбросанные сульфидные и кислородные сращения. На месторождениях первого вида олово представлено сфалеритами, халькопиритами, пиритами. В результате распада возникают элементы тилита и других минеральных веществ. В России изоморфные рассеивания обнаруживаются в Приморье, например, в Дубровском и Смирновском месторождении.
Минеральные формы
В группу входят самородки и сплавы интерметаллических образований. Концентрации в почве являются низкими, но такие залежи сконцентрированы на широких площадях. Вместе с оловом обнаруживается руда меди, алюминия, железа, не считая характерных самородков серебра, золота и платиноидов.
Эти же элементы участвуют в образовании сплавов олова:
- атакит;
- стистаит;
- звягинцевит;
- штурмылит.
Приведенные образования встречаются в интрузивных породах магния, например, пикритах и траппах в области Сибирской платформы. Габброиды и гипербазиты располагаются в грунтах Камчатки. Гидротермальные и метасоматические породы находятся в составе никелевых и медных руд в бассейнах Урала, Узбекистана, Кавказа. Пелагические осадочные соединения являются результатом Большого Толбачинского извержения.
Окисные соединения
Наиболее распространены в природе в форме касситеритов (Sn O 2), являющихся оксидами олова. Гамма-резонансное исследование показывает присутствие Sn +4 . Соединения включают до 78% олова в форме сплошных вкраплений с отдельными зернами минерала величиной 3−5 мм.
Встречаются формы касситеритов:

- Гидроокисные сплавы представлены в природе осадками полиоловянной кислоты. К ним относят сукулаиты, варламовиты, гидромартиты, гидростаннаты.
- Силикаты находятся в форме малаяитов, стоказитов, пабститов. Первый вид минералов встречается в больших масштабах.
- Сульфидные образования металла представлены серой в сочетании с оловом и являются второй по значению группой для промышленных разработок. Более сложные соединения имеют в составе медь, свинец. В породах чаще других встречаются халькопириты.
- Станнины имеют второе название оловянного колчедана. Минералы широко добываются в Якутии и Приморье. Во многих случаях представляет основу для образования халькопирита.
Касситериты являются отличным материалом для получения чистого олова. В России добываются в Забайкалье, разрабатываются в районах Средней Азии. Мировые бассейны располагаются в Таиланде, Боливии, Малайзии, Китае, Индонезии, Нигерии.
Коллоидные формирования
Кремниево-коллоидные виды играют большую роль в геохимических процессах, хотя их детальное изучение не проводилось. Соединения относятся к вязкой форме выражения коломорфных касситеритов, которые подвергаются кристаллическим преобразованиям. Обнаружена сильная растворимость олова в кремниево-хлористых составах.
Анализ характеристик соединений и их похожесть на Si (OH) 4 показывает способность к получению высокомолекулярного материала (полимера) методом присоединения олигомеров и мономеров к активным молекулам. В результате возникает соединение с замещением анионами хлора и фтора группы ОН. Полимеризация вызывает образование дисперсного геля. Такая форма относится к промежуточным этапам при выделении осадка из гидротермальных веществ.
Жидкая фаза
В газовых и жидких образованиях горных пород выявляются касситериты в категории заключенных минералов. Природные растворы с включением олова почти не анализировались, информация получена после экспериментальных методов исследования.
Виды содержания олова в природных жидкостях делятся на категории:
- Ионные соединения. Их строение изучалось с точки зрения валентных сцеплений и стереохимических сочетаний. Выделяются подкатегории ионов, галогенидов, гидроксильных и сульфидных образований.
- Комплексные формирования. Получаются в результате травления касситеритов в среде с высокой концентрацией фтора или хлора.
Редко встречаются олово — кремниевые и дисперсные гелевые вкрапления в жидкой природной среде. Фундаментом этих форм являются минеральные материалы. Соединения проявляют свойства слабых оснований в кислых породах.
Источник: nauka.club
Олово (Sn, Stannum)
Олово – один из древнейших известных человечеству металлов, первые изделия из оловянной бронзы (сплав, где наряду с оловом присутствует медь) датируются III тысячелетием до н.э. Латинское название stannum связано с санскритом, где есть похожий термин для определения сплава серебра и свинца, который был чрезвычайно прочный (calorizator). Собственно название олово было образовано от нескольких слов в славянских языках, обозначающих белый или жёлтый цвет.

Общая характеристика олова
Олово является элементом XIV группы V периода периодической таблицы химических элементов Д.И. Менделеева, имеет атомный номер 50 и атомную массу 118,710. Принятое обозначение – Sn (от латинского stannum).
Нахождение в природе
Олово считается редким рассеянным элементом, основное количество содержится в минерале касситерите (оловянном камне), основные месторождения олова на территории Китая, Индонезии, Таиланда, Малайзии, Перу, Боливии и Бразилии.
Физические и химические свойства
Олово является лёгким, пластичным, легкоплавким и ковким металлом, имеет блестящую поверхность серебристо-белого цвета. Инертен к воздействию воздуха при обычных температурах благодаря образующейся на поверхности оксидной плёнке.

Суточная потребность в олове
Суточная потребность в олове чётко не установлена, считается, что человеку достаточно 2-10 мг в день. Ежедневно организм с едой получает до 50 мг микроэлемента (при заявленной токсичной дозе в 20 мг), но отравления не происходит потому, что усваивается не более 5% олова, остальное естественным путём выводится с мочой.
Продукты питания богатые оловом
Основными поставщиками олова для организма человека традиционно считаются говядина, свинина, индейка и курица, молоко и молочные продукты, фасоль, горох и семечки подсолнуха, свёкла и картофель.

Признаки нехватки олова
Недостаточное количество олова в организме человека встречается крайне редко и характеризуется следующими признаками:
- замедление роста;
- ухудшение слуха;
- потеря веса;
- выпадение волос;
- дисбаланс минерального состава.
Признаки избытка олова
Избыток олова случается у работающих с солями олова и у тех, кто часто питается консервами в железных банках, которые имеют свойство разрушаться при длительном хранении, поэтому, если содержимое банки не используется сразу, есть смысл переложить продукты в стеклянную или пластиковую ёмкость. Избыток олова характеризуется:
- анемией;
- мигренями и головокружениями;
- металлическим привкусом во рту;
- увеличением печени;
- воспалительными реакциями на коже;
- снижением аппетита, рвотой, поносом;
- изменением цвета кожи (бледность с серым оттенком) и дёсен (синева);
- возбуждением и немотивированной агрессией.
Применение олова в жизни
Олово применяют как в чистом виде, так и в сплавах для изготовления безопасных и стойких к коррозии покрытий, также в химической промышленности, стекольном деле и для окраски шерсти.

Полезные свойства олова и его влияние на организм
Роль олова на процессы, происходящие в организме, изучена не в полном объёме, на сегодняшний день понятно, что микроэлемент участвует в процессах роста и в окислительно-восстановительных реакциях, присутствует в желудочном ферменте (гастрин), способствует нормальному развитию костных тканей.
Источник: calorizator.ru