Олово – это материал, который, как и многие другие, подвержен коррозии. Под действием различных внешних факторов с течением времени он начинает разрушаться. Это представляет прямую угрозу для использования оловянных деталей, потому что они теряют свою надежность, больше не могут эксплуатироваться в нужных условиях.
Коррозия может поражать различные варианты оловянных сплавов. При этом серьезную угрозу представляет среда, в которой применяется заготовка – она может как замедлить, так и ускорить процесс коррозийного разрушения.
В этом материале мы рассмотрим, как проходит коррозия олова, какие опасные факторы могут на нее повлиять. Мы также коснемся темы создания безопасной среды, в которой оловянные изделия различного назначения могли бы подвергаться коррозии со значительно менее высокой степенью вероятности.
Особенности олова как материала
Коррозия олова – это процесс его постепенного разрушения. Запускается под действием как внешних факторов среды, так и внутренних рисков, к примеру, повышенного напряжения, влияния сильных нагрузок.
Электрохимическая коррозия
Если рассматривать характеристики олова как материала, то можно установить, что это металл серебристо-белого цвета. В силу не самой высокой плотности, его можно легко подвергать разным вариантам обработки. Промышленность использует различные средства работы с оловом – к ним относится ковка, плавление, пластическая деформация и многие другие.
Среди металлов, которые активно используются в промышленности, температура плавления олова является одной из наиболее низких. В жидкое состояние оно начинает переходить уже при прогреве до 231,9 °С. Во многом это связано с тем, что плотность олова составляет всего 7,3 г/см3 при стандартной температуре 20 ºС.
По мере своего нагрева, материал становится все менее плотным, сначала размягчается и потом переходит в жидкое состояние. В таком варианте его можно переливать в специальные формы, которые после остывания помогут создать готовое изделие.
При рассмотрении вопросов коррозийной стойкости стоит также обратить внимание и на фактор электродного потенциала. В случае с таким материалом он будет находиться на уровне -0,136 В.
Сегодня в промышленности применяется два основных варианта олова:
- Белое. Его особенность – существование при температуре выше 13,2 ºС.
- Серое. Существует при температуре ниже 13,2 ºС.
Именно температура становится важным фактором превращения одного материала в другое. Если материал перешагивает через отметку в 13,2 ºС, наблюдается развитие аллотропического превращения. При этом создается особый порошок серого цвета, который также можно встретить под названием оловянная чума.
Если температура опускается до уровня -48 ºС достигает наиболее высокая скорость постепенного превращения белого олова в серое.
Именно особенности физических характеристик и состава во многом влияют на коррозийные свойства такого материала. Рассмотрим их более подробно далее.
Коррозия металла. Химия – Просто
Несмотря на свою низкую плотность и сильную разрушаемость в агрессивных средах, олово на удивление хорошо показывает себя при контакте с водой. При этом одинаково хорошая устойчивость демонстрируется как в случае с пресной, так и с морской водой. То же самое относится к применению на открытом воздухе – уровень стойкости становится достаточно высоким, что сильно расширяет список потенциальных областей применения.
Показательно то, что на протяжении довольно длительного времени олово использовалось при монтаже трубопроводов. Они отличаются высокой склонностью к коррозии, при том, что допустить коррозийного повреждения коммуникаций такого типа нельзя – есть большой риск аварии в инженерных сетях. Но по мере роста цен на олово его стали заменять менее дорогим алюминием. Сегодня олово продолжает активно применяться при создании различных типов оборудования и посуды для пищевой промышленности.
Сегодня олово может применяться как в чистом виде, так и при создании специального луженого железа. Этот материал отличается тем, что его поверхность покрывается оловянной пленкой. Также можно встретить такое железо под названием «белая жесть».
Область использования подобного материала очень обширна. Он может использоваться при создании различной тары разного объема – от небольших консервных банок до крупных цистерн большой вместимости. Также допускается применение подобной продукции в том случае, если требуется создавать приспособления для пищевой промышленности, а также других областей использования.
Особенности протекания процесса коррозии олова
Олово относится к списку материалов, которые отличаются высоким уровень атмосферности. При этом разрушение стимулирует довольно большое количество факторов, в том числе, попадание в агрессивные среды, контакты с щелочами, кислотами, которые могли бы нанести материалу серьезный вред.
Если говорить о коррозии материалов, которые покрыты оловянным слоем, таких, как луженое железо, стоит обратить внимание на высокие требования к сохранности самого защитного слоя. Во время эксплуатации на нем не должно появляться никаких трещин. В таком случае можно гарантировать, что исходный материал окажется хорошо защищен против самых разных вариантов внешнего негативного воздействия. К ним относятся такие, как контакт с агрессивными средами и многое другое.
Потенциально достаточно высокую опасность представляет контакт олова со многими видами агрессивных сред, в которых оно может оказаться. Здесь основной фактор – это непосредственно состав самой подобной агрессивной среды.
Обычно при протекании активного коррозийного процесса не выделяется водород, либо он фиксируется в достаточно небольшом количестве, чтобы говорить о незначительности появления. Если на какой-то материал наносится дополнительное оловянное покрытие, то водород начинает выделяться уже после того, как оно оказывается полностью нейтрализована.
Так как олово часто используется для того, чтобы создавать различные типы тары, стоит обратить внимание на то, что именно перевозится или хранится в такой таре. Есть масса факторов, которые потенциально могут увеличить степень опасности полного разрушения материала или частичного уменьшения плотности, потери прочности.
Часто коррозия олова наблюдается при контактах с кислотами. При этом интенсивность и скорость ее протекания будут значительно отличаться в зависимости от концентрации и самого типа кислоты. К примеру, если металл начинает контактировать с серной кислотой, реакция происходит по формуле Sn + 4H2SO4 = Sn(SO4)2 + 2SO2 + 4H2O. На фоне нее протекает быстрое образование сульфата.
Еще один случай – контакт материала с соляной кислотой. Процесс можно описать формулой Sn + 2HCl = SnCl2 + H2↑. Водород в таком случае начинает выделяться значительно более активно – это удается зафиксировать с использованием различных методов. Побочным продуктом становится появление хлорида.
Ученые также наблюдают за особенностями поведения такого материала при вступлении в контакт с азотной кислотой в концентрированном виде. Интересной особенностью становится то, что при реакции начинает создаваться не только оксид азота, представляющий токсическую опасность, но и оловянная кислота. Реакция в таком случае может быть записана следующей формулой: Sn + 4HNO3 = H2SnO3 + 4NO2 + H2O..
Олово относится к категории металлов, которые показывают низкую скорость коррозии при контакте с щелочами. Сам процесс при этом протекает довольно медленно, на фоне можно наблюдать значительное выделение водорода. Есть и другая особенность – формирование солей, в данном случае станнаатов натрия. Химическая формула, по которой протекает такая реакция, записывается как Sn + 2NaOH = Na2SnO2 + H2↑.
Особо опасные среды для коррозии олова
Существует ряд сред, в которых вероятность появления коррозионного процесса в олове становится значительно выше. Потому при планировании использования такого материала, попадания в подобные среды стоит избегать, либо позаботиться о том, чтобы была создана оптимальная защита, существенно уменьшающая риски для металла.
К списку агрессивных сред, увеличивающих риск развития коррозии олова относятся следующие:
- Азотная кислота. Есть масса потенциальных рисков для материала, причем вне зависимости от того, в какой концентрации находится кислота. Она может попасть на поверхность каплями, либо находиться в постоянном контакте с материалом. Таким образом произойдет быстрое разрушение материала, коррозия начнет распространяться по всей его поверхности. Концентрация, температура и другие внешние аналогичные факторы в подобной ситуации не имеют большого значения.
- Щелочи. Речь идет про щелочи в высокой концентрации. При нагреве температура становится дополнительным катализатором разрушительного процесса для материала. Если же щелочи находятся в невысокой концентрации, они практически безвредны для материала. Стоит обратить внимание, что при использовании ряда продуктов, есть риск создания щелочной среды.
- Соляная и серная кислота в высоких концентрациях. Здесь также стоит помнить о том, что в низком содержании кислота не представляет угрозы для материала. Но по мере нарастания уровня ее содержания, есть риск того, что материал будет сильно разрушен.
При планировании использования оловянных изделий либо специальных металлических листов, которые покрыты слоем олова, стоит помнить о том, как среда может повлиять на такой вариант материала. Нельзя допустить, чтобы коррозия началась скрытно, и вы не смогли вовремя на нее среагировать.
Среды с низкой степенью опасности для коррозии олова
Исходя из описанного выше можно сделать предположение, что олово отличается низкой коррозийной стойкостью и есть слишком много сред, которые представляют для него опасность. Но также есть и множество областей использования, которые не создают потенциального риска наступления коррозийного разрушения. К ним относятся такие, как:
- Вода. Олово может на протяжении длительного времени использоваться без коррозийного повреждения в природной воде. Главный фактор защиты в таком случае – степень концентрации загрязнителей в воде. Если их много, то появляется опасность, что коррозия начнет распространяться достаточно быстро и при этом захватывать все новые пространства.
- Пищевая среда. Часто луженое железо, на которое нанесено специальное оловянное покрытие, используется для того, чтобы качественно упаковывать различные типы продуктов, в том числе, консервы. В таком случае олово показывает низкие показатели коррозии. Многое зависит от того, какую именно среду формирует продукт. Риск есть только при повышенной кислотности и щелочности, но доводить эти значения до опасных для материала могут только немногие продукты.
- Солевые растворы. Если соли в растворе нейтральные, можно не опасаться, что олово начнет постепенно ржаветь.
- Воздух. Большое значение здесь имеет температура воздуха. Если он прогревается до уровня выше отметки в 150 ºС, есть вероятность того, что разрушение все-таки начнется. Если говорить об атмосфере, стоит также обратить внимание на ее состав. Если есть какие-либо сильные загрязнения, угрозы становятся значительно выше.
- Кислоты в малой концентрации. Можно безопасно использовать олово в том случае, если оно оказывается в контакте с серной, соляной и органической кислотами. Главное условие – такие вещества должны быть разбавлены.
Чтобы оловянные изделия или металлы с таким покрытием могли прослужить как можно дольше, важно также позаботиться о дополнительных средствах защиты против коррозии. К ним относятся создание на материале специальной пленки для защиты от потенциального негативного воздействия, исключение контакта с агрессивными средами, трения, сильного механического повреждения поверхности. Набор защитных мер и средств для каждого конкретного случая стоит выбирать на индивидуальной основе.
Закажите качественное цинкование
Наша компания давно и успешно занимается проведением качественного горячего цинкования. Такая процедура обеспечивает повышенный уровень защиты материала против внешнего негативного давления, к примеру, когда требуется не допустить контакта с источниками окисления и агрессивными средами.
КОРРОЗИЯ И ЗАЩИТА МЕТАЛЛОВ И СПЛАВОВ
77. Какие металлы (Fe, Ag, Ca) будут разрушаться в атмосфере влажного воздуха, насыщенного диоксидом углерода? Ответ дайте на основании вычисления соответствующих процессов.
78. Алюминий склепан с медью. Какой из металлов будет подвергаться коррозии, если эти металлы попадут в кислую среду? Составьте схему гальванического элемента, образующегося при этом. Подсчитайте ЭДС и этого элемента при стандартных условий.
79. Железо покрыто никелем. Какой из металлов будет корродировать в случае разрушения поверхности покрытия? Коррозия происходит в кислой среде. Составьте схему гальванического элемента, образующегося при этом.
80. Олово спаяно с серебром. Какой из металлов будет окисляться при коррозии, если эта пара металлов попадет в щелочную среду? Ответ дайте на основании вычисления ЭДС и образующегося гальванического элемента.
81. Железо покрыто хромом. Какой из металлов будет корродировать в случае нарушения поверхностного слоя покрытия в атмосфере промышленного района (влажный воздух содержит СО2, Н2S, SO2 и др.)? Составьте схему процессов, происходящих на электродах образующегося гальванического элемента.
82. При работе гальванического элемента:
образовавшегося при коррозии алюминия, который находится в контакте с хромом, за 1 мин 20 с его работы на хромовом катоде восстановилось 0,034л кислорода. Определите, на сколько уменьшилась при этом масса алюминиевого электрода и чему равна сила тока, протекающего во внешней цепи гальванического элемента.
83. Гальванический элемент:
образовавшийся при коррозии хрома, спаянного со свинцом, дает ток силой 6 А. Какая масса хрома окислится и сколько литров водорода выделится за 55 с работы этого элемента?
84. Медь покрыта оловом. При нарушении оловянного покрытия работает гальванический элемент:
который дает ток силой 7,5 А. Какая масса олова растворится и сколько литров водорода выделится на медном катоде за 25 мин?
85. При работе гальванопары:
за 1,5 мин образовалось 0,125 г Fe(OH)2. Вычислите объем кислорода, израсходованный на получение Fe(OH)2. Сколько электричества протекло во внешней цепи гальванического элемента за это время?
86. При нарушении поверхностного слоя цинкового покрытия на железе идет процесс коррозии вследствие работы гальванопары:
За 48 с работы этой гальванопары через внешнюю цепь протекло 550 Кл электричества. Какая масса Zn растворилась при этом и какой объем водорода выделился на железном катоде?
87. При коррозии железа, покрытого кадмием, в кислой среде работает гальванический элемент:
(–) Fe/0,1 моль/л Fe 2+ | 1н HCl | (Cd) H2/2H + (+)
Определите, как изменится ЭДС гальванического элемента, если концентрация иона Fe 2+ возросла до 0,15 моль/л.
88. Никель находится в контакте с золотом во влажном воздухе, насыщенном сероводородом. Коррозия никеля происходит вследствие работы гальванопары:
ЭДС этого гальванического элемента равна 0,285 В. Определите, как изменится ЭДС гальванического элемента при его работе, если концентрация ионов Ni 2+ возрастает до 0,25 моль/л.
89. При нарушении целостности поверхностного слоя медного покрытия на алюминии будет коррозия вследствие работы гальванопары:
За 45 с работы этой гальванопары на катоде выделилось 0,09 л водорода (измеренного при н.у.). Какая масса алюминия растворилась за это время и какую силу тока дает эта гальванопара?
90. В раствор хлороводородной (соляной) кислоты поместили цинковую пластинку и цинковую пластинку, частично покрытую медью. В каком случае процесс коррозии цинка происходит интенсивнее? Ответ мотивируйте, составив электронные уравнения соответствующих процессов и вычислить указанных процессов.
91. Две железные пластинки, частично покрытые одна оловом, другая медью, находятся во влажном воздухе. На какой из этих пластинок быстрее образуется ржавчина? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этих пластинок. Каков состав продуктов коррозии железа?
92. Если опустить в разбавленную серную кислоту пластинку из чистого железа, то выделение на ней водорода идет медленно и со временем почти прекращается. Однако если цинковой палочкой прикоснуться к железной пластинке, то на последней начинается бурное выделение водорода. Почему? Какой металл при этом растворяется? Составьте электронные уравнения анодного и катодного процессов.
93. Почему химически чистое железо более стойко против коррозии, чем техническое железо? Составьте электронные уравнения анодного и катодного процессов, происходящих при коррозии технического железа во влажном воздухе и в кислой среде.
94. Железные бочки применяют для транспортировки концентрированной серной кислоты, но после освобождения от кислоты бочки часто совершенно разрушаются вследствие коррозии. Чем это можно объяснить? Что является анодом и что катодом? Составьте электронные уравнения соответствующих процессов.
95. В раствор электролита, содержащего растворенный кислород, опустили цинковую пластинку и цинковую пластинку, частично покрытую медью. В каком случае процесс коррозии цинка происходит интенсивнее? Составьте электронные уравнения анодного и катодного процессов.
96. Как влияет рН среды на скорость коррозии железа и цинка? Почему? Составьте электронные уравнения анодного и катодного процессов атмосферной коррозии этих металлов.
97. Цинковую и железную пластинки опустили в раствор сульфата меди. Составьте электронные и ионные уравнения реакций, происходящих на каждой из этих пластинок. Какие процессы будут проходить на пластинках, если наружные концы их соединить проводником?
98. Какой металл целесообразней выбрать для протекторной защиты от коррозии свинцовой оболочки кабеля: цинк, магний или хром? Почему? Составьте электронные уравнения анодного и катодного процессов атмосферной коррозии. Каков состав продуктов коррозии?
99. Железное изделие покрыли кадмием. Какое это покрытие — анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и в соляной кислоте. Какие продукты коррозии образуются в первом и во втором случаях?
100. Какое покрытие металла называется анодным и какое катодным? Назовите несколько металлов, которые могут служить для анодного и катодного покрытия железа. Составьте электронные уравнения анодного и катодного процессов, происходящих при коррозии железа, покрытого медью во влажном воздухе и в сильнокислой среде.
Источник: 4-i-5.ru
Учебно-методическое пособие «Защита материалов от коррозии» , страница 41

ЭДС этого гальванического элемента равна 0.285 В. Определите, как изменится ЭДС гальванического элемента при его работе, если концентрация ионов Ni +2 возрастет до 0.25 моль/л, а перенапряжение выделения водорода на золоте равно 0.15 В.
21. Железо покрыто никелем. Какой из металлов будет корродировать в случае разрушения поверхности покрытия? Коррозия происходит в кислой среде. Составьте схему гальванического элемента, образующегося при этом.
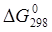
22. Олово спаяно с серебром. Какой из металлов будет окисляться при коррозии, если эта пара металлов попадет в щелочную среду? Ответ дайте на основании вычисления ЭДС и образующегося гальванического элемента.
23. Железо покрыто хромом. Какой из металлов будет корродировать в случае нарушения поверхностного слоя покрытия в атмосфере промышленного района (влажный воздух содержит CO2, H2S, SO2 и др.)? Составьте схему процессов, происходящих на электродах образующегося гальванического элемента.
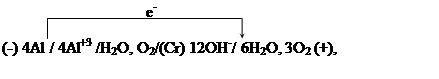
24. При работе гальванического элемента
образовавшегося при коррозии алюминия, который находится в контакте с хромом, за 1 мин 20 с. его работы на хромовом катоде восстановилось 0.034 л кислорода. Определите, на сколько уменьшилась при этом масса алюминиевого электрода и чему равна сила тока, протекшего во внешней цепи гальванического элемента.
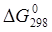
25. Алюминий склепан с медью. Какой из металлов будет подвергаться коррозии, если эти металлы попадут в кислотную среду? Составьте схему гальванического элемента, образующегося при этом? Подсчитайте ЭДС и этого элемента для стандартных условий.
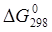
26.Исходя из величины , определите, какие из приведенных ниже металлов будут корродировать во влажном воздухе по уравнению
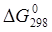
27. Какие металлы: Fe, Ag, Ca — будут разрушаться в атмосфере влажного воздуха, насыщенного диоксидом углерода? Ответ дайте на основании вычисления соответствующих процессов.
Примеры решения задач.
Пример 1. Вычисление электродных потенциалов металлов. Вычислите электродный потенциал цинка, опущенного в раствор его соли с концентрацией ионов Zn +2 = 0.001 моль/л.
Решение. Вычисление электродного потенциала j производят по уравнению Нернста:
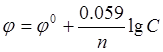
где j 0 — стандартный электродный потенциал; n — число электронов, участвующих в обратимо протекающем окислительно-восстановительном процессе; C — концентрация катионов металла в растворе, моль/л. Стандартный электродный потенциал цинка 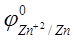 равен — 0,76 В. Отсюда
равен — 0,76 В. Отсюда 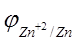 = -0.76 + (0.059/2)×lg10 -3 = -0.76 — 0.0295×3 = -0.85 В.
= -0.76 + (0.059/2)×lg10 -3 = -0.76 — 0.0295×3 = -0.85 В.
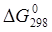
Пример 2. Определение возможности протекания реакции в гальваническом элементе. Исходя из величин стандартных электродных потенциала и значения укажите, можно ли в гальваническом элементе осуществить следующую реакцию:
Fe + Cd +2 ® Fe +2 + Cd
Решение. Составим гальванический элемент, отвечающий этой реакции.
На аноде происходит окисление атомов железа: Fe – 2e = Fe +2 ,
на катоде — восстановление ионов кадмия: Cd +2 + 2e = Cd.
В гальваническом элементе отрицательным будет железный электрод, а положительным-кадмиевый. Схема гальванического элемента:
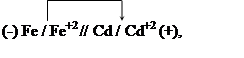 |
Пользуясь таблицей стандартных электродных потенциалов, определяем ЭДС этого гальванического элемента:
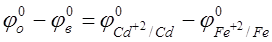
E = = -0.40 – (-0.44) = 0.04 В
Изменение величины энергии Гиббса DG с величиной ЭДС элемента связано соотношением: DG = -nFE,
где n — число электронов, принимающих участие в реакции, F — постоянная Фарадея (96500 Кл/моль); E — ЭДС гальванического элемента.
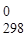
Следовательно, DG = -2×96500×0.04 = -7720 Дж.
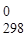
Так как DG < 0, поэтому данную реакцию можно осуществить в гальваническом элементе. Реакция в выбранном направлении протекает самопроизвольно.
Пример 3. Вычисление потенциала электрода по величине константы равновесия реакции. Константа равновесия реакции, протекающей в гальваническом элементе
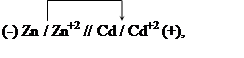 |
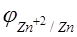
равна 2.022×10 5 . Определите электродный потенциал кадмия, если электродный потенциал цинка равен -0,789В.
Источник: vunivere.ru