Коррозия – это разрушение металла в результате его физико-химического взаимодействия с окружающей средой. По механизму протекания коррозионного процесса различают химическую и электрохимическую коррозию.
Химическая коррозия представляет собой самопроизвольное разрушение металлов в среде окислительного газа (например, кислорода, галогенов) при повышенных температурах или в жидких неэлектролитах.
Уравнение реакции окисления металлов кислородом (пример газовой коррозии) можно записать в общем виде:

.
Электрохимическая коррозия протекает при контакте металла с растворами электролитов. Например, наиболее распространённая атмосферная коррозия протекает в тонких плёнках электролитов, которые возникают на поверхности металла в результате адсорбции, конденсации или прямого попадания воды и растворения в ней коррозионно-активных газов и солей (O2, SO2, CO2, NO2, NaCl и др.). Учитывая, что поверхность металла всегда энергетически неоднородна (из-за наличия примесей в металле, различий по химическому и фазовому составу сплава и др.), на участках металла, имеющих более отрицательное значение потенциала, пойдёт процесс окисления этого металла. Таким образом, при электрохимической коррозии разрушение металла происходит в результате работы огромного количества коррозионных микроэлементов. При этом на корродирующем металле протекает анодная реакция:
Опять сварил философский камень. Из меди, олова и свинца
АНОД M → Mn + + ne — ,
а на участках металла с более положительным потенциалом – катодное восстановление окислителя (Ox):
КАТОД Ox + ne — → Red.
Наиболее распространёнными окислителями при электрохимической коррозии являются молекулы кислорода О2, воздуха и ионы водорода Н + электролита.
Коррозия с участием кислорода называется коррозией с поглощением кислорода (с кислородной деполяризацией). В зависимости от рН среды возможны два механизма ионизации (восстановления) кислорода:
в щелочной или нейтральной среде
При коррозии с выделением водорода (с водородной деполяризацией) реакции выделения водорода имеют вид:
в щелочной или нейтральной среде
Если в качестве окислителя одновременно выступают О2 и Н + , то такая коррозия называется коррозией со смешанной деполяризацией.
Возможность протекания электрохимической коррозии может быть определена по знаку ЭДС элемента: если ЭДС элемента имеет положительное значение, то коррозия возможна. Так как ЭДС равна разности потенциалов окислителя и восстановителя Еэ=Еок-Евосст или разности потенциалов катода и анода Еэ=Ек-Еа, то коррозия возможна при условии, что потенциал окислителя (или катода) положительнее потенциала металла:
Еок > E(M n + /M) или Ек > E(M n + /M).
Равновесный потенциал кислородного электрода при 298 К описывается уравнением:
E (О2/ОН — ) = 1.227 — 0.059●pH + 0.0147●lg p(О2),
а потенциал водородного электрода — уравнением:

Как паять металлы в домашних условиях? Ничего трудного — смотри и паяй. Секреты для начинающих.
Для оценки возможности или невозможности протекания электрохимических процессов обычно используют диаграммы Пурбэ. Анализ диаграмм Пурбэ для разных металлов показывает, что в водных средах, содержащих О2 и Н + , металлы корродируют по-разному, в зависимости от рН:
а) если потенциал металла положительнее потенциала кислородного электрода (верхняя зона диаграммы), то коррозия металла невозможна (например потенциал золота);
б) если потенциал металла положительнее потенциала водородного электрода и отрицательнее потенциала кислородного электрода (средняя зона диаграммы), коррозия возможна с поглощением кислорода и невозможна с выделением водорода;
в) если потенциал металла отрицательнее потенциала водородного электрода (нижняя зона диаграммы), то возможна коррозия как с поглощением кислорода, так и с выделением водорода (щелочные и щелочно-земельные металлы, магний, алюминий, цинк и др.).
Примеры решения задач
Пример 1. Во сколько раз возрастает толщина плёнки при увеличении продолжительности равномерной газовой коррозии титана от 8 до 100 ч при 300 о С.
где δ – толщина плёнки.
Отсюда следует, что толщина плёнки (δ2/δ1) увеличится в 2.53 раза (ln(100/8)=2.53).
Пример 2. Определите скорость равномерной коррозии железа в (мм/год) и в [г/(м 2 ●год)], если плотность коррозионного тока составляет 0.02 А/м 2 .
Скорость равномерной коррозии, выраженная в г/(м 2 ●с), равна

где Э – молярная масса эквивалента металла (г/моль);
I – плотность тока коррозии, А/м 2 ;
F – число Фарадея, F = 96500 Кл/моль.
Умножая эту величину на число секунд в сутки (3600●24) и число дней в году (365), получим скорость коррозии в году ν = 170 г/(м 2 ●год). Для перевода этой размерности в мм/год используем плотность железа ρ=7.87 г/см 3 . После преобразования единиц получим ν = 0.022 мм/год.
Пример 3. Возможна ли электрохимическая коррозия олова (Sn) в водном растворе при рН=6 при контакте с воздухом, если относительные парциальные давления газов равны p(H2) = 1, p(O2) = 0.21? Напишите уравнения реакций анодного и катодного процессов. При каких значениях рН возможна коррозия с выделением кислорода?
Найдём стандартный электродный потенциал олова (E 0 (Sn 2+ /Sn 0 =-0.136 В). По уравнению Нернста определим равновесные потенциалы вероятных окислителей (H + и O2) при 25 о С, p(H2) = 1, p(O2) = 0.21
E (H + /H2) = -0.059●pH = -0.059●6 = -0.354 В,
E (О2/ОН — ) = 1.227 — 0.059●pH + 0.0147●lg0.21= 1.227 — 0.059●6 – 0.01 = 0.873 В.
Рассчитаем ЭДС предполагаемых коррозионных микроэлементов:
ε2 = Ек(О2) – Еа = 0.873 В – (-0.136 В) = 1.009 В > 0 – коррозия с поглощением кислорода возможна.
Таким образом, уравнения реакций анодного и катодного процессов выглядят следующим образом:
(анод) Sn – 2e — → Sn 2+
Для выяснения диапазона значений рН, при которых возможна коррозия с водородной деполяризацией, решим неравенство:
После подстановки значений электродных потенциалов получим
-0.059●pH – (-0.136 В) > 0,
Пример 4. Определите, будет ли корродировать медь (Cu) в деаэрированном (без содержания кислорода) растворе CuSO4 в кислом растворе с рН=0 и выделением водорода при его относительном парциальном давлении p(H2) = 0.1.
Стандартный потенциал меди составляет E 0 (Сu 2+ /Cu 0 )=+0.337 В, а потенциал водорода рассчитаем по уравнению Нернста:
E (H + /H2) = -0.0295●lg p(H2) — 0.059●pH = -0.0295●lg0.1 — 0.059●0 = +0.0295 В.
ЭДС коррозионного микроэлемента:
Пример 5. Определите возможность электрохимической коррозии с водородной деполяризацией гальванической пары Сu-Zn, погруженной в 0.01М раствор ZnSO4 при 25 o C. Как изменится ЭДС коррозионного элемента в результате концентрационной поляризации анода, если концентрация раствора возросла до 0.05 моль/л?
С учётом гидролиза соли, образованной слабым основанием и сильной кислотой, рассчитываем рН раствора:

Равновесный потенциал водорода в предположении, что его относительное давление равно 1:
E (H + /H2) = -0.059●pH = -0.230 В.
Для выбора корродирующего металла воспользуемся их стандартными потенциалами (E 0 (Сu 2+ /Cu 0 =+0.337 В, E 0 (Zn 2+ /Zn 0 =-0.763 В). Потенциал меди значительно положительнее потенциала предполагаемого катода, и электрохимическая коррозия идёт с участием цинка. Запишем процессы в коррозионном элементе:
(анод) Zn – 2e — → Zn 2+
(катод) 2H + + 2e — → H2.
Для расчёта ЭДС указанного микроэлемента уточним равновесный потенциал цинка, используя уравнение Нернста для 25 o C:
E1(Zn 2+ /Zn 0 ) = -0.763 + (0.059/2)●lg10 -2 .
При увеличении концентрации ZnSO4 его потенциал изменяется:
E2(Zn 2+ /Zn 0 ) = -0.763 + (0.059/2)●lg(5●10 -2 ) = E1(Zn 2+ /Zn 0 ) + (0.059/2)●lg5.
Таким образом, учитывая, что ε = Ек – Еа, значение ЭДС уменьшится на величину
Δε = (0.059/2)●lg5 = 0.02 В.
Пример 6. Определите возможность электрохимической коррозии стального изделия (железа) в 0.1М растворе FeCl2, комнатной температуре (T=298 K) при следующих относительных парциальных давлениях водорода и кислорода: p(H2) = 0.1, p(O2) = 0.9.
Указанная соль подвергается гидролизу. Учитывая первую ступень гидролиза:
Fe 2+ + H2O ↔ H + + FeOH + , можно определить значение рН, величина которого, как видно из реакции меньше 7, т.е. коррозия идёт в подкисленной среде.
Найдём рН раствора, принимая активность ионов равной их концентрации:

Теперь можно определить равновесные электродные потенциалы вероятных окислителей (H + и O2):
E (H + /H2) = -0.0295●lg p(H2) — 0.059●pH = -0.0295●lg0.1 — 0.059●5.56 = -0.3 В,
E (О2/ОН — ) = 1.227 — 0.059●pH + 0.0147●lg p(О2) = 0.9 В.
Равновесный потенциал предполагаемого анода при 25 o C:
E(Fe 2+ /Fe 0 ) = E(Fe 2+ /Fe 0 ) + (0.0592/2) )●lg a(Fe 2+ ) = -0.44 — (0.0592/2)●1 = -0.47 В.
ε1 = Ек(Н + ) – Еа = -0.3 В – (-0.47 В) = +0.17 В > 0 – коррозия с выделением водорода возможна.
ε2 = Ек(О2) – Еа = 0.9 В – (-0.47 В) = +1.37 В > 0 – коррозия с поглощением кислорода также возможна.
Таким образом, возможна коррозия железа с протеканием на катоде двух реакций:
Пример 7. Стальное изделие имеет цинковое покрытие. Какой из металлов будет окисляться при коррозии, если эта пара металлов попадёт в нейтральную среду с рН=7? Подсчитайте ЭДС коррозионного элемента для стандартных условий. При каких рН прекратится процесс выделения водорода?
Стандартный потенциал цинка составляет E 0 (Zn 2+ /Zn 0 )= -0.763 В, а потенциал железа E 0 (Fe 2+ /Fe 0 )= -0.44 В. Учитывая, что потенциал цинка более отрицателен, цинк является анодным покрытием. При этом железо не будет принимать участие в анодном процессе, т.е. не будет корродировать.
Равновесные потенциалы водорода и кислорода, при их парциальных давлениях, равных 1, определяем по уравнениям
E (H + /H2) = — 0.059●pH = — 0.059●7 = -0.413 В,
E (О2/ОН — ) = 1.227 — 0.059●pH = +0.814 В.
ЭДС коррозионных микроэлементов равны:
ε1 = Ек(Н + ) – Еа = -0.413 В – (-0.763 В) = +0.35 В > 0 – коррозия с выделением водорода возможна;
ε2 = Ек(О2) – Еа = 0.814 В – (-0.763 В) = +1.577 В > 0 – коррозия с поглощением кислорода также возможна.
Контрольное задание
Многовариантные задачи
Задача 1. Гальваническая пара, состоящая из двух различных металлов, помещена в раствор электролита (см. таблицу). Какой металл и почему будет корродировать? Написать уравнения соответствующих электрохимических процессов (образование пассивирующих плёнок не учитывать).
Гальваническая пара, электролит
Гальваническая пара, электролит
Гальваническая пара, электролит
Источник: studfile.net
Олово спаяно с серебром какой из металлов будет окисляться

June 2022 1 2 Report
Олово спаяно с серебром. Какой из металлов будет окислятся при помещении сплава в раствор имеющий pH
Answers https://scholar.tips/olovo-spayano-s-serebrom-kakoj-iz-metallov-budet-okislyatsya-pri-pomeshenii-splava.html» target=»_blank»]scholar.tips[/mask_link]
Учебно-методическое пособие «Защита материалов от коррозии» , страница 41

ЭДС этого гальванического элемента равна 0.285 В. Определите, как изменится ЭДС гальванического элемента при его работе, если концентрация ионов Ni +2 возрастет до 0.25 моль/л, а перенапряжение выделения водорода на золоте равно 0.15 В.
21. Железо покрыто никелем. Какой из металлов будет корродировать в случае разрушения поверхности покрытия? Коррозия происходит в кислой среде. Составьте схему гальванического элемента, образующегося при этом.
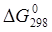
22. Олово спаяно с серебром. Какой из металлов будет окисляться при коррозии, если эта пара металлов попадет в щелочную среду? Ответ дайте на основании вычисления ЭДС и образующегося гальванического элемента.
23. Железо покрыто хромом. Какой из металлов будет корродировать в случае нарушения поверхностного слоя покрытия в атмосфере промышленного района (влажный воздух содержит CO2, H2S, SO2 и др.)? Составьте схему процессов, происходящих на электродах образующегося гальванического элемента.
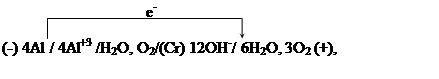
24. При работе гальванического элемента
образовавшегося при коррозии алюминия, который находится в контакте с хромом, за 1 мин 20 с. его работы на хромовом катоде восстановилось 0.034 л кислорода. Определите, на сколько уменьшилась при этом масса алюминиевого электрода и чему равна сила тока, протекшего во внешней цепи гальванического элемента.
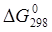
25. Алюминий склепан с медью. Какой из металлов будет подвергаться коррозии, если эти металлы попадут в кислотную среду? Составьте схему гальванического элемента, образующегося при этом? Подсчитайте ЭДС и этого элемента для стандартных условий.
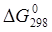
26.Исходя из величины , определите, какие из приведенных ниже металлов будут корродировать во влажном воздухе по уравнению
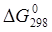
27. Какие металлы: Fe, Ag, Ca — будут разрушаться в атмосфере влажного воздуха, насыщенного диоксидом углерода? Ответ дайте на основании вычисления соответствующих процессов.
Примеры решения задач.
Пример 1. Вычисление электродных потенциалов металлов. Вычислите электродный потенциал цинка, опущенного в раствор его соли с концентрацией ионов Zn +2 = 0.001 моль/л.
Решение. Вычисление электродного потенциала j производят по уравнению Нернста:
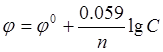
где j 0 — стандартный электродный потенциал; n — число электронов, участвующих в обратимо протекающем окислительно-восстановительном процессе; C — концентрация катионов металла в растворе, моль/л. Стандартный электродный потенциал цинка 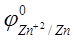 равен — 0,76 В. Отсюда
равен — 0,76 В. Отсюда 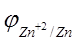 = -0.76 + (0.059/2)×lg10 -3 = -0.76 — 0.0295×3 = -0.85 В.
= -0.76 + (0.059/2)×lg10 -3 = -0.76 — 0.0295×3 = -0.85 В.
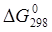
Пример 2. Определение возможности протекания реакции в гальваническом элементе. Исходя из величин стандартных электродных потенциала и значения укажите, можно ли в гальваническом элементе осуществить следующую реакцию:
Fe + Cd +2 ® Fe +2 + Cd
Решение. Составим гальванический элемент, отвечающий этой реакции.
На аноде происходит окисление атомов железа: Fe – 2e = Fe +2 ,
на катоде — восстановление ионов кадмия: Cd +2 + 2e = Cd.
В гальваническом элементе отрицательным будет железный электрод, а положительным-кадмиевый. Схема гальванического элемента:
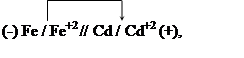 |
Пользуясь таблицей стандартных электродных потенциалов, определяем ЭДС этого гальванического элемента:
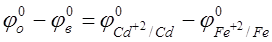
E = = -0.40 – (-0.44) = 0.04 В
Изменение величины энергии Гиббса DG с величиной ЭДС элемента связано соотношением: DG = -nFE,
где n — число электронов, принимающих участие в реакции, F — постоянная Фарадея (96500 Кл/моль); E — ЭДС гальванического элемента.
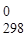
Следовательно, DG = -2×96500×0.04 = -7720 Дж.
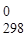
Так как DG < 0, поэтому данную реакцию можно осуществить в гальваническом элементе. Реакция в выбранном направлении протекает самопроизвольно.
Пример 3. Вычисление потенциала электрода по величине константы равновесия реакции. Константа равновесия реакции, протекающей в гальваническом элементе
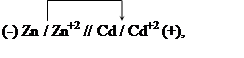 |
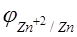
равна 2.022×10 5 . Определите электродный потенциал кадмия, если электродный потенциал цинка равен -0,789В.
Источник: vunivere.ru