Химия просто и понятно. Золото. Серебро. Медь. Эта группа элементов – первые металлы, с которыми познакомился человек.
В данном выпуске мы расскажем подробно об истории, химических свойствах и применении данных металлов, узнаем, почему золото и серебро называют благородными металлами и почему серебро со временем темнеет, а также проведем яркие опыты: получим медь из её оксида с помощью водорода и узнаем, какие ещё существуют способы получения меди, сделаем лимонные часы и узнаем, что такое гальванопластика, цианирование, амальгамация. Покажем, что произойдёт с золотой фольгой, если на неё попадёт капля жидкого металла и как может исчезнуть целый драгоценный слиток, а также вырастим дерево из ртути и серебра, получим красное и голубое золото, посмотрим на горение металлов в атмосфере хлора, а ещё превратим малахит в медь.
13 декабря 2020
Код ролика:
Размер видео: × Отмена Код для плейлиста Начинать с текущего видео
Источник: www.dokonlin.online
Медь и серебро в АП 50, кнопке пускателя и трехфазном автомате.
Презентация на тему: Медь, серебро, золото

№ слайда 1
Описание слайда:
Химия элементов. Лекция 8 Общая характеристика элементов IБ-группы. Медь. Серебро 900igr.net
№ слайда 2
Описание слайда:
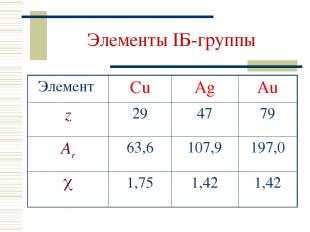
Элементы IБ-группы Элемент Cu Ag Au z 29 47 79 Ar 63,6 107,9 197,0 1,75 1,42 1,42
![Элементы IБ-группы Общая электронная формула: […] ns1 (n–1)d10 Степени окисления](https://fs3.ppt4web.ru/images/132073/183651/310/img2.jpg)
№ слайда 3
Описание слайда:
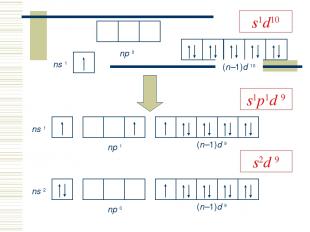
Элементы IБ-группы Общая электронная формула: […] ns1 (n–1)d10 Степени окисления: 0, +I, +II, +III КЧ: 2 (sp -гибр., линейн.), 4 (dsp 2-гибр., квадрат; sp 3-гибр., тетраэдр)
№ слайда 4
Описание слайда:

№ слайда 5
Описание слайда:
Степени окисления +I (d10ns0) +II (d9ns0) +III (d8ns0) Cu Cu2SO4, CuCl Cu(+II) уст. ст. окисления NaCuO2 Ag Ag(I) уст. ст. окисления AgCO3, AgF2 AgF3 Au Au2S, AuBr – Au(+III) уст. ст. окисления
№ слайда 6
Описание слайда:
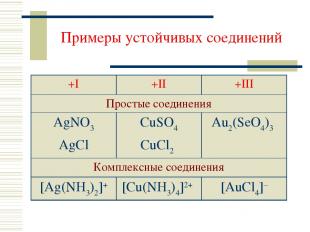
Примеры устойчивых соединений +I +II +III Простые соединения AgNO3 AgCl CuSO4 CuCl2 Au2(SeO4)3 Комплексные соединения [Ag(NH3)2]+ [Cu(NH3)4]2+ [AuCl4]–
Медь и серебро в современных тепловых расцепителях.

№ слайда 7
Описание слайда:
Простые вещества Медь Серебро Золото т. пл., С 1084,5 961,9 1064,4 т. кип., С 2540 2170 2947 , г/см3 8,9 10,5 19,3
![В ЭХРН: …H . Cu …Ag …Au Сu2+/Cu Ag+/Ag [AuСl4]–/Au , В: +0,34 +0,799 +1,00 ЭIБ](https://fs3.ppt4web.ru/images/132073/183651/310/img7.jpg)
№ слайда 8
Описание слайда:
В ЭХРН: …H . Cu …Ag …Au Сu2+/Cu Ag+/Ag [AuСl4]–/Au , В: +0,34 +0,799 +1,00 ЭIБ + H2O ЭIБ + H3O+ CuAg H2SO4(конц.) HNO3(конц.) HNO3(разб.) Cu2+ Ag+

№ слайда 9
Описание слайда:
Химическое растворение В «царской водке» (до ст. ок. +III) Au + HNO3 + 4HCl = H[AuCl4] + NO + 2H2O В расплаве селеновой кислоты (до ст. ок. +III) 2Au + 6H2SeO4 = Au2(SeO4)3 + 3SeO2 + 6H2O В щелочной среде (до ст. ок. +I) 2Cu + 8(NH3.H2O) + O2 = = 2[Cu(NH3)4]2+ + 4OH + 6H2O 2Cu + 4CN + 2H2O = 2[Cu(CN)2] + 2OH + H2 4Ag + 8CN + 2H2O + O2 = 4[Ag(CN)2] + 4OH

№ слайда 10
Описание слайда:
Кислородные соединения Cu Ag, Au +I: Cu2O уст. красн., т. пл. 1240 С +II: CuO черн., разл. до Cu2O и O2 (1026 С) Cu(OH)2 синий, амфотерн., разл. до CuO и H2O (40-80 С) +III: Cu2O3 т-ра разл. 400 С (до CuO и O2 ) +I: Ag2O разл. до Ag и O2 (160 С ) +II: «Ag2O2» (AgIAgIIIO2) диамагнитен, разл. до Ag2O и O2 (100 С) +III: Au2O3 амфотерн., разл. до Au и O2 (160 С) Au2O3 · 2H2O амфотерный (Kк Kо) – «золотая кислота»
№ слайда 11
Описание слайда:
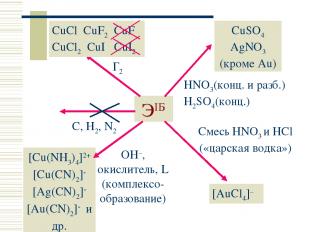
ЭIБ C, H2, N2 Г2 CuCl CuF2 CuF CuCl2 CuI CuI2 CuSO4 AgNO3 (кроме Au) HNO3(конц. и разб.) H2SO4(конц.) Смесь HNO3 и HCl («царская водка») [AuCl4]– OH–, окислитель, L (комплексо-образование) [Cu(NH3)4]2+ [Cu(CN)2] [Ag(CN)2] [Au(CN)2] и др. Простые вещества

№ слайда 12
Описание слайда:
Распространение в природе и важнейшие минералы В земной коре: 26. Cu 0,01% масс. 69. Ag 1·10–5 % масс. 75.
Au 5·10–5 % масс.

№ слайда 13
Описание слайда:
Минералы халькопирит (FeCu)S2 халькозин Cu2S ковеллин CuS куприт Cu2O малахит Cu2(CO3)2(OH)2 аргентит Ag2S хлораргирит AgCl калаверит AuTe2

№ слайда 14
Описание слайда:
Получение меди 2(FeIIICuI)S2 + 5 O2 + 2SiO2 = 2Cu0 + 2FeSiO3 + 4SO2 халькопирит…обжиг/связывание FeII ………шлак……. газ Cu+I + 1e– = Cu0 Fe+III + 1e– = Fe+II 2S–II – 12e– = 2S+IV O2 + 4e– = 2O–II Выплавляемую «черновую» медь рафинируют электролитически.

№ слайда 15
Описание слайда:
Выплавка меди Рафинирование меди электролизом Загрузка печи Пульт управления Очищенная медь

№ слайда 16
Описание слайда:
![Цианидный метод извлечения золота и серебра ЭIБ(Ag,Au) + NaCN(р) + O2 [Э(CN)2] +](https://fs3.ppt4web.ru/images/132073/183651/310/img16.jpg)
№ слайда 17
Описание слайда:
Цианидный метод извлечения золота и серебра ЭIБ(Ag,Au) + NaCN(р) + O2 [Э(CN)2] + OH измельч.руда….……………..воздух……р-р, рН > 7, выделение HCN (гидролиз) 2[Э(CN)2] + Zn(тв., пыль) = [Zn(CN)4]2 + 2Э(т) Zn + 2HCl = ZnCl2 + H2 (удаление избытка Zn)

№ слайда 18
Описание слайда:
Особенности химии меди 2Cu+I Cu0 + Cu2+ Cu2O + H2SO4 = = Cu0 + CuSO4 + H2O Cu2O + 2HCl = 2CuCl + H2O CuCl + HCl = H[CuCl2] Cu2O + 4(NH3·H2O) = = 2[Cu(NH3)2]OH + 3H2O КЧ(CuI) = 2, sp-гибр. Получение: 4Cu(OH)2 + N2H4·H2O = = 2Cu2O + N2 + 7H2O

№ слайда 19
Описание слайда:
Гидроксид Cu(OH)2 Получение: Cu2+ + 2OH─ = Cu(OH)2 Амфотерность: Cu(OH)2 + 2H3O+ = = [Cu(H2O)4]2+ Cu(OH)2 + 2OH = = [Cu(OH)4]2 Cu(OH)2 = CuO + H2O синий черный t°
![Комплексные соединения Cu2+(р): [Cu(H2O)4(H2O)2]2+ [Cu(H2O)4(H2O)2]2+ + 4NH3·H2O](https://fs3.ppt4web.ru/images/132073/183651/310/img19.jpg)
№ слайда 20
Описание слайда:
Комплексные соединения Cu2+(р): [Cu(H2O)4(H2O)2]2+ [Cu(H2O)4(H2O)2]2+ + 4NH3·H2O = = [Cu(NH3)4(H2O)2]2+ + 8H2O Длинные транс-связи: Cu–N: 205 пм, Cu–O: 337 пм [Cu(NH3)6]2+ можно получить в среде жидкого аммиака в воде условно для [CuL4]2+ КЧ(CuII) = 4, dsp2-гибр. (квадрат) см. эффект Яна-Теллера sp3d2, искаж. октаэдр
![Комплексные соединения dsp2 (квадрат): [Cu(H2O)2(OH)4]2–, [Cu(H2O)2Cl4]2–, [Cu(N](https://fs3.ppt4web.ru/images/132073/183651/310/img20.jpg)
№ слайда 21
Описание слайда:
Комплексные соединения dsp2 (квадрат): [Cu(H2O)2(OH)4]2–, [Cu(H2O)2Cl4]2–, [Cu(NH3)2(H2O)2(NO2)2] sp3 (тетраэдр): [Cu(OH)4]2 (в усл. изб. щелочи, рН 11) Аммиачный к-с меди(II): получение и разрушение
![Окислительно-восстановительные свойства 2[Cu(H2O)4]2+ + 4I = 2CuI + I2 + 8H2O Cu](https://fs3.ppt4web.ru/images/132073/183651/310/img21.jpg)
№ слайда 22
Описание слайда:
Окислительно-восстановительные свойства 2[Cu(H2O)4]2+ + 4I = 2CuI + I2 + 8H2O Cu2+ + I– + e–= CuI (CuII – мягкий окислитель) 2I– – 2e– = I2 В р-ре: [I(I)2]–, CuI (суспензия) I2 + 2SO3S2– = 2I– + S4O62– Растворение за счет комплексообразования: CuI(т) + 2 SO3S2–= [Cu(SO3S)2]3– + I– CuI(т) + 2Na2SO3S = Na3[Cu(SO3S)2] + NaI

№ слайда 23
Описание слайда:
Серебро Ag – уникальный элемент: нет гидратов солей нет аквакомплексов Растворимые соли: AgNO3, AgClO4, AgClO3, AgF Комплексообразование (растворение осадка): AgX(т) + 2NH3·H2O = = [Ag(NH3)2]X + 2H2O (КЧ 2) AgX(т) + 2Na2SO3S = Na3[Ag(SO3S)2] (КЧ 2)

№ слайда 24
Описание слайда:
Серебро 2Ag+ + 2OH– Ag2O(т) + H2O ПР(AgOH) = 1,6 ·10–6 2Ag+ + S2– = Ag2S(т) ПР(Ag2S) = 6,3 ·10–50 4Ag + 2H2S + O2 = 2Ag2S + 2H2O (почернение серебряных предметов)
Источник: ppt4web.ru
Медь. Серебро. Золото

В настоящее время медь добывают из руд. Последние, в зависимости от характера входящих в их состав соединений, подразделяют на оксидные и сульфидные. Сульфидные руды имеют наибольшее значение, поскольку из них выплавляется 80% всей добываемой меди.
Важнейшими минералами, входящими в состав медных руд, являются: халькозин или медный блеск — Cu2S; халькопирит или медный колчедан — CuFeS2; малахит — (CuOH) 2CO3.
Выплавка меди их её сульфидных руд или концентратов представляет собою сложный процесс. Обычно он слагается из следующих операций:
В ходе обжига большая часть сульфидов примесных элементов превращается в оксиды. Так, главная примесь большинства медных руд, пирит — FeS2 — превращается в Fe2O3. Газы, отходящие при обжиге, содержат SO2 и используются для получения серной кислоты.
Получающиеся в ходе обжига оксиды железа, цинка и других примесей отделяются в виде шлака при плавке. Основной же продукт плавки — жидкий штейн (Cu2S с примесью FeS) поступает в конвертор, где через него продувают воздух. В ходе конвертирования выделяется диоксид серы и получается черновая или сырая медь.
Для извлечения ценных спутников (Au, Ag, Te и др.) и для удаления вредных примесей черновая медь подвергается огневому, а затем электролитическому рафинированию. В ходе огневого рафинирования жидкая медь насыщается кислородом. При этом примеси железа, цинка, кобальта окисляются, переходят в шлак и удаляются. Медь же разливают в формы. Получающиеся отливки служат анодами при электролитическом рафинировании.
Чистая медь — тягучий вязкий металл светло-розового цвета, легко прокатываемый в тонкие листы. Она очень хорошо проводит тепло и электрический ток, уступая в этом отношении только серебру.
В сухом воздухе медь почти не изменяется, так как образующаяся на её поверхности тончайшая плёнка оксидов придаёт меди более тёмный цвет и также служит хорошей защитой от дальнейшего окисления. Hо в присутствии влаги и диоксида углерода поверхность меди покрывается зеленоватым налётом гидроксокарбоната меди — (CuOH) 2CO3. При нагревании на воздухе в интервале температур 200-375oC медь окисляется до чёрного оксида меди(II) CuO. При более высоких температурах на её поверхности образуется двухслойная окалина: поверхностный слой представляет собой оксид меди(II) , а внутренний — красный оксид меди(I) — Cu2O.
Медь широко используется в промышленности из-за:
хороших литейных качеств
большого сопротивления на разрыв
Около 40% меди идёт на изготовление различных электрических проводов и кабелей. Широкое применение в машиностроительной промышленности и электротехнике нашли различные сплавы меди с другими веществами. Hаиболее важные из них являются латуни (сплав меди с цинком) , медноникеливые сплавы и бронзы.
Медноникеливые сплавы и бронзы также подразделяются на несколько различных групп — по составу других веществ, содержащихся в примесях. И в зависимости от химических и физических свойств находят различное применение.
Все медные сплавы обладают высокой стойкостью против атмосферной коррозии.
В химическом отношении медь — малоактивный металл. Однако с галогенами она реагирует уже при комнатной температуре. Например, с влажным хлором она образует хлорид — CuCl2. При нагревании медь взаимодействует и с серой, образуя сульфид — Cu2S.
Hаходясь в ряду напряжения после водорода, медь не вытесняет его из кислот. Поэтому соляная и разбавленная серная кислоты на медь не действуют. Однако в присутствии кислорода медь растворяется в этих кислотах с образованием соответствующих солей:
2Cu + 4HCl + O2 —> 2CuCl2 + 2H2O
Летучие соединения меди окрашивают несветящееся пламя газовой горелки в сине-зелёный цвет.
Соединения меди(I) в общем менее устойчивы, чем соединения меди(II) , оксид Cu2O3 и его производные весьма нестойки. В паре с металлической медью Cu2O применяется в купоросных выпрямителях переменного тока.
Оксид меди(II) (окись меди) — CuO — чёрное вещество, встречающееся в природе (например в виде минерала тенерита) . Его легко можно получит прокаливанием гидроксокарбоната меди(II) (CuOH) 2CO3 или нитрата меди(II) — Cu(NO3) 2. При нагревании с различными органическими веществами CuO окисляет их, превращая углерод в диоксид углерода, а водород — в воду и восстанавливаясь при этом в металлическую медь. Этой реакцией пользуются при элементарном анализе органических веществ для определения содержания в них углерода и водорода.
Гидроксокарбонат меди(II) — (CuOH) 2CO3 — встречается в природе в виде минерала малахита, имеющего красивый изумрудно-зелёный цвет. Применяется для получения хлорида меди(II) , для приготовления синих и зелёных минеральных красок, а также в пиротехнике.
Сульфат меди(II) — CuSO4 — в безводном состоянии представляет собой белый порошок, который при поглощении воды синеет. Поэтому он применяется для обнаружения следов влаги в органических жидкостях.
Смешанный ацетат-арсенит меди(II) — Cu(CH3COO) 2• Cu3(AsO3) 2 — применяется под названием «парижская зелень» для уничтожения вредителей растений.
Из солей меди вырабатывают большое количество минеральных красок, разнообразных по цвету: зелёных, синих, коричневых, фиолетовых и чёрных. Все соли меди ядовиты, поэтому медную посуду лудят — покрывают внутри слоем олова, чтобы предотвратить возможность образования медных солей.
Характерное свойство двухзарядных ионов меди — их способность соединяться с молекулами аммиака с образованием комплексных ионов.
Медь принадлежит к числу микроэлементов. Такое название получили Fe, Cu, Mn, Mo, B, Zn, Co в связи с тем, что малые количества их необходимы для нормальной жизнедеятельности растений. Микроэлементы повышают активность ферментов, способствуют синтезу сахара, крахмала, белков, нуклеиновых кислот, витаминов и ферментов. Микроэлементы вносят в почву вместе с микроудобрениями. Удобрения, содержащие медь, способствуют росту растений на некоторых малоплодородных почвах, повышают их устойчивость против засухи, холода и некоторых заболеваний.
2. Серебро
Серебро распространено в природе значительно меньше, чем медь (около 10-5 вес. %) . В некоторых местах (например, в Канаде) серебро находится в самородном состоянии, но большую часть серебра получают из его соединений. Самой важной серебряной рудой является серебряный блеск (аргент) — Ag2S.
В качестве примеси серебро встречается почти во всех медных и серебряных рудах. Из этих руд и получают около 80% всего добываемого серебра.
Чистое серебро — очень мягкий, тягучий металл. Оно лучше всех металлов проводит электрический ток и тепло.
Hа практике чистое серебро вследствие мягкости почти не применяется: обычно его сплавляют с большим или меньшим количеством меди. Сплавы серебра служат для изготовления ювелирных и бытовых изделий, монет, лабораторной посуды. Серебро используется для покрытия им других металлов, а также радиодеталей в целях повышения их электропроводимости и устойчивости к коррозии. Часть добываемого серебра расходуется на изготовление серебряно-цинковых аккумуляторов.
Серебро — малоактивный металл. В атмосфере воздуха оно не окисляется ни при комнатных температурах, ни при нагревании. Часто наблюдаемое почернение серебряных предметов — результат образования на их поверхности чёрного сульфида серебра — AgS2. Это происходит под влиянием содержащегося в воздухе сероводорода, а также при соприкосновении серебряных предметов с пищевыми продуктами, содержащими соединения серы.
4Ag + 2H2S + O2 —> 2Ag2S +2H2O
В ряду напряжения серебро расположено значительно дальше водорода. Поэтому соляная и разбавленная серная кислоты на него не действуют. Растворяют серебро обычно в азотной кислоте, которая взаимодействует с ним согласно уравнению:
Ag + 2HNO3 —> AgNO3 + NO2 + H2O
Серебро образует один ряд солей, растворы которых содержат бесцветные катионы Ag+.
При действии щелочей на растворы солей серебра можно ожидать получения AgOH, но вместо него выпадает бурый осадок оксида серебра(I) :
2AgNO3 + 2NaOH —> Ag2O + 2NaNO3 + H2O
Кроме оксида серебра(I) известны оксиды AgO и Ag2O3.
Hитрат серебра (ляпис) — AgNO3 — образует бесцветные прозрачные кристаллы, хорошо растворимые в воде. Применяется в производстве фотоматериалов, при изготовлении зеркал, в гальванотехнике, в медицине.
Подобно меди, серебро обладает склонностью к образованию комплексных соединений.
Многие нерастворимые в воде соединения серебра (например: оксид серебра(I) — Ag2O и хлорид серебра — AgCl) , легко растворяются в водном растворе аммиака.
Комплексные цианистые соединения серебра применяются для гальванического серебрения, так как при электролизе растворов этих солей на поверхности изделий осаждается плотный слой мелкокристаллического серебра.
Все соединения серебра легко восстанавливаются с выделением металлического серебра. Если к аммиачному раствору оксида серебра(I) , находящемуся в стеклянной посуде, прибавить в качестве восстановителя немного глюкозы или формалина, то металлическое серебро выделяется в виде плотного блестящего зеркального слоя на поверхности стекла. Этим способом готовят зеркала, а также серебрят внутреннюю поверхность стекла в сосудах для уменьшения потери тепла лучеиспусканием.
Соли серебра, особенно хлорид и бромид, ввиду их способности разлагаться под влиянием света с выделением металлического серебра, широко используются для изготовления фотоматериа-лов — плёнки, бумаги, пластинок. Фотоматериалы обычно представляют собою светочувствительную суспензию AgBr в желатине, слой которой нанесён на целлулоид, бумагу или стекло.
При экспозиции в тех местах светочувствительного слоя, где на него попал свет, образуются мельчайшие зародыши кристаллов металлического серебра. Это — скрытое изображение фотографируемого предмета. При проявлении бромид серебра разлагается, причём скорость разложения тем больше, чем выше концентрация зародышей в данном месте слоя.
Получается видимое изображение, которое является обращённым или негативным изображением, поскольку степень почернения в каждом месте светочувствительного слоя тем больше, чем выше была его освещённость при экспозиции. В ходе закрепления (фиксирования) из светочувствительного слоя удаляется неразложившийся броми серебра. Это происходит в результате взаимодействия между AgBr и веществом закрепителя — тиосульфатом натрия. При этой реакции получается нерастворимая комплексная соль:
AgBr + 2Na2S2O3 —> Na3[Ag(S2O3) 2] + NaBr
Далее негатив накладывают на фотобумагу и подвергают действию света — «печатают». При этом наиболее освещёнными оказываются те места фотобумаги, которые находятся против светлых мест негатива, Поэтому в ходе печатания соотношения между светом и тенью меняется на обратное и становится отвечающим сфотографированному объекту. Это — позитивное изображение.
Ионы серебра подавляют развитие бактерий и уже в очень низкой концентрации (около 10-10 г-ион/л) стерилизуют питьевую воду. В медицине для дезинфекции слизистых оболочек применяются стабилизированные специальными добавками коллоидные растворы серебра (протаргол, колларгол и др.) .
3. Золото
Золото отделяется от песка и измельченной кварцевой породы промыванием водой, которая уносит частицы песка, как более лёгкие, или обработкой песка жидкостями, растворяющими золото. Чаще всего применяется раствор цианида натрия (NaCN) , в котором золото растворяется в присутствии кислорода с образованием комплексных анионов [Au(CN) 2]-:
4Au + 8NaCN + O2 + 2H20 —> 4Na[Au(CN) 2] + 4NaOH
Из полученного раствора золото выделяют цинком:
2Na[Au(CN) 2] + Zn —> Na2[Zn(CN) 4] + 2Au
Освобождённое золото обрабатывают для отделения от него цинка разбавленной серной кислотой, промывают и высушивают. Дальнейшая очистка золота от примесей (главным образом от серебра) производится обработкой его горячей концентрированной серной кислотой или путём электролиза.
Метод извлечения золота из руд с помощью растворов цианидов калия или натрия был разработан в 1843 году русским инженером П. Р. Багратионом. Этот метод, принадлежащий к гидрометаллургическим способам получения металлов, в настоящее время наиболее распространён в металлургии золота.
Золото — ярко-жёлтый блестящий металл. Оно очень ковко и пластично; путём прокатки из него можно получить листочки толщиной менее 0.0002 мм, а из 1 грамма золота можно вытянуть проволоку длиной 3.5 км. Золото — прекрасный проводник тепла и электрического тока, уступающий в этом отношении только серебру и меди.
Ввиду мягкости золото употребляется в сплавах, обычно с серебром или медью. Эти сплавы применяются для электрических контактов, для зубопротезирования и в ювелирном деле.
В химическом отношении золото — малоактивный металл. На воздухе оно не изменяется даже при сильном нагревании. Кислоты в отдельности не действуют на золото, но в смеси соляной и азотной кислот (царской водке) золото легко растворяется:
Au + HNO3 + 3HCl —> AuCl3 + NO + 2H2O
Так же легко растворяется золото в хлорной воде и в аэрируемых (продуваемых воздухом) растворах цианидов щелочным металлов. Ртуть тоже растворяет золото, образуя амальгаму, которая при содержании более 15% золота становится твёрдой.
Известны два ряда соединений золота, отвечающие степеням окислённости +1 и +3. Так, золото образует два оксида — оксид золота(I) , или закись золота, — Au2O — и оксид золота(III) , или окись золота — Au2O3. Более устойчивы соединения, в которых золото имеет степень окисления +3.
Все соединения золота легко разлагаются при нагревании с выделением металлического золота.
Источник: referatplus.ru