На нашем сайте собрано более 100 бесплатных онлайн калькуляторов по математике, геометрии и физике.
Основные формулы, таблицы и теоремы для учащихся. Все что нужно, чтобы сделать домашнее задание!
Не можете решить контрольную?!
Мы поможем! Более 20 000 авторов выполнят вашу работу от 100 руб!
Общие сведения о строении атома серебра
Относится к элементам d-семейства. Металл. Обозначение – Ag. Порядковый номер – 47. Относительная атомная масса – 107,868 а.е.м.
Электронное строение атома серебра
Атом серебра состоит из положительно заряженного ядра (+47), внутри которого есть 47 протонов и 61 нейтрон, а вокруг, по пяти орбитам движутся 427 электронов.
Рис.1. Схематическое строение атома серебра.
Распределение электронов по орбиталям выглядит следующим образом:
Валентными электронами атома серебра считаются электроны, расположенные на 4d— и 5s-орбиталях. Энергетическая диаграмма основного состояния принимает следующий вид:
ОТВЕРГНУТОЕ НА 100 ЛЕТ РЕАЛЬНОЕ СТРОЕНИЕ АТОМА
Валентные электроны атома серебра можно охарактеризовать набором из четырех квантовых чисел: n (главное квантовое), l (орбитальное), ml (магнитное) и s (спиновое):
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
Таблица менделеева – Электронный учебник K-tree

Периодический закон, открытый Д.
И. Менделеевым был выражен в таблице. Периодическая таблица химических элементов, или таблица менделеева.

65. 38
+Electron+configuration+should+be+1s22s22p63s23p64s23d104p65s24d9.+It%E2%80%99s+actually+1s22s22p63s23p64s23d104p65s14d10..jpg)
195. 084
В таблице менделеева колонки называются группами, строки называются периодами. Элементы в группах как правило имеют одинаковые электронные конфигурации внешних оболочек, например, благородные газы – последняя группа, имеют законченную электронную конфигурацию.
Как заполняется электронная конфигурация элементов подробно описано в статье
Скачать таблицу менделеева в хорошем качестве
Копия материалов, размещённых на данном сайте, допускается только по письменному разрешению владельцев сайта.
Ag Информация об элементе серебра: факты, свойства, тенденции, использование и сравнение – Периодическая таблица элементов
Кристаллическая структура серебра
Твердотельная структура серебра Гранецентрированная кубическая .
Кристаллическая структура может быть описана с точки зрения ее элементарной ячейки. Единичные Клетки повторяются в трехмерном пространстве, образуя структуру.
Параметры элементарной ячейки
Элементарная ячейка представлена в терминах ее параметров решетки, которые являются длинами ребер ячейки Константы решетки (a, b и c)
Электронные конфигурации | Химия ЕГЭ | Умскул
408.  53 pm 53 pm |
408.53 pm | 408.53 pm |
and the angles between them Lattice Angles (alpha, beta and gamma).
| π/2 | π/2 | π/2 |
The positions of the atoms inside the unit cell are described by the set атомных позиций ( x i , y i , z i ), измеренные от опорной точки решетки.
Серебряный атомный и орбитальный свойства

Серебряные атомы имеют 47 электронов и электронная оболочка. , 1] с символом атомного члена (квантовые числа) 2 S 1/2 .
| Атомный номер | 47 |
| Число электронов (без заряда) | 47 |
| Number of Protons | 47 |
| Mass Number | 108 |
| Number of Neutrons | 61 |
| Shell structure (Electrons per energy level) | 2, 8, 18, 18, 1 |
| Электронная конфигурация | [KR] 4D10 5S1 |
| Валентные электроны | 4D10 5S1 |
| Валентность (Валентность) | 1 |
| Валентность (Валентность) | 1 |
| (Валентность) | 1 |
| (Валентность) | 1 |
| (Валентность) | |
| (Валентность) | |
| (Валентность)0028 | |
| Main Oxidation States | 1 |
| Oxidation States | -2, -1, 0, 1, 2, 3 |
| Atomic Term Symbol (Quantum Numbers) | 2 S 1 /2 |
Боровская модель атома серебра – количество электронов на энергетический уровень
Электронная конфигурация серебра в основном состоянии – нейтральный атом серебра
Сокращенная электронная конфигурация серебра

Сокращенная электронная конфигурация нейтрального атома серебра в основном состоянии [Kr] 4d10 5s1. Часть конфигурации серебра, эквивалентная благородному газу предыдущего периода, обозначается аббревиатурой [Kr]. Для атомов с большим количеством электронов это обозначение может стать длинным, поэтому используется сокращенное обозначение. Это важно, поскольку именно валентные электроны 4d10 5s1, электроны в самой внешней оболочке, определяют химические свойства элемента.
Полная электронная конфигурация нейтрального серебра
Полная электронная конфигурация атома серебра в основном состоянии. Полная электронная конфигурация
1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s1 Правило.

Атомная структура серебра
Атомный радиус серебра составляет 165 пм, а ковалентный радиус — 153 пм.
Источник: csri.ru
Описать строение атома серебра
Вопрос по химии:
Описать строение атома электронную конфигурацию распределение электронов по энергетическим уровням ячейкам элемента серебра
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок — бесплатно!
- bookmark_border
- 12.11.2017 17:43
- Химия
- remove_red_eye 10986
- thumb_up 6
Ответы и объяснения 1
hrulyst814
47 Ag ) ) ) ) ) 108 2 8 18 18 1 1S2 2S2 2P6 3S2 3P6 3d10 4S2 4P6 4d10 5S1 P=47 e=-47 n=61
- 13.11.2017 16:04
- thumb_up 4
Знаете ответ? Поделитесь им!
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете правильный ответ;
- Писать подробно, чтобы ответ был исчерпывающий и не побуждал на дополнительные вопросы к нему;
- Писать без грамматических, орфографических и пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся уникальные и личные объяснения;
- Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не знаю» и так далее;
- Использовать мат — это неуважительно по отношению к пользователям;
- Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует? Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи — смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
Источник: online-otvet.ru
Строение атома серы

Сера (S) – неметалл, относящийся к группе халькогенов. Строение атома серы легко определить, обратившись к периодической таблице Менделеева.
Строение
Сера в периодической таблице находится под 16 номером в третьем периоде, VI группе. Относительная атомная масса элемента – 32.
Природная сера имеет несколько изотопов:
Кроме этого, искусственно получено 20 радиоактивных изотопов.
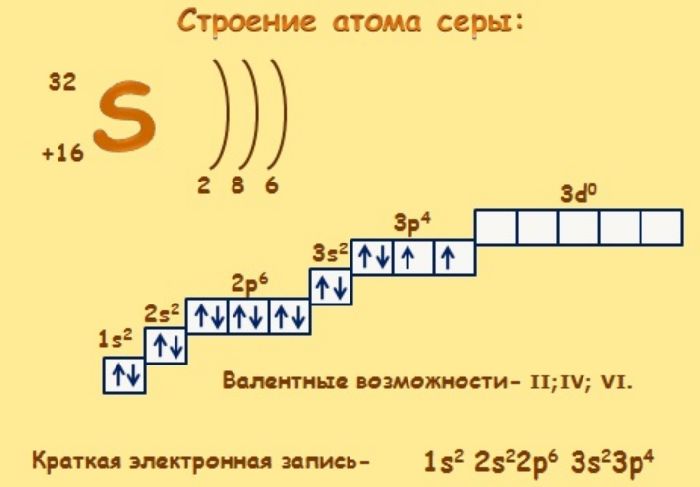
Сера – элемент р-семейства. Атом серы включает ядро с положительным зарядом +16 (16 протонов, 16 нейронов) и 16 электронов, расположенных на трёх электронных оболочках. На внешнем энергетическом уровне находится 6 электронов, которые определяют валентность элемента. До завершения внешнего р-уровня не хватает двух электронов, что определяет степень окисления серы как -2.
Атом серы может переходить в возбуждённое состояние за счёт вакантных 3d-орбиталей (всего пять d-орбиталей). Поэтому атом может проявлять степень окисления +4 и +6.
Отрицательную степень окисления сера проявляет в составе солей – Al2S3, SiS2, Na2S. Четвёртая степень окисления проявляется в реакциях с галогенами (SCl4, SBr4, SF4) и при взаимодействии с кислородом (SO2). Наивысшая степень окисления (+6) проявляется с наиболее электроотрицательными элементами – H2SO4, SF6, SO3.
Электронное строение атома серы – 1s 2 2s 2 2p 6 3s 2 3p 4 или +16 S)2)8)6.
Физические свойства
Сера – кристаллическое соединение, которое при нагревании приобретает пластичную форму. Цвет неметалла варьирует от ярко-жёлтого до коричневого. Модификации серы зависят от количества атомов серы в молекуле.

Сера – слабый проводник тепла и электрического тока. Не взаимодействует с водой, но хорошо растворяется в органических растворителях – феноле, бензоле, аммиаке, сероуглероде.
В природе сера встречается в виде самородков и в составе руд, минералов, горных пород. Сера находится в сульфидах, сульфатах, каменном угле, нефти, газе. Серу накапливают бактерии, перерабатывающие сероводород.
Химические свойства
Сера – активный элемент, реагирующий при нагревании практически со всеми элементами, кроме инертных газов и N2, I2, Au, Pt. Сера не взаимодействует с соляной кислотой. Основные реакции серы с элементами описаны в таблице.
Взаимодействие
Продукты реакции
Пример
Источник: obrazovaka.ru