Сера (S) находится в 6 группе периодической таблицы Д.И. Менделеева.
Строение оболочки: 1s 2 2s 2 2p 6 3s 2 3p 4 . Сера – неметалл, в соединениях может выступать в качестве окислителя и в качестве восстановителя.
Физические свойства серы.
Сера S — твердое кристаллическое вещество желтого цвета, нерастворимое в воде. Температура кипения составляет 445°С.
Аллотропия серы.
Аллотропия – существование 2х и более простых форм одного и того же простого химического элемента, различных по строению и свойствам.
Сера может быть:
- ромбическая (Sромб);
- моноклинная;
- пластическая (очень неустойчивая форма, при замерзании превращается в ромбическую).
Способы получения серы.
1. В промышленности: выделение из руды с помощью водяного пара.
2. Сгорание в недостатке кислорода:
Источник: www.calc.ru
Соединения серы. 9 класс.
Сера — химические и физические свойства
Сера – важнейший элемент в современной промышленности.
Оглавление:
- Что такое сера и как она выглядит
- Характеристика серы
- Области применения
- Нахождение серы в природе
- Биологическая роль серы
Особые свойства серы (антисептические и антипаразитарные) делают её незаменимым компонентном многих лекарственных препаратов.
Что такое сера и как она выглядит
Сера – химический элемент, находящийся по 16 номером в таблице Д. И. Менделеева и обозначающийся буквой S (по первой букве латинского названия Sulphur).

Молярная масса серы равна 32, 065 г/моль, атомная масса — 32,066 а. е. м. Это вещество может быть как ярко-желтого, так и коричневого цвета.

Различают порошкообразную (молотую) и жидкую серу.
Характеристика серы
Сера – вещество с переменной степенью окисления. На внешней электронной орбитали серы находятся шесть валентных электронов, для заполнения не хватает ещё двух, поэтому в соединениях с металлами и водородом она проявляет валентность -2.
При взаимодействии с кислородом и галогенами, т. е. с элементами с большей электроотрицательностью, сера может проявлять положительную валентность, например, +4 и +6.
Физические свойства
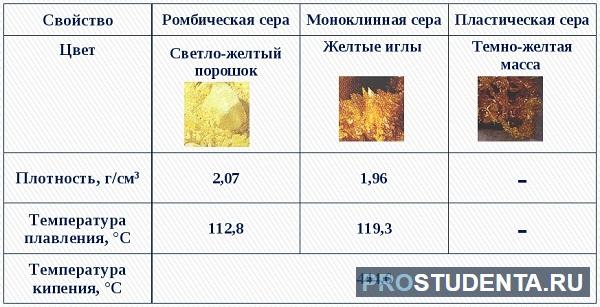
Как простое вещество, сера образует несколько аллотропных модификаций:
- Ромбическая – то, что мы привыкли называть обычной серой. Она устойчива при обычных условиях, встречается чаще всего недалеко от действующих или потухших вулканов.
- Пластическая – представляет собой замкнутые или открытые цепочки соединяющейся между собой серы, получаемые обычно при её сжигании. Имеет самую большую молекулярную массу среди всех разновидностей серы.
- Моноклинная (S8) – соединение серы, которое в молекулярном виде представляет собой восьмиугольник с атомами серы в вершинах. Выглядит как множество цилиндров, похожих на иглы. При комнатной температуре быстро превращается в ромбическую.
Приблизительная молярная масса одной молекулы моноклинной серы – 256 г/моль. В России сера, в основном, бывает только двух товарных видов: гранулированная и комовая.
Сера – легкоплавкое вещество, температура плавления около 120 градусов. Нерастворима в воде и не намокает про соприкосновении с ней.
Не обладает электролитическими свойствами и теплопроводностью. Плотность серы — 2,070 г/см³.
Химические свойства
В соединениях с водородом образует серную (химическая формула H2SO4) со степенью окисления серы +6 и сернистую (H2SO3) со степенью окисления +4 кислоты, которые дают соответственно сульфаты и сульфиты.

В нормальных условиях реагируют с активными металлами и ртутью, образуя сульфиды:
Также образует сульфиды при нагревании с большинством неактивных металлов, кроме платины и золота:
Проявляет восстановительные свойства в реакции с кислородом при нагревании, образуя кислотный оксид:
В реакциях с водородом образует сернистый газ, летучее бесцветное вещество с неприятным запахом тухлых яиц:
Области применения
Широко применяется в медицине, обладает антисептическими и антипаразитарными свойствами, используется для дезинфекции помещений и избавления от паразитов.
В низких концентрациях способствует формированию новых клеток эпидермиса, из-за чего её часто используют для лечения воспалений. Помимо этого сера имеет слабительное действие, а при приеме внутрь оказывает отхаркивающий эффект.
Благодаря легковоспламеняемости и горючим свойствам, сера хорошо горит. Например, самое простое, где можно взять серу, это открыть полный спичечный коробок — сера входит в состав спичечной головки.

При трении головка касается шероховатой поверхности (например, наждачной бумаги), и спичка легко загорается.
Серная кислота (H2SO4) – важнейший продукт химической промышленности, используется в качестве электролита в свинцовых аккумуляторах, применяется для получения соляной, азотной, борной и других кислот.
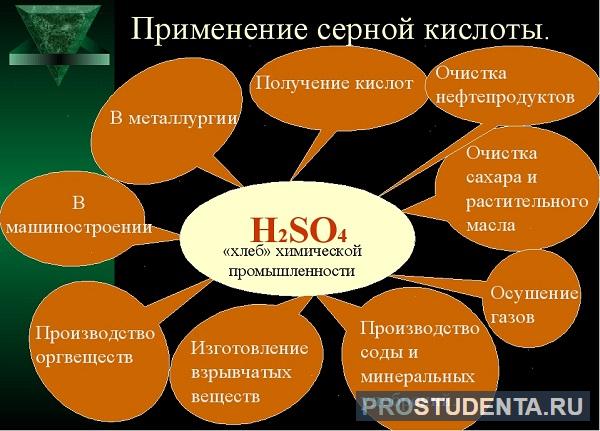
Серная кислота является необходимым сульфирующим средством при получении многих лекарственных веществ и красок.
Сероводород (H2S) используется для выделения чистой серы, сульфитов и серной кислоты из растворов.
Оксиды серы (SO2 и SO3) находят применения в производстве серной и азотной кислот, а также используются в бытовой химии: входят в состав отбеливателей, дезинфицирующих средств.
Нахождение серы в природе

Чаще всего в природе находится самородная сера (S), однако встречаются и её соединения с другими элементами: FeS2 (сульфат железа (II), пирит), ZnS (сульфат цинка, цинковая обманка), CaSO4*2H2O (гипс), PbS (сульфат свинца, свинцовый блеск) и другие.
Биологическая роль серы
Сера содержится в живых организмах, особенно много её в белках ногтей, волос, копыт. Общая масса серы в человеческом организме составляет около 130 грамм. Также это вещество встречается в составе некоторых витаминов и гормонов.
Сера обладает уникальными химическими и физическими свойствами, благодаря чему является важнейшим компонентом промышленности и незаменима при создании лекарственных препаратов.
Источник: www.prostudenta.ru
Сера, свойства атома, химические и физические свойства

Сера, свойства атома, химические и физические свойства.
Поделиться в:




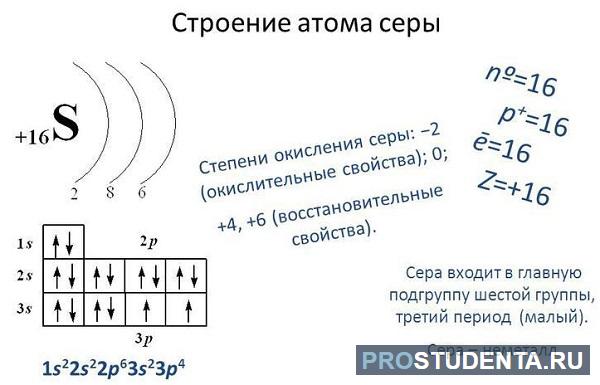
32,059-32,076 1s 2 2s 2 2p 6 3s 2 3p 4
Сера — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 16. Расположен в 16-й группе (по старой классификации — главной подгруппе шестой группы), третьем периоде периодической системы.
Атом и молекула серы. Формула серы. Строение атома серы:
Сера (лат. Sulfur, из старославянского «сѣра» — «сера, смола», вообще «горючее вещество, жир») – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением S и атомным номером 16. Расположен в 16-й группе (по старой классификации – главной подгруппе шестой группы), третьем периоде периодической системы.
Сера – неметалл. Относится к группе халькогенов.
Сера обозначается символом S.
Как простое вещество сера при нормальных условиях представляет собой светло-жёлтое порошкообразное вещество или лимонно-жёлтые кристаллы.
Молекула серы. Сера отличается способностью образовывать устойчивые цепочки и циклы из атомов. Наиболее стабильны циклические молекулы S8, имеющие форму короны, образующие ромбическую и моноклинную серу. Кроме того, возможны молекулы с замкнутыми (S4, S6) цепями и открытыми цепями.
Химическая формула серы чаще всего записывается просто S, так как она, хотя и имеет молекулярную структуру, является смесью простых веществ с разными молекулами.
Электронная конфигурация атома серы 1s 2 2s 2 2p 6 3s 2 3p 4 . Потенциал ионизации (первый электрон) атома серы равен 999,59 кДж/моль (10,36001 эВ).
Строение атома серы. Атом серы состоит из положительно заряженного ядра (+16), вокруг которого по четырем оболочкам движутся 16 электрона. При этом 10 электронов находятся на внутреннем уровне, а 6 электронов – на внешнем. Поскольку сера расположена в третьем периоде, оболочек всего три. Первая – внутренняя оболочка представлена s-орбиталью.
Вторая – внутренняя оболочка представлены s- и р-орбиталями. Третья – внешняя оболочка представлена s- и р-орбиталями. На внешнем энергетическом уровне атома серы на 3s-орбитали находятся два спаренных электрона, на 3p-орбитали – два спаренных и два неспаренных электрона. В свою очередь ядро атома серы состоит из 16 протонов и 16 нейтронов. Сера относится к элементам p-семейства.
Радиус атома серы (вычисленный) составляет 88 пм.
Атомная масса атома серы составляет 32,059-32,076 а. е. м.
Источник: xn--80aaafltebbc3auk2aepkhr3ewjpa.xn--p1ai