При нахождении коэффициентов активности сульфата калия по его растворимости в присутствии добавок другого электролита в качестве последнего нами был выбран хлорид серебра (см 7.2). В связи с этим встала необходимость количественного определения ионов серебра при концентрации их порядка lO -lO»6 моль/л.
Одним из наиболее чувствительных органических реагентов, используемых при определении малых количеств серебра, является дифенилтиокарбазон, известный в аналитической практике как дитизон.
Дитизон представляет собой фиолетово-черные плоские иглы с металлическим блеском, которые в тонком слое имеют фиолетово-красную окраску. Дитизон имеет следующую химическую формулу: С6 H5N = N С S N Н N Н С6 Н5, или С6 Н5 N = N С (SH) = N N Н С6 Н5 , практически не растворяется в воде при рН 7. Растворы дитизона в четыреххлористом углероде и хлороформе интенсивно окрашены в зеленый цвет. Так, раствор реагента, разбавленный до 1 : 10 , при толщине слоя 1 см обладает еще отчетливой окраской.
Являясь слабой двухосновной кислотой, дитизон в зависимости от величины рН образует в водном растворе однозарядные ионы Н Dz и двухзарядные ионы Dz » в разных соотношениях. Таким образом, при взаимодействии с ионами серебра в кислой среде при избытке реагента образуется первичный (кислый) дитизонат серебра состава AgHDz (кето-дитизонат), а в щелочной среде при недостатке дитизона — вторичный Ag2 Dz — (енольный дитизонат) [ 286 ]. На образовании в кислой среде интенсивно окрашенного в оранжево-желтый цвет однозамещенного дитизоната серебра AgHDz, растворимого в неполярных органических растворителях, основано экстракционно-фотометрическое определение серебра.
В определенном интервале рН дитизон образует внутрикомплексные соединения с 18 различными ионами тяжелых металлов. В периодической системе эти элементы расположены очень близко один от другого и обычно называются аналитиками элементами «группы дитизона». К этой группе относятся только те элементы, ионы которых образуют в водных растворах труднорастворимые сульфиды [ 287 ]. Ион серебра реагирует с дитизоном активнее других металлов группы дитизона (за исключением двухзарядных ионов ртути и палладия и трехзарядного иона золота). Таким образом, так называемый «дитизоновый метод» может быть применен для определения в растворе малых количеств ионов серебра в присутствии ионов щелочных металлов [ 288 ].
Определение концентрации ионов серебра в пробе раствора хлорида серебра проводилось нами методом фотометрического титрования на однолучевом фотоэлектрическом колориметре КФО — У4.2. Дозирование титранта, в качестве которого использовали раствор дитизона в хлороформе, осуществляли с помощью микропипетки с ценой деления 0,001 мл. Титрование выполняли в кювете объемом 15 мл с толщиной поглощающего слоя 3 см, без кюветы сравнения. Точность метода, отработанного на специально приготовленных смесях, 0,5 %.
К взвешенной с точностью 1 10″4 г пробе раствора соли серебра (масса пробы составляла не менее 0,1 г) приливали около 5 мл чистого хлороформа для увеличения толщины нижнего слоя, около 5 мл воды ддя увеличения толщины верхнего, водного слоя над органической фазой и проводили титрование. При этом продукт взаимодействия титранта -раствора дитизона в хлороформе — с ионами серебра окрашивает органический слой в желтый цвет.
При окончании титрования появляется зеленоватая окраска неводного слоя, обусловленная присутствием избыточного количества титранта (имеющего, как указано выше, зеленый цвет). Слабо различимое визуально изменение окраски при прибавлении первой избыточной порции раствора дитизона в хлороформе уверенно фиксировалось в виде хорошо заметного максимума на кривой титрования даже при объеме этой порции 0,001 мл. После добавления очередного количества титранта раствор в кювете перемешивали с помощью стеклянной мешалки. Фотометрическое титрование можно проводить при красном или оранжевом светофильтре. При этом пучок света в фотоэлектрическом колориметре должен проходить только через нижний органический слой, для чего можно использовать специально подобранной высоты подставку под дно кюветы при помещении ее в гнездо прибора.
Концентрация использованного в качестве титранта раствора дитизона в хлороформе составляла около 10″5 моль/л. Точная концентрация дитизона устанавливалась с помощью стандартных растворов нитрата серебра и перед каждой серией измерений проверялась как на этих растворах, так и на растворе хлорида серебра в воде, приготовленном ранее. Необходимость постоянного контроля концентрации дитизона связана с высокой летучестью растворителя — хлороформа, а также с возможностью разложения растворенного реагента.
Указанным методом нами была определена концентрация насыщенного водного раствора хлорида серебра. Хлорид серебра получали при смешении растворенных в воде эквивалентных количеств нитрата серебра и хлорида натрия и многократно промывали дистиллированной водой на воронке Бюхнера. Насыщение водного раствора хлорида серебра проводили при 298 К в сосуде растворимости по методике, описанной выше в 2.2 настоящей работы.
Оригинал текста доступен для загрузки на странице содержания
Источник: studexpo.net
Электрохимические методы анализа
Потенциометрический метод анализа относится к электрохимическим. Это метод определения концентрации ионов в растворе, основанный на измерении потенциала электрода, погруженного в исследуемый раствор. Потенциал отдельного электрода измерить невозможно. Необходимо составить соответствующую гальваническую ячейку.
Она состоит из двух электродов, помещённых в анализируемый раствор. Потенциал одного из этих электродов – индикаторного – зависит от концентрации определяемого иона. Потенциал другого – электрода сравнения постоянен и не зависит от состава анализируемого раствора.
В аналитической практике используют две разновидности потенциометрического анализа. Первоая– прямая потенциометрия – измерение потенциала индикаторного электрода и нахождение концентрации определяемого иона по его величине. Вторая – потенциометрическое титрование — измерение потенциала индикаторного электрода в процессе титрования анализируемого раствора.
ЭЛЕКТРОДЫ СРАВНЕНИЯ И ИНДИКАТОРНЫЕ ЭЛЕКТРОДЫ
Слайд 1
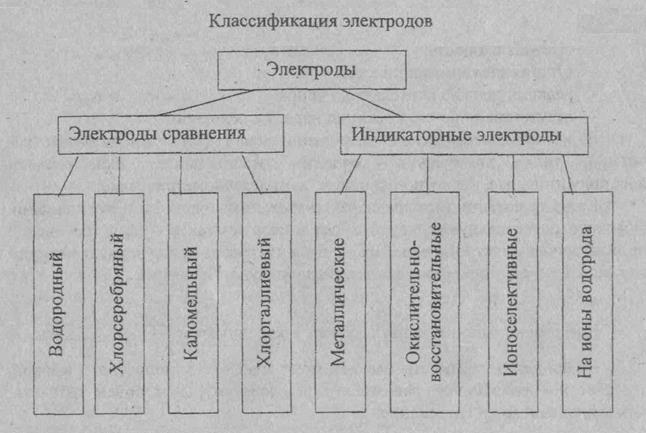
Электроды сравнения
Потенциал индикаторного электрода измеряют по отношению к электроду, потенциал которого сохраняется постоянным. Нормальный водородный электрод для практического использования не удобен. Поэтому в качестве электрода сравнения используют специально изготовляемые электроды, потенциалы которых остаются постоянными как при работе с ними, так и при их хранении.
Наибольшее применение имеет хлорсеребряный электрод, изготовленный из серебряной проволоки, покрытой тонким слоем хлорида серебра, помещённый в раствор хлорида калия. Также используют каломельный электрод сравнения, содержащий металлическую ртуть, каломель (Hg2CI2) и хлорид калия. Это электроды второго рода. Потенциал электродов второго рода зависит от концентрации анионов.
Слайд 2
Электрохимическая реакция – реакция на электроде
AgCl + e → Ag 0 + Cl —
Потенциал хлорсеребряного электрода равен
Слайд 3
Если такой электрод опустить в насыщенный раствор хлорида калия, то концентрация хлорид ионов будет постоянная и потенциал хлорсеребряного электрода будет постоянным, т.е. удовлетворять требованию электродов сравнения.
Индикаторные электроды.
Индикаторный электрод — электрод, потенциал которого зависит от концентрации определяемых ионов в растворе.
Требования к индикаторным электродам.
1). Должны быть обратимы по отношению к одному из ионов, участвующих в химической реакции.
2). Не должен взаимодействовать с ионами, находящимися в растворе, т.е. должен быть индифферентным.
3). Должен концентрационно правильно и мгновенно реагировать на изменение концентрации потенциалопределяющего иона.
В качестве индикаторных электродов в потенциометрическом методе анализе используется металлические и мембранные ионоселективные электроды (ИСЭ).
Металлические электроды. Это электроды первого рода. Они представляют металлический электрод, опущенный в раствор собственной соли. Например, серебряный электрод, это серебряная проволока, опущенная в раствор собственной соли (AgNO3), содержащей ионы серебра.
Слайд4
Реакция в растворе Ag + + Cl — → AgCl
Электрохимическая реакция на электроде
E = E 0 + 0,059 lg C (Ag + )
Таким образом, потенциал серебряного электрода зависит от природы металла (E o Ag+/Ag) и концентрации ионов серебра Ag+ в растворе, т.е. является индикаторным электродом для ионов серебра.
Серебряный электрод можно применять для определения ионов серебра.
Для определения ионов ртути (I) нужен ртутный электрод.
В общем виде потенциал электрода первого рода равен
Таким образом, потенциал металлического электрода зависит от концентрации потенциалопределяемых ионов в растворе.
Слайд5
Индикаторные электроды из благородных металлов (платина, золото, палладия) являются индикаторными для окислительно-восстановительных систем.
Их потенциал выражается уравнением Нернста
В этом случае металлы являются лишь переносчиками электронов от восстановленной формы к окисленной. Их потенциалы зависят от соотношения концентраций окисленной и восстановленной форм системы. Электроды из платины (и золота) используют при потенциометрическом окислительно – восстановительном титровании.
Ионоселективные мембранные электроды. Ионоселективным называется электрод на основе мембраны, потенциал которой линейно зависит от десятичного логарифма концентрации определяемого иона в растворе.
Основной частью такого электрода является полупроницаемая мембрана – тонкая плёнка растворов электролитов, твёрдый или стекловидный электролит.
При соприкосновении поверхности с раствором происходит обмен ионами между мембраной и раствором. Таким образом, если возникновение потенциала на металлических электродах связано с переносом электронов через границу раздела электрод – раствор, то в случае мембранных электродов – с обменом ионами между материалом мембраны и раствором.
Слайд 6
Потенциал ионоселективного электрода
где k – постоянная, зависящая от конструкции электрода:
знак ± зависит от заряда иона (плюс – для катионов, минус – для анионов); z – заряд иона; С(А) – концентрация иона.
В зависимости от материала мембранные электроды подразделяются на стеклянные, с твёрдой, с жидкой мембранами.
Стеклянный электрод – это один из давно известных мембранных электродов, широко используемых для определения pH, т.е. концентрации ионов водорода.
Слайд 7 (стеклянный электрод)
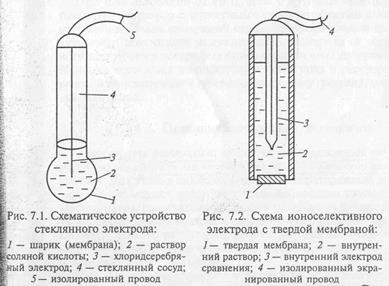
Этот электрод представляет небольшой стеклянный сосуд, к нижней части которого припаян шарик из стекла специального состава. В сосуд заливают 0,1 М раствор соляной кислоты. В этот внутренний раствор погружён хлорсеребряный электрод – серебряная проволока, покрытая хлоридом серебра. К серебряной проволоке припаян изолированный экранированный провод.
Стеклянный электрод обычно используют при измерениях pH с хлорсеребряным электродом сравнения.
Стеклянный шарик изготовлен из специального стекла, содержащий оксиды: натрия, кальция, лития, кремния.
При опускании стеклянного электрода в раствор, содержаний ионы водорода, идёт обменная реакция.
Слайд 8.
E = k – 0,059pH
где k = const зависит от сорта стекла и устройства электрода
Концентрация во внешней и внутренней частях мембраны разная. Поэтому на границе раздела стекло – исследуемый раствор возникает потенциал, который зависит от концентрации ионов водорода в исследуемом растворе, т.е. от pH.
Преимущества стеклянного электрода
1). На измерение pH не влияют посторонние ионы.
2). Потенциал устанавливается быстро.
3). Не отравляется.
4). Пригоден для измерения в широком диапазоне pH: от 1 до 14.
1). Хрупкость стеклянного шарика.
ЭЛЕКТРОДЫ С ТВЁРДЫМИ МЕМБРАНАМИ
В них используют тонкие пластины (мембраны) из веществ, мало растворимых и проводящих ток за счёт ионов. Например, фтор селективный электрод с мембраной из кристаллического три фторида лантана. Этим электродом можно измерять вторичную концентрацию фторид-ионов от 1 до 10 -6 моль/л.
ЭЛЕКТРОДЫ С ЖИДКИМИ МЕМБРАНАМИ
В них используют мембрану в виде пористой полимерной плёнки, пропитанной раствором электропроводного вещества в органическом растворителе. Один из ионов электродного вещества обменивается с ионом, находящимся в водном растворе. Такие электроды используются для определения нитрат ионов, хлорид-ионов, бромит-ионов, иодит-ионов, катионов калия, натрия, кальция и др.
Источник: infopedia.su
Способ качественного определения ионов серебра

СОЮЗ СОВЕТСК СОЦИАЛИСТИЧЕС 135 ЕСПУБЛ 78(54) СПОСОБ КА ЛЕНИЯ ИОНОВ (57) Сущность из пробу обрабаты 3-этоксикарбони енилимино) рода моль/л, 3 табл,Известен способ .экстракционно-фото- метрического определения ионов серебра с помощью гетероциклическйх аминов, кото-. рыи заключается в экстрагировании органикческими растворителями их ионных ассоциатов и фотометрировании.Недостатком дайного способа является невысокая чувствительность 101 — 10 моль/л для серебра, т. е. 170 у в пробе, что не дает возможности определять наличие ионов серебра в природных и сточных водах.Наиболее близким к предлагаемому по техйической сущности и достигаемому результату является способ идентификации ионов серебра с помощью 5-(и-диэтиламинобензилилиден)роданина; основанный на йолучении окрашенных соединений (пятен) на фильтровальной бумаге, пропитанной насыщенным раствором реагента, Определение можно проводить в микропробирках, но необходимо йоддерживать определенаналитичеению ионов водах, химиных средстовано для ектах внешктивови леораториях х станцйй, контрольноптечных уч-ОСУДАРСТВЕННЫЙ КОМИТЕТО ИЗОБРЕТЕНИЯМ И ОТКРЫТИЯМРИ ГКНТ СССР ВТОРСКОМУ СВИДЕТЕЛЬСТ 1(71) Львовский государственный медицинский институт(56) Пятницкий И. В., Сухан В. В. Анали 1 иче-скал химия серебра. М.: Наука, 1973, с. 110.Авторское свидетельство СССРЬ 451309, кл.
6 01 1 ч 5/00, 1972,Файгль ФАнгер В, Качественный анализ неорганических веществ. М,: Мир, 1976,т. 2, с. 114.
Изобретение относится к ской химии, а именно к определ серебра в природных й сточных ческих реактивов и лекарствен вах, и может быть использ открытия ионов серебра в обь ней среды, оценки качества реа карственных средств в лаб санитарно-эпидемиологически химических лабораториях и в аналитических лабораториях а реждений,Известен способ экстракционно-фото- метрического определения ионов серебра с помощью дийафтизона, основанный на экстракции хлороформом образующегося динафтизата и фотометрировании,Недостатком указанного способа является невысокая чувствительйость 0,1 мкг/мл, что не позволяет определить следовые количества серебра,ЧЕСТВЕННОГО ОПРЕДЕСЕРЕБРАобретения: анализируемуювают спиртовым раствором.лметил-(и-диэтиламинофина концентрации 10 — 10держания узкого значения рН и точного количества реагента, что позволяет упроститьспособ, увеличить чувствительность реакции более чем на порядок и повысить специфичность.В качестве цветореагента в предлагаемомспособе используется спиртовый раствор 3 этоксикарбон ил метил-(и-диэтил ам иное нилимино)-роданина концентрации 1010 моль/л, так как при более низких концентрациях не обеспечивается полное образование комплексногь соединения. Верхняя граница концентрации цветореагента объясняется понижением чувствительности реакции,3-этоксикарбонилметил-(и-диэтиламинофенилимино)-роданин получен нами взаимодействием 3-этилкарбоксиметилроданина с и-нитрозодиэтиленилийом в этаноле при кипячении по следующейметодике: 2,6 г (0,0118 моль) 3-этилкарбоксиметилроданина смешали с 2,1 г (0,0118моль) и-нитроэодиэтиланилином и растворяют в 20 мл этанола, Реакционную смесь кипятят с обратным холодильником в течение 1,5 ч. После охлаждения растворитель декантируют, а образовавшийся мазеобразный продукт смешивают с 30 мл бензола, кипятят 10 мин и упаривают, Остатокрастворяют в 15 мл ацетона, прибавляютактивированный уголь и оставляют при комнаткой температуре на 10 — 15 мин, отфильтровывают, растворитель отгоняют, а остаток помещают в эксикатор и вакуумйруют.
Через 10 — 12 дней образуются темно 25303540 ное значение рН и отделение избытка реактива экстракцией эфиром.Недостатком указанного способа является невысокая специфичйость, поскольку открытию ионов серебра с помощью 5-(и диэтиламинобензилиден роданин мешают ионы Нц, Ан, Рб, РЬ, СнЦель изобретения — повышение селективности и чувствительности способа.Поставленная цель достигается тем, что 10 в способе качествеййого определения ионов серебра с применением органических реагентов согласно изобретению, в качестве реагента используют спиртовый раствора 3-этоксикарбонилметил-(и-диэ тиламинофенилимино) роданина концентрации 10 — 10 мол ь/л.Существенное отличие предлагаемого способа состоит в том, что при взаимодействии ионов серебра и 3-этоксикарбонилметил-(и-диэтиламинофенилимино)-роданина образуется растворимое комплексноесоединение, окрашенное в ярко-синий цвет, для образования которого не требуется подвишневые блестящие кристаллы. Выход 1,2г(26%), Тп =80 — 83 С.Элементный анализ, вычислено, %; й -11,1; Я — 16,9найдено, %: М — 10,8; Я — 16,4Способ качественного определенияионов серебра осуществляется следующимобразом; на фильтровальную бумагу, смоченную цветореагентом, или в микропробирку с определенным количествомреагента наносят каплю или эквивалентноеколичество раствора соли серебра.
Наблюдается изменение виьнневой окраски реагента на ярко-синюю образованногокомплексного соединения,П р и м е р 1. Фильтровальную бумагупропитывают спиртовым раствором реагента (1: 2000), который окрашивает ее в интенсивный красный цвет, На поверхностьобработанной таким образом бумаги наносят каплю анализируемого раствора, содержащего ионы серебра, Окраска бумагиизменяется в синий цвет. Определению серебра таким способом не Мешают ионы других металлов, в т, ч, Рб, РЬ, Нц, Снтак как прибавление к исследуемому раствору не меняет результата реакции; отсутствие ионов серебра в этой смеси даетотри цател ьн ый резул ьтат.Предел обнарукения — 0,4 у, Предел,разбавления — 1: 50000Специфичность действия реактива приведена в табл, 1,П р и м е р 2. К 1 мл спиртового растворареактива, содержащего 1 — 2 мкг/мл реагента прибавляют 1 мл анализируемого раствора, Раствор изменяет свою окраску открасного к ярко-синему цвету.Предел обнаружения — 0,008 у, Предель-.ное разбавление — 1: 2500000,Результаты определений приведены втабл. 2.Предлагаемый способ является болеечувствительным, так как позволяет определить 0,008 у ионов серебра в пробе; чтоболее чем на порядок превышает известныйспособ (0,1 мкг/мл).Предлагаемый реактив-зтоксикарбонил-(и-диэтиламинофенилимино)-роданин является более селективным, чем 5-(Мдиэтиламинобензилиден)-роданин, так какдает возможность определить ионы серебрав присутствии ионов Ну, Ан, Рб, Стогда как известному реактиву мешают указанные ионы.Проведены дополнительные исследования по выяснению влияния присутствия наиболее часто сопутствующих элементов и риразличной их концентрации (табл, 2),1755135 6 Таблица 1 Цвет осадка или раство а Цвет осадка или раство а Ионы Ионы Нет осадка То жеИ И Н Н Н Н Н И И И Н И ФФ Н Н 11 Раствор яркосинего г цвета Нет осадка То жеИ И Цинк /И/Кадмий /11/Ртуть //Ртуть /11/Хром /11/АммонийМа ганец Н ДихроматХром атРоданидОртофасфатАрсе натАрсен итТа т ат ФФ И И И Н Н Н И 5Из представленных в табл. 2 данных следует,что при использовании предлагаемого реактива достигается повышейие из-+бирательности определения Ад . Кратность повышения избирательностй по отношению к ртути достигает 66 раз, меди — 10 раз.6 Присутствие Нд 2+ и СсР+ не мешает открытию серебра предлагаемым способом, так как они не образуют окрашенных соединений или осадков с предлагаемым реактивом при любых концентрациях,Понижение чувствительности обнаружения Ад пои концентрации реагента в растворе 10 м объясняется интенсивно- красной окраской реагента, которая маскиНатрий /1/Калий /1/Литий /1/Магний /11/Кальций /1/Стронций /11/Барий /1/.Алюминий /11/Свинец /11/Олово /11/Висмут /Ш/Медь /1 /Медь /1/Серебро /1/ рует синюю окраску продукта его реакции с Ад .Результаты исследования влияния концентрации реагента йа чувствительность 5 обнаружения серебра йредставлены в табл,3,формула изобретения Способ качественного определенияионов серебра путем обработки пробы химическим реагейтом С образованием окра шенного соединения, о т л и ч а ю щ и й с ятем, что, с целью повышения селективности и чувствительности определения, в качестве реагента используют спиртовый раствор 3- этоксика рбонил метил-(и-диэтила миное 15 нилимино-роданина концентрации 1010 5 моль/л. Железо /11/Железо /111/Кобальт /11/Никель /1/Палладий /1/ХлоридБромидИодидНитратНитритСульфитСульфатАцетатПерманганатТираж Подписноевейного комитета по изобретениям и открытиям при ГКНТ ССС 113035, Москва, Ж, Раушская наб., 4/5
Заявка
ЛЬВОВСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ ИНСТИТУТ
ЗИМЕНКОВСКИЙ БОРИС СЕМЕНОВИЧ, МУЗЫЧЕНКО ВЛАДИМИР АФАНАСЬЕВИЧ, МЫНКА АНАТОЛИЙ ФЕДОРОВИЧ, МУРАВЬЕВА АЛЛА АЛЕКСАНДРОВНА, МУРАТОВА ЛИЛИЯ АЛЕКСЕЕВНА
Источник: patents.su