Определение поправочного коэффициента : Определенное количество ( около 40 мг) оксида ртути ( Н) и 1 г иодида калия растворяют при слабом нагревании в 30 см3 кипящей воды. Раствор охлаждают, прибавляют 5 капель смешанного индикатора и титруют раствор 0 05 М НСЮ4 до перехода окраски индикатора из зеленой в красную. [1]
Определение поправочного коэффициента / возможно двумя путями. Один путь — рациональный — это, как указано выше, путь теоретического расчета на основе определенных предположений о природе взаимодействий между частицами, приводящих к отступлению системы от идеального состояния. [2]
Для определения поправочного коэффициента к раствору азотнокислого серебра в коническую колбу вносят пипеткой 10 мл раствора хлористого натрия и 90 мл дистиллированной воды, добавляют 1 мл раствора хромовокислого калия и титруют раствором азотнокислого серебра до перехода ли-монно-желтой окраски мутного раствора в оранжево-желтую, не исчезающую в течение 15 — 20 с. Полученный результат считают ориентировочным. К оттитрованной пробе прибавляют одну-две капли раствора хлористого натрия до получения желтой окраски. Эта проба является контрольной при повторном, более точном определении. Для этого отбирают новую порцию раствора хлористого натрия и титруют азотнокислым серебром до получения незначительной разницы оттенков слабооранжевого в титруемом растворе и желтого в контрольной пробе. [3]
Часть 2. Коэффициент поправки
Для определения поправочных коэффициентов используют вещества высокой чистоты. Последние могут быть получены с помощью препаративной газовой хроматографии. В случае легколетучих компонентов необходимо не допускать испарения компонентов смеси при отборе пробы. Поэтому для приготовления калибровочных смесей рекомендуется брать достаточно большие количества веществ. [5]
После определения поправочных коэффициентов dq их прибавляют к начальным значениям и получают улучшенное приближение. [6]
Для определения поправочных коэффициентов в колонку при одной и той же температуре и скорости потока газа-носителя вводят по несколько раз исходные растворы с известными составами. Затем из отношения площадей i-того и стандартного компонентов и их весовых долей определяют поправочные коэффициенты. При анализе растворов, находящихся в равновесии с адсорбентом, по величинам площадей пика компонентов на хроматограммах и поправочным коэффициентам определяют весовые доли компонентов. [7]
Для определения поправочного коэффициента на вспомогательный угол резца в плане cpj производят умножение. [8]
Для определения поправочных коэффициентов используют вещества высокой чистоты. Последние можно получить с помощью препаративной газовой хроматографии. В случае легколетучих компонентов необходимо не допускать испарения компонентов смеси при отборе пробы. Поэтому для приготовления калибровочных смесей рекомендуется брать достаточно большие количества веществ. [9]
Для определения поправочного коэффициента 0 05 М раствора комплексона III по раствору нитрата цинка бюреткой отбирают в коническую колбу вместимостью 500 мл 20 мл раствора комплексона III и разбавляют его водой до 200 мл. Вводят 5 — 6 капель ксиленолового оранжевого и добавляют по каплям аммиак до синей окраски, которую устраняют добавлением по каплям разбавленной соляной кислоты. Затем в колбу приливают 20 мл ацетатного буферного раствора и титруют раствором нитрата цинка до изменения желтой окраски раствора в розовую. [10]
Кузьмич Е.С. Приготовление рабочего раствора нитрата серебра и установка его концентрации.
Для определения поправочного коэффициента и газ из баллона ( азот, воздух) пропускают последовательно через систему, состоящую из двух трубок с фосфорным ангидридом, U-образную трубку с навеской дестиллированной воды ( 0 2 — 0 3 г) и две трубки с карбидом кальция. [11]
Для определения поправочных коэффициентов используют вещества высокой чистоты. Последние могут быть получены с помощью препаративной газовой хроматографии. В случае легколетучих компонентов необходимо не допускать испарения компонентов смеси при отборе пробы. Поэтому для приготовления калибровочных смесей рекомендуется брать достаточно большие количества веществ. [13]
Для определения поправочного коэффициента 25 мл приготовленного раствора переносят в коническую колбу, прибавляют 2 — 3 мл ледяной уксусной кислоты и 10 мл раствора K.J. Выделившийся иод титруют раствором Na2S203, прибавляя к концу титрования 2 — 3 мл раствора крахмала. [14]
Для определения поправочного коэффициента / d необходимо предварительно определить число Рейнольдса. [15]
Источник: www.ngpedia.ru
Стандартизация титрованных растворов
После приготовления проводят стандартизацию титрованных растворов. Под стандартизацией титрованного раствора понимают процесс нахождения точной концентрации активного реагента в растворе.
Согласно ГФ концентрацию титрованных растворов устанавливают с помощью специальных установочных веществ (первичных стандартов) – исходных стандартных веществ. Их обозначают буквами РО (реактив основной). Исходные стандартные вещества(первичные стандарты) – вещества высокой чистоты. Согласно указаниям ОФС «Титрованные растворы» их готовят из реактивов, подвергая дополнительной очистке (сублимируют, перекристаллизовывают).
В основе стандартизации лежит стехиометрическое взаимодействие титранта и первичного стандартного вещества.
Вещества, используемые в качестве первичных стандартов, должны иметь:
– состав, точно соответствующий формуле;
– высокую чистоту (строгая стехиометричность состава);
– устойчивость на воздухе при комнатной температуре (не должны изменяться при хранении);
– отсутствие гигроскопической влаги (должны быть негигроскопичными);
– по возможности большую молярную массу эквивалента для обеспечения минимальной погрешности взвешивания;
Согласно ОФС «Титрованные растворы» в качестве исходных стандартных веществ (реактивов основных (РО); первичных стандартов) для установки концентрации титрованных растворов в титриметрическом анализе используют:
– калия бромат (РО) KBrO3;
– натрия карбонат безводный (РО) Na2CO3;
– натрия хлорид (РО) NaСl;
В качестве вторичных стандартов при стандартизации титрованных растворов согласно ГФ выступают титрованные растворы с установленной концентрацией, которые стехиометрически взаимодействуют со стандартизуемым титрованным раствором.
Например, стандартизацию титрованных растворов аммония тиоцианата (аммония роданида) согласно ГФ следует проводить, используя в качестве вторичного стандарта титрованные растворы серебра нитрата.
Для стандартизации заполняют бюретку приготовленным титрованным раствором и титруют точно отмеренный объем стандартного титрованного раствора (вторичный стандарт) или точную навеску исходного стандартного вещества (реактив основной (РО); первичный стандарт). В ряде случаев при стандартизации точно отмеренный объем приготовленного титрованного раствора титруют стандартным титрованным раствором (вторичный стандарт).
Точку конца титрования (ТКТ) при стандартизации приготовленного титрованного раствора определяют тем же методом, которым она будет устанавливаться в методике количественного определения анализируемого ЛС согласно НД – по индикатору, методом потенциометрии, амперометрии и др. При стандартизации титрованного раствора должен быть использован тот же состав среды, в котором он будет использоваться.
Способ приготовления титрованного раствора, методика стандартизации, установочное вещество, температурный режим, скорость титрования (при необходимости), защита от воздействия окружающей среды (титрование в атмосфере инертного газа и др.), способ расчета концентрации и поправочного коэффициента (К) титрованного раствора приводится в статье на титрованный раствор соответствующего наименования в ОФС «Титрованные растворы».
Согласно ГОСТу для расчета концентрации приготовленного титрованного раствора в ГФ приведены 2 способа:
– по навеске химически чистого вещества (первичный стандарт);
– по титрованному раствору известной концентрации (вторичный стандарт).
На основании найденной истинной концентрации рассчитывают поправочный коэффициент к молярной концентрации (К) приготовленного титрованного раствора, который характеризует точность приготовления титрованного раствора.
Поправочный коэффициент показывает отношение реально полученной (экспериментально установленной) концентрации титрованного раствора к теоретически заданной или отношение его истинного и теоретического титров:
Для обеспечения точности измерения молярной концентрации и поправочного коэффициента используют калиброванную посуду. При определении поправочного коэффициента проводят не менее трех параллельных титрований. Титрование ведут в конических колбах вместимостью 250 мл.
Если результаты титрования отличаются друг от друга менее чем на 0,05 мл, то для расчета К берут среднее арифметическое из полученных результатов. Если расхождения между отдельными титрованиями превышает 0,05 мл, то титрование повторяют до тех пор, пока не будут получены сходимые результаты.
Расхождение между коэффициентами поправки по каждой навеске установочного вещества (первичного стандарта) или по каждому объему раствора установочного вещества (вторичный стандарт) не должны превышать 0,001. Относительная погрешность определения поправочного коэффициента не должна превышать ±0,2%. Для этого следует титровать не менее 20,0-30,0 мл раствора (0,05·100/25 = 0,2%) и пользоваться мерными колбами и пипетками, предварительно проверенными на точность калибровки. Точность приготовления титрованных растворов является необходимым условием высокой точности титриметрических способов количественного определения фармацевтических субстанций и лекарственных средств.
Поправочный коэффициент нужно определять при 20 0 С. При этой же температуре рекомендуется проводить количественное определение титриметрическими методами с помощью титрованных растворов. Если титрованные растворы применяют при других температурах, то коэффициент поправки устанавливают при соответствующей температуре и используют температурную поправку.
Если титрованный раствор устойчив, соблюдены условия хранения и нет других указаний в НД, то коэффициент поправки проверяют один раз в месяц. В случае изменения титра титрованного раствора в процессе хранения под действием различных факторов окружающей среды (например, реактив Фишера, раствор иодмонохлорида, раствор иода), то согласно НД каждый раз перед применением заново определяют его титр (реактив Фишера) или параллельно проводят контрольный опыт на титрованный раствор.
Поправочный коэффициент согласно ГФ должен укладываться в интервал 0,9–1,1 (т.е. отличаться от заданной концентрации не более чемна ±10%). В случаях, когда значения поправочных коэффициентов не укладываются в указанные пределы, растворы необходимо укрепить или разбавить.
Для РАЗБАВЛЕНИЯ титрованных растворов (поправочный коэффициент К больше 1,1) нужно добавить растворитель, рассчитав его объем по формуле:
где V – объем растворителя, который нужно добавить для доведения поправочного коэффициента (К) до нормы, мл; W – заданный для приготовления объем титрованного раствора, мл; Wi – объем приготовленного титрованного раствора, израсходованный при установлении концентрации, мл.
Результат умножения соответствует количеству растворителя в мл, которое нужно прибавить к приготовленному раствору для доведения поправочного коэффициента (К) до требуемого значения.
ПРИМЕР: Поправочный коэффициент 500 мл 0,1 М раствора натрия гидроксида равен 1,15. Приведите расчет доведения поправочного коэффициента (К) до нормы.
РЕШЕНИЕ: Так как поправочный коэффициент (К) больше 1,10, то раствор следует разбавить, добавив воду в количестве:
(1,15 — 1,0) ·500 = 75 (мл).
ЗАКЛЮЧЕНИЕ: Раствор следует разбавить, добавив 75 мл воды.
Для УКРЕПЛЕНИЯ титрованного раствора (поправочный коэффициент К меньше 0,9) нужно добавить вещество, рассчитав его количество по формуле:
а, г = (1,0 – К) · m; (11)
где а – количество вещества, которое нужно добавить для доведения поправочного коэффициента до нормы, г; m – навеска вещества, взятая для приготовления заданного объема титрованного раствора, г.
ПРИМЕР: 2000 мл 0,1 М раствора натрия гидроксида (Mr 40,0) приготовлены из навески массой 8,0 г (m). Поправочный коэффициент полученного раствора равен 0,85 (К). Приведите расчет доведения поправочного коэффициента (К) до нормы.
РЕШЕНИЕ: Раствор следует укрепить (поправочный коэффициент (К) меньше 1,0), добавив натрия гидроксид в количестве:
а, г = (1,0 – К) · m = (1,0 — 0,85) · 8 = 1,2.
ЗАКЛЮЧЕНИЕ: Раствор следует укрепить, добавив 1,2 г натрия гидроксида.
После добавления рассчитанного количества растворителя или исходного вещества проводят повторное (трехкратное) определение поправочного коэффициента. При соответствии поправочного коэффициента (К) требованиям ГФ титрованный раствор готов к употреблению.
Титрованные растворы, более разбавленные, чем представленные в ОФС «Титрованные растворы» (0,05; 0,02; 0,01; 0,001М), готовят непосредственно перед использованием путем разведения водой, свободной от углерода диоксида. При этом поправочные коэффициенты титрованных растворов для кислотно-основного и осадительного титрования, полученных путем разбавления более концентрированных исходных титрованных растворов, используют такие же, как и у исходных растворов.
Поправочные коэффициенты титрованных растворов для окислительно-восстановительного титрования, полученных путем разбавления более концентрированных исходных титрованных растворов, устанавливают заново.
Титрованные растворы готовят и хранят в стеклянных бутылках, склянках с тубусом, растворы щелочей – в полиэтиленовых бутылках, плотно закрытых пробками. Склянки с тубусом или бутыли для титрованных растворов светочувствительных веществ должны быть темного стекла или окрашены черным лаком.
Титрованные растворы следует тщательно оберегать от потери влаги и от разбавления водой, так как при этом изменяется их титр. Титрованные растворы хранят в помещениях при комнатной температуре в местах, защищенных от попадания прямых солнечных лучей, возможно дальше от источников тепла. При необходимости титрованные растворы защищают от воздействия углерода диоксида и влаги воздуха. При появлении капель испарившейся жидкости в верхней части бутылей с титрованным раствором бутыли необходимо тщательно взболтать. Титрованные растворы, в которых при хранении появились хлопья или осадок, применять нельзя.
На склянках с титрованными растворами должно быть указано название раствора, заданная молярная концентрация, коэффициент поправки, применяемый индикатор, дата (число, месяц, год) и температура установления поправочного коэффициента. Согласно ГОСТу допускается вместо заданной молярной концентрации и коэффициента поправки указывать значение точной молярной концентрации с четырьмя значащими цифрами после запятой.
Источник: studopedia.su
Определить поправочный коэффициент азотнокислого серебра
Определение хлоридов (определение поправочного коэффициента к титру раствора нитрата серебра)
В коническую колбу вместимостью 250 см 3 вносят пипеткой 10 см 3 раствора хлорида натрия и 90 см 3 дистиллированной воды, добавляют 1 см 3 раствора хромата калия и титруют раствором нитрата серебра до перехода лимонно-желтой окраски в оранжево-желтую, не исчезающую в течение 15 — 20 с.
Полученный результат считают ориентировочным. К оттитрованной пробе прибавляют 1 — 2 капли раствора хлорида натрия до получения желтой окраски. Эта проба является контрольной при повторном, более точном определении. Д
ля этого отбирают новую порцию (10 см 3 ) раствора хлорида натрия и титруют нитратом серебра до получения незначительной разницы оттенков слабо-оранжевого в титруемом растворе и желтого в контрольной пробе.
Поправочный коэффициент вычисляют по формуле:
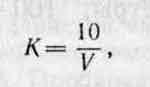
где: V — объем нитрата серебра, пошедший на титрование, см 3 .
Подготовка пробы к анализу
Мутную воду фильтруют через беззольный фильтр, промытый горячей водой. Воду с цветностью свыше 30° обесцвечивают путем добавления суспензии гидроксида алюминия (из расчета 3 см 3 суспензии на 100 см 3 воды), после чего встряхивают до обесцвечивания жидкости. Затем пробу фильтруют через беззольный фильтр. Первые порции фильтрата отбрасывают.
Воду, имеющую щелочную реакцию, нейтрализуют слабым раствором серной кислоты в присутствии фенолфталеина до слабо-розового окрашивания, воду с кислой реакцией — слабым раствором гидрокарбоната натрия, после чего розовую окраску устраняют, взбалтывая воду.
«Руководство к практическим занятиям по методам
санитарно-гигиенических исследований», Л.Г.Подунова
Приготовление 0,1 н. раствора азотнокислого серебра
Эквивалент AgNO3 — 169,89, следовательно, в 1 л 0,1 н. раствора азотнокислого серебра должно содержаться 16,989 г реактива. Для приготовления раствора отвешивают с точностью до 0,01 г 17 г реактива и растворяют в 1 л дистиллированной воды. Титр приготовленного раствора устанавливают через 7-10 дней по химически чистому хлористому натрию. Для этого в стеклянный стаканчик емкостью 0,3-0,5 мл берут с точностью до 0,0001 г навеску в 0,1-0,2 г дважды перекристаллизованного хлористого натрия и, опустив стаканчик в коническую колбу, растворяют в 25-30 мл дистиллированной воды.
Раствор хлористого натрия титруют раствором азотнокислого серебра в присутствии 0,5 мл 10%-ного раствора хромовокислого калия при непрерывном перемешивании содержимого колбы до появления неисчезающей при взбалтывании красновато-бурой окраски. Титр раствора вычисляют по следующей формуле:

где g — навеска хлористого натрия, г; 169,9 — эквивалент азотнокислого серебра; 58,46 — эквивалент хлористого натрия; V — количество раствора азотнокислого серебра, пошедше-го на титрование, мл.
Поправку 0,1 н. раствора азотнокислого серебра получают путем деления установленного титра раствора на титр точно 0,1 н. раствора AgNO3, т. е. 0,01699 г/мл. Титр 0,1 н. раствора азотнокислого серебра обычно устанавливают по 2-3 навескам хлористого натрия. Приготовленный раствор хранят в склянке из темного стекла.
Определить поправочный коэффициент азотнокислого серебра
Настоящий стандарт распространяется на питьевую воду и устанавливает методы определения содержания хлоридов (хлор-иона).

Определение содержания хлор-иона в питьевой воде производят:
при содержании хлор-иона от 10 мг/дм3 и выше титрованием азотнокислым серебром в присутствии хромовокислого калия в качестве индикатора;
при содержании хлор-иона до 10 мг/дм3 титрованием азотнокислой ртутью в присутствии индикатора дифенилкарбазона.
1.1. Отбор проб производят по ГОСТ 2874 и ГОСТ 4979.
1.2. Объем пробы воды для определения содержания хлоридов должен быть не менее 250 см3.
1.3. Пробы воды, предназначенные для определения хлоридов, не консервируют.
2.1. Сущность метода
Метод основан на осаждении хлор-иона в нейтральной или слабощелочной среде азотнокислым серебром в присутствии хромовокислого калия в качестве индикатора. После осаждения хлорида серебра в точке эквивалентности образуется хромовокислое серебро, при этом желтая окраска раствора переходит в оранжево-желтую. Точность метода 1-3 мг/дм3.
2.2 Аппаратура, материалы и реактивы
Посуда мерная стеклянная лабораторная по ГОСТ 1770, ГОСТ 29227, ГОСТ 29251, вместимостью: пипетки 100, 50 и 10 см3 без делений; пипетка 1 см3 с делением через 0,01 см3; цилиндр мерный 100 см3; бюретка 25 см3 со стеклянным краном.
Колбы конические по ГОСТ 25336, вместимостью 250 см3.
Пробирки колориметрические с отметкой на 5 см3.
Воронки стеклянные по ГОСТ 25336.
Фильтры беззольные «белая лента».
Серебро азотнокислое по ГОСТ 1277.
Натрий хлористый по ГОСТ 4233.
Квасцы алюмокалиевые (алюминий-калий сернокислый) по ГОСТ 4329.
Калий хромовокислый по ГОСТ 4459.
Аммиак водный по ГОСТ 3760, 25 %-ный раствор.
Вода дистиллированная по ГОСТ 6709.
Все реактивы, используемые для анализа, должны быть квалификации чистые для анализа (ч. д. а.).
2.3. Подготовка к анализу
2.3.1. Приготовление титрованного раствора азотнокислого серебра.
2,40 г химически чистого AgNO3 растворяют в дистиллированной воде и доводят объем раствора дистиллированной водой до 1 дм3.
1 см3 раствора эквивалентен 0,5 мг Сl-.
Раствор хранят в склянке из темного стекла.
2.3.2. Приготовление 10%-ного раствора (подкисленного азотной кислотой) азотнокислого серебра
10 г AgNO3 растворяют в 90 см 3 дистиллированной воды и добавляют 1-2 капли HNO3.
2.3.3. Приготовление титрованного раствора хлористого натрия
0,8245 г химически чистого NaCl, высушенного при 105 °С, растворяют в дистиллированной воде и доводят объем раствора дистиллированной водой до 1 дм3.
1 см3 раствора содержит 0,5 мг Сl-.
2.3.4. Приготовление гидроокиси алюминия
125 г алюмокалиевых квасцов [AlK(SO4)2×12H2O] растворяют в 1 дм3 дистиллированной воды, нагревают до 60 °С и постепенно прибавляют 55 см3 концентрированного раствора аммиака при постоянном перемешивании. После отстаивания в течение 1 ч осадок переносят в большой стакан и промывают декантацией дистиллированной водой до исчезновения реакции на хлориды.
2.3.5. Приготовление 5 %-ного раствора хромовокислого калия
50 г К2СrО4 растворяют в небольшом объеме дистиллированной воды и доводят объем раствора дистиллированной водой до 1 дм 3 .
2.3.6. Установка поправочного коэффициента к раствору азотнокислого серебра.
В коническую колбу вносят пипеткой 10 см 3 раствора хлористого натрия и 90 см 3 дистиллированной воды, добавляют 1 см 3 раствора хромовокислого калия и титруют раствором азотнокислого серебра до перехода лимонно-желтой окраски мутного раствора в оранжево-желтую, не исчезающую в течение 15-20 с. Полученный результат считают ориентировочным. К оттитрованной пробе прибавляют 1-2 капли раствора хлористого натрия до получения желтой окраски. Эта проба является контрольной при повторном, более точном определении. Для этого отбирают новую порцию раствора хлористого натрия и титруют азотнокислым серебром до получения незначительной разницы оттенков слабо-оранжевого в титруемом растворе и желтого в контрольной пробе. Поправочный коэффициент (К) вычисляют по формуле
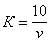
где v — количество азотнокислого серебра, израсходованное на титрование, см 3 .
2.4. Проведение анализа
2.4.1. Качественное определение
Характеристика осадка или мути
2.4.2. Количественное определение
В зависимости от результатов качественного определения отбирают 100 см 3 испытуемой воды или меньший ее объем (10-50 см 3 ) и доводят до 100 см 3 дистиллированной водой. Без разбавления определяются хлориды в концентрации до 100 мг/дм 3 . pН титруемой пробы должен быть в пределах 6-10. Если вода мутная, ее фильтруют через беззольный фильтр, промытый горячей водой.
Если вода имеет цветность выше 30°, пробу обесцвечивают добавлением гидроокиси алюминия. Для этого к 200 см 3 пробы добавляют 6 см 3 суспензии гидроокиси алюминия, а смесь встряхивают до обесцвечивания жидкости. Затем пробу фильтруют через беззольный фильтр. Первые порции фильтрата отбрасывают.
Отмеренный объем воды вносят в две конические колбы и прибавляют по 1 см 3 раствора хромовокислого калия. Одну пробу титруют раствором азотнокислого серебра до появления слабого оранжевого оттенка, вторую пробу используют в качестве контрольной пробы. При значительном содержании хлоридов образуется осадок AgCl, мешающий определению. В этом случае к оттитрованной первой пробе приливают 2-3 капли титрованного раствора NaCl до исчезновения оранжевого оттенка, затем титруют вторую пробу, пользуясь первой, как контрольной пробой.
Определению мешают: ортофосфаты в концентрации, превышающей 25 мг/дм 3 ; железо в концентрации более 10 мг/дм 3 . Бромиды и йодиды определяются в концентрациях, эквивалентных Сl-. При обычном содержании в водопроводной воде они не мешают определению.
2.5. Обработка результатов.
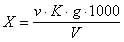
где v — количество азотнокислого серебра, израсходованное на титрование, см 3 ;
К — поправочный коэффициент к титру раствора нитрата серебра;
g — количество хлор-иона, соответствующее 1 см 3 раствора азотнокислого серебра, мг;
V — объем пробы, взятый для определения, см 3 .
Расхождения между результатами повторных определений при содержании Сl- от 20 до 200 мг/дм 3 — 2 мг/дм 3 ; при более высоком содержании — 2 отн. %.
3.1. Сущность метода
Хлориды титруют в кислой среде раствором азотнокислой ртути в присутствии дифенилкарбазона, при этом образуется растворимая, почти диссоциирующая хлорная ртуть. В конце титрования избыточные ионы ртути с дифенилкарбазоном образуют окрашенное в фиолетовый цвет комплексное соединение. Изменение окраски в эквивалентной точке выражено четко, в связи с этим конец титрования определяется с большой точностью.
3.2. Аппаратура, материалы и реактивы.
Посуда мерная стеклянная лабораторная по ГОСТ 1770, ГОСТ 29227, ГОСТ 29251, вместимостью: пипетки 100 и 50 см 3 без делений, цилиндр мерный 100 см 3 микробюретка 2 см 3 .
Колбы конические по ГОСТ 25336, вместимостью 250 см 3 .
Ртуть азотнокислая окисная по ГОСТ 4520.
Натрий хлористый по ГОСТ 4233.
Кислота азотная по ГОСТ 4461.
Спирт этиловый ректификованный по ГОСТ 5962.
Бромфеноловый синий (индикатор).
Все реактивы, используемые для анализа, должны быть квалификации чистые для анализа (ч. д. а.).
3.3. Подготовка к анализу
3.3.1. Приготовление 0,0141 н. раствора азотнокислой ртути
2,42 г Hg(NО3)2×1/2Н2O растворяют в 20 см 3 дистиллированной воды к которой прибавлено 0,25 см 3 концентрированной азотной кислоты, затем объем раствора доводят дистиллированной водой до 1 дм 3 .
1 см 3 этого раствора эквивалентен 0,5 мг Сl-.
Раствор устойчив в течение четырех месяцев.
Поправочный коэффициент к титру раствора азотнокислой ртути определяют титрованием 5 см3 3 хлористого натрия (1 см 3 — 0,5 мг Сl-), разбавленного до 100 см 3 дистиллированной водой, в тех же условиях, как при анализе пробы воды.
3.3.2. Приготовление дифенилкарбазона, спиртового раствора смешанного индикатора
0,5 г дифенилкарбазона и 0,05 г бромфенолового синего растворяют в 100 см 3 95 %-ного этилового спирта. Хранят в склянке из темного стекла.
3.3.3. Приготовление 0,2 н. раствора азотной кислоты
12.8 мл концентрированной азотной кислоты разводят дистиллированной водой до 1 дм 3
Все растворы готовят на дважды перегнанной дистиллированной воде.
3.4. Проведение анализа
Отбирают 100 см 3 испытуемой воды, прибавляют 10 капель смешанного индикатора и по каплям 0,2 н. раствор HNO3 до появления желтой окраски (рН 3,6), после чего прибавляют еще пять капель 0,2 н. раствора HNO3 и титруют из микробюретки раствором азотнокислой ртути. К концу титрования окраска раствора приобретает оранжевый оттенок. Титрование продолжают медленно, по каплям добавляя раствор азотнокислой ртути, сильно взбалтывая пробу до появления слабо-фиолетового оттенка.
Для определения более четкого конца титрования используют контрольную пробу, в которой к 100 см 3 дистиллированной воды прибавляют индикатор, 0,2 н. раствор азотной кислоты и одну каплю раствора азотнокислой ртути.
Определению не мешают цветность воды выше 30° и железо в концентрации, превышающей 10 мг/дм 3 . Йодиды и бромиды определяют в концентрациях, эквивалентных Сl-.
3.5. Обработка результатов
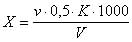
где v — количество азотнокислой ртути, израсходованное на титрование, см 3 ;
К — поправочный коэффициент к титру раствора азотнокислой ртути;
V — объем воды, взятый для определения, см 3 .
Расхождения между результатами повторных определений при содержании Сl- в воде до 10 мг/дм 3 — 0,5 мг/дм3.
- Свежие записи
- Где находится датчик температуры охлаждающей жидкости на ЯМЗ 534?
- Эффект Холла и измерение величин датчиками Холла
- Датчик холла на ВАЗ 2109 инжектор: устройство и функции
- Датчик глубины в телефонах Samsung: что это такое и для чего нужен?
- Последствия неисправности датчика распредвала и как ее обнаружить
Источник: ollimpia.ru