Аргенометрия-метод объемного анализа, основанный на применении стандартного раствора нитрата серебра. Различают несколько методов аргенометрии: метод просветления, метод Мора, метод Фольгарда, метод Фаянса.
Метод Мора применяется для определения бромидов и хлоридов. Он основан на реакции, протекающей между Ag + и Cl — ,выполняется в присутствии индикатора – раствора хромата калия. Лишняя капля титрованного раствора AgNO3, прибавленная после достижения точки эквивалентности, вызывает выпадение кирпично-красного осадка Ag2CrO4, образующегося в результате взаимодействия Ag + с ионами индикатора: 2Ag + +CrO4 -2 =Ag2CrO4. Этот метод выполняется только в нейтральной или слабощелочной среде. В сильнощелочной среде образуется AgOH, который сразу же распадается на Ag2O и H2O: 2Ag + OH — =Ag2O+H2O.
Метод Фольгарда, основанный на реакции, протекающей между Ag + и SCN — , выполняется в присутствии индикатора- насыщенного раствора железлоаммонийных квасцов, содержащих ионы железа. Ag + +SCN — =AgSCN.
14. Интеграл мора ( практический курс по сопромату )
Лишняя капля раствора NH4SCN, прибавленная после достижения точки эквивалентности, вызывает появление кроваво-красного окрашивания раствора вследствие взаимодействия SCN — с ионами Fe +3 индикатора: Fe +3 +3SCN — =Fe(SCN)3. Этот метод применяется в нейтральной и кислой среде. В щелочной среде Fe +3 образует осадок Fe(OH)3, а Ag + может образовать осаок Ag2O.
9. Термохимические уравнения и расчеты. Закон Гесса и следствия из него. Стандартные теплоты сгорания и образования и их применение для термохимических расчетов.
Уравнения химических реакций, в которых записывается величина теплового эффекта, называются термохимическими. Для определения теплового эффекта используется калориметр, снабженный точным термометром. Количество теплоты, выделяющейся в калориметре, определяют по общей теплоемкости всех частей калориметра и изменению температуры: Q=C∆t, С=m1c1+m2c2.
Закон Гесса гласит: тепловой эффект реакции зависит только от природы и состояния исходных веществ и конечных продуктов и не зависит от пути, по которому реакция протекает.
1 следствие из закона Гесса: тепловой эффект реакции равен сумме теплот образования продуктов реакции минус сумма теплот образования исходных веществ.
2 следствие из закона Гесса: тепловой эффект реакции равен сумме теплот сгорания исходных веществ минус сумма теплот сгорания продуктов реакции.
Стандартной теплотой образования называется тепловой эффект образования 1 моль сложного вещества из простых веществ при стандартных условиях.
Стандартной теплотой сгорания называется тепловой эффект сгорания 1 моль органического вещества до Co2 и H2O при стандартных условиях, а если речь идет о неорганических веществах, то указываются степени окисления продуктов сгорания.
Обратимые и необратимые по направлению реакции. Понятия о химическом равновесии. Принцип Ле-Шателье.
Состояние реагирующих веществ, при котором скорость прямой реакции равна скорости обратной реакции называется состоянием химического равновесия. Состояние химичесчкого равновесия характеризуется константой равновесия K. Так, для реакции H2+I2=2HI
Рассмотрели пример определения перемещений методом Мора
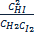
K=
Для обратимой реакции
В 1884г. Французский ученый Ле-Шателье сформулировал принцип подвижного равновесия: при изменении каких-либо параметров системы, находящейся в химическом равновесии, происходит смещение его в направлении, при котором уменьшается влияние этого изменения.
Химическая кинетика, как основа для изучения скоростей и механизма биохимических процессов. Средняя скорость реакции.
Кинетика-наука, изучающая механизм и закономерности протекания химических реакций. В хим.кинетике используется графический метод изображения функциональных зависимостей.
Vср.=  потому что скорость реакции не может быть отрицательной Vср.=-
потому что скорость реакции не может быть отрицательной Vср.=-  поэтому пишем Vср.=
поэтому пишем Vср.=  =
= 
Скоростью химической реакции называется изменение концентрации реагирующих веществ в единицу времени.
Vср.=lim( )
)  →0=
→0= 
 =tgα
=tgα
Источник: infopedia.su
Методы количественного определения солей галогенводородных кислот
В некоторых методах титриметрического анализа применяют титранты, образующие осадки с определяемыми веществами. Методы, в которых используются данные титрованные растворы называются методами осадительного титрования (осаждения). Точку эквивалентности в методах осадительного титрования определяют химическим путем при помощи индикаторов, которые взаимодействуют с избытком титранта или по исчезновению (связыванию) определяемого вещества, а также используют инструментальную индикацию изменений физико-химических свойств раствора в процессе титрования. Для осадительного титрования применимы только быстро протекающие реакции, сопровождаемые количественным осаждением осадка и отсутствием процессов соосаждения. Количественное образование осадка зависит от его растворимости, определяемой произведением растворимости.
Методы аргентометрии:
В фармацевтическом анализе широко используют аргентометрию, которая предполагает взаимодействие галогенов с нитратом серебра:
Применяется метод в виде прямого (методы Мора, Фаянса) и обратного титрования (метод Фольгарда). Титрантами являются 0,1 М и 0,05 М растворы серебра нитрата и аммония тиоцината.
Метод Фольгарда, согласно требованиям ГФУ используется для определения концентрации хлоридов, бромидов способом обратного титрования. Индикатором является раствор железа(III) аммония сульфата (раствор железоаммониевых квасцов). Анализ производится в среде азотной кислоты. Кислая среда нужна для того, чтобы железа(III) аммония сульфат не подвергался гидролизу с образованием не растворимых гидроксидов. Продукт гидролиза – железа (III) гидроксид (красно-бурого цвета) мешает точному определению точки эквивалентности.
К анализируемому раствору приливают точно измеренный избыток 0,1М раствора серебра нитрата, 2-3 мл разведенной кислоты азотной, 10 капель раствора железоаммониевых квасцов и титруют раствором аммония тиоцианата до появления розовой окраски:
При титровании хлоридов по методу Фольгарда нельзя вблизи точки эквивалентности сильно встряхивать реакционную смесь, так как вследствие меньшей величины произведения растворимости серебра (≈ 10 -12 ) по сравнению с серебра хлоридом (≈ 10 -10 ) может произойти частичное превращение серебра хлорида в серебра тиоцианат, в результате чего будут получены заниженные результаты.
Также при титровании хлоридов возможно взаимодействие осадка серебра хлорида с соединением [Fe(SCN)3] красного цвета:
что затрудняет определение точки эквивалентности. Чтобы избежать взаимодействия между серебра хлоридом и комплексным соединением, необходимо отфильтровать осадок и в фильтрате оттитровать избыток нитрата серебра. Избежать взаимодействия осадка можно также путем добавления перед титрованием в анализируемый раствор 5-10 мл органического растворителя с большой плотностью, например четыреххлористого углерода, ксилола, толуола которые изолируют поверхность осадка серебра хлорида. Согласно требований ГФУ для этих целей используется дибутилфталат. При титровании йодидов индикатор – раствор железоаммониевых квасцов – прибавляют после добавления избытка серебра нитрата. Если этого не сделать, то возможно окислительно-востановительное взаимодействие йодид-иона с индикатором:
Видоизмененный метод Фольгарда используется при определении хлоридов и йодидов. Этот способ позволяет избежать взаимодействия йодидов с комплексным соединением [Fe(SCN)3] и тем самым улучшить условия титрования.
К растворенной навеске галогенида добавляют 2-3 мл разведенной кислоты азотной, 1 мл 0,1 М раствора аммония тиоцианата. Раствор окрашивается в красный цвет вследствие образования роданида железа тиоцианата:
Титруют 0,1 М раствором серебра нитрата до исчезновения окраски. Серебра нитрат реагирует вначале с галогенидом:
После достижения точки эквивалентности избыточная капля раствора серебра нитрата реагирует с железа тиоцианатом, вследствие чего раствор обесцвечивается:
Не фармакопейными методами количественного определения солей галогенводородных кислот является метод Мора и метод Фаянса.
По методу Мора титрование раствором серебра нитрата выполняют при рН 6,5-10,0 в присутствии 5-7 капель 5%-ного водного раствора калия хромата в качестве индикатора. В процессе титрования образуются малорастворимые галогениды серебра, и, когда их осаждение закончится полностью, образуется красный осадок серебра хромата, свидетельствующий о достижении точки эквивалентности:
Этим методом определяют концентрацию хлоридов и бромидов. Йодиды определять не рекомендуется, потому что появление красной окраски происходит раньше точки эквивалентности, что объясняется адсорбцией йодид-ионов поверхностью осадка, а также вследствие того, что осадки йодида серебра и хромата серебра близки по цвету и в точке эквивалентности трудно заметен переход окраски.
В кислой среде K2CrO4 переходит в K2Cr2O7, не обладающий индикаторными свойствами вследствие высокой растворимости Ag2Cr2O7. В сильнощелочной среде образуется AgOH, распадающийся на Ag2O и H2O.
Метод Фаянса применяется для определения концентрации йодидов, но он может использоваться также для хлоридов и бромидов. В отличие от метода Мора, титрование выполняется не только в нейтральной среде, но и в среде уксусной кислоты. В качестве индикатора в методе Фаянса применяют адсорбционные индикаторы – флюоресцеин и тетрабромфлюоресцеин – эозин.
В точке эквивалентности наблюдается появление ярко-розового окрашивания осадка. Флюоресцеин и эозин представляют собой кислоты HInd, при диссоциации распадающиеся на ионы H + и Ind — . При титровании йодидов раствором AgNO3 в присутствии индикаторов образуется осадок AgI, адсорбирующий на себе другие ионы из растворов до точки эквивалентности согласно правилу Панета – Фаянса – Гана осадок AgI адсорбирует ионы I — , находящиеся в избытке, и приобретает отрицательный заряд AgI · nI — . Ионы Ind — адсорбироваться не могут, так как их одноименный заряд с частицами осадка препятствует этому.
При достижении точки эквивалентности ионы I — связываются в осадок AgI, и в растворе появляется избыток ионов Ag + . Осадок AgI адсорбирует их и приобретает положительный заряд AgI · m Ag + . Смена осадком заряда приводит к адсорбции на нем ионов индикатора AgI · m Ag + · Ind — и появлению розовой окраски. Эозин нельзя применять при титровании хлоридов.
Он представляет собой более сильную кислоту, чем флюоресцеин, адсорбируется на AgCl раньше Cl — , и осадок с начала титрования приобретает розовый цвет. Эозин используют при титровании только бромидов и йодидов. Титрование по методу Фаянса проводится в нейтральной и слабокислой среде. В щелочной среде вести анализ нельзя вследствие образования AgOH.
I — + AgNO3 → AgI + NO 3 —
до т.э. n · mI — (m-n)Ag + > x xAg +
после т.э. n · mInd (m-n)Ind> x+ xInd —
Метод Кольтгофа является методом прямого аргентометрического титрования. Используют обычно для определения йодидов в присутствии хлоридов и бромидов. Суть метода заключается в том, что осадок йодида серебра менее растворим, чем хлориды и бромиды серебра и поэтому выпадает в осадок в первую очередь. Для фиксирования точки эквивалентности к исследуемому раствору прибавляют раствор калия йодата, кислоту серную разведенную и крахмал
Раствор медленно, тщательно перемешивая, титруют 0,1М раствором серебра нитрата до перехода синей окраски в желтую, обусловленную цветом осадка серебра йодида. В процессе титрования в растворе уменьшается концентрация калия йодида, равновесие смещается влево, уменьшается концентрация йода, и синяя окраска исчезает. Возможность определения йодидов в присутствии остальных галогенидов достигается потому, что в растворе образуется буферная смесь, поддерживающая значение рН ‹ 5,5. Бромиды в этих условиях не окисляются йодатом калия при его незначительной концентрации.
В точке эквивалентности из раствора исчезают йодид-ионы, что сопровождается исчезновением синего окрашивания.
Определению йодидов по методу Кольтгофа не мешают хлориды. При наличии бромидов необходимо до прибавления серной кислоты прилить к реакционной смеси 5 мл 10% раствора карбоната аммония.
Другим методом прямого аргентометрического титрования является метод Шика (с внешним индикатором – нитрозо-крахмальной бумагой).
К анализируемому раствору приливают 4-5 мл воды, 5 мл разведенной серной кислоты и титруют раствором нитрата серебра. Индикатор – нитрозокрахмальная бумага (полоска фильтровальной бумаги, пропитанная смесью растворов нитрата натрия и крахмала). При нанесении на ее поверхность капли раствора до момента эквивалентности бумага окрашивается в синий цвет вследствие протекания реакции
При титровании серебра нитратом, когда йод-ионы удаляются из системы, происходит обесцвечивание крахмала.
Цвет бумаги не изменится после достижения точки эквивалентности. Для получения более точных результатов целесообразно предварительно рассчитать количество титровального раствора нитрата серебра, необходимого для титрования взятого количества йодидов, или выполнить ориентировочное титрование, а затем при повторном титровании иметь в виду результаты расчетов.
Воспользуйтесь поиском по сайту:

studopedia.org — Студопедия.Орг — 2014-2023 год. Студопедия не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования (0.006 с) .
Источник: studopedia.org
Определение содержания соли методом Мора.
Определение соли методом Мора основано на реакции обмена между хлористым натрием и азотнокислым серебром в присутствии индикатора хромата калия, в результате чего в нейтральном растворе после осаждения всех ионов хлора образуется кирпично-красный осадок.
Техника определения:
В химический стакан на 100 мл взвесьте 20 г измельченной пробы, прибавьте небольшое количество дистиллированной воды и тщательно размешайте стеклянной палочкой. Полученную смесь количественно перенесите в мерную колбу на 250 мл, долейте до 3/4 ее объема дистиллированной водой, закройте пробкой. Содержимое колбы тщательно перемешайте и поставьте на 30 минут для настаивания. После этого долейте колбу до метки дистиллированной водой, закройте пробкой, тщательно перемешайте и профильтруйте через сухой складчатый фильтр в чистую колбу на 200 мл.

где V — объем раствора азотнокислого серебра, израсходованного на титрование, мл;
n — количество хлористого натрия, соответствующее I мл раствора азотнокислого серебра (для 0,05 н = 0,0029; для 0,1 н = 0,00585), г;
К — поправочный коэффициент точно на 0,05 н или 0,1 н раствора АgNО3;
V1- объем вытяжки, взятой для титрования, мл;
V2 — количество дистиллированной воды, взятой для настаивания, мл.
Экспериментальный раздел
Определение органолептических показателей.
Определение массы блюда.
Взвешивание блюда “Ризотто по-итальянски” на весах марки ВНЦ- 10 показало, что m =270 г.
Вывод: Взвешивание блюда “Ризотто по-итальянски” показало, что m =270 г., что соответствует норме выхода блюда, равной 270г, установленной нормативно технической документацией, отклонения от рецептуры составляет 0 г., 0%.
Органолептическая оценка блюд.
| Показатель | Количество баллов | Снижение | Количество баллов после снижения | Оценка |
| Внешний вид | 5 | 5 | ||
| Цвет | 5 | 1 | 4 | |
| Консистенция | 5 | 1 | 4 | |
| Запах | 5 | 5 | ||
| Вкус | 5 | 5 | ||
| Сумма баллов | 5 | 23 | отлично |
Внешний вид блюда не имеет дефектов и соответствует продукции высокого качества. Данный показатель получил 5 баллов
Цвет блюда бледный, не выразительный. За данный дефект снимается 1 балл, в итоге за цвет блюдо получило 4 балла из возможных 5.
Такой показатель как консистенция получил 4 балла из пяти возможных, 1 балл снимается за то, что рис неравномерно разварен и имеются не достаточно разваренные рисовые зерна.
Вкус выразительный, слегка пряный, не имеет дефектов и соответствует продукции высокого качества. Вкус за не имением дефектов получает 5 баллов.
Запах выразительный, пряный, соответствующий данному блюду, не имеет дефектов и получает 5 баллов.
Вывод: блюдо получило оценку отлично, набрав 23 балла. По одному баллу снижено было за цвет и консистенцию, т.к. цвет блюда был не выразительным и рис был не равномерно разварен. Причиной данных дефектов является нарушения технологического процесса, такие как недостаточное по времени пассерование лука, недостаточная обжарка риса, не соблюдение температурного режима.
Рекомендации: следует строго соблюдать температурный режим и технологию приготовления блюда.
Определение физико-химических показателей.
Подготовка образцов к анализу.
Среднюю пробу блюда взвешиваем, разогреваем до 65-70 С и гомогенизируем в течении 3 минут с добавлением воды в количестве 150 г. Подготовленная проба переносится в склянку с притертой пробкой.
3.2.2. Определение содержания сухих веществ методом высушивания (ускоренный метод).

X= (c-a) * 100%,
где а – масса чашки с песком и палочкой, г;
b – масса чашки с навеской, песком и палочкой до высушиваения, г.
с — масса чашки с навеской, песком и палочкой после высушивания,г

X= x100% =27,12%
Количество экспериментально определенных сухих веществ в порции блюда составляет 113,36 г.
Вывод: экспериментально определенное значение содержания сухих веществ в количестве 113,36г в блюде “Ризотто по-итальянски” соответствует теоретически установленной норме количества сухих веществ в данном блюде, находящейся в пределах от 109,86 до 113,49, что свидетельствует о том, что сырьё вложено в соответствии с нормами, установленными нормативно технической документации.
Рекомендации: строгое соблюдение норм вложения сырья, строгое соблюдение технологического процесса.


Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ — конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой.

Папиллярные узоры пальцев рук — маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни.

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого.
Источник: cyberpedia.su