Функция доступна в рамках тарифа «Старт+». Приобретите подписку на 1 месяц и пользуйтесь сервисом без ограничений. Подробнее.
Скачать документ
Добавление закладки
Функция доступна в рамках тарифа «Старт+». Приобретите подписку на 1 месяц и пользуйтесь сервисом без ограничений. Подробнее.
Поделиться ссылкой
Функция доступна в рамках тарифа «Старт+». Приобретите подписку на 1 месяц и пользуйтесь сервисом без ограничений. Подробнее.
Добавление в избранное
Функция доступна в рамках тарифа «Старт+». Приобретите подписку на 1 месяц и пользуйтесь сервисом без ограничений. Подробнее.
Определение хлоридов методом потенциометрического титрования
Juice products. Determination of chlorides by potentiometric titration method
Дата введения 2016-07-01
Цели, основные принципы и основной порядок проведения работ по межгосударственной стандартизации установлены
ГОСТ 1.0-92 «Межгосударственная система стандартизации. Основные положения» и
Потенциометрическое титрование практикум
ГОСТ 1.2-2009 «Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, применения, обновления и отмены»
Сведения о стандарте
1 РАЗРАБОТАН Некоммерческой организацией «Российский союз производителей соков» (РСПС)
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии (Росстандарт)
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 27 августа 2015 г. N 79-П)
За принятие голосовали:
Краткое наименование страны по
МК (ИСО 3166) 004-97
МК (ИСО 3166) 004-97
Сокращенное наименование национального органа по стандартизации
Минэкономики Республики Армения
Госстандарт Республики Беларусь
Госстандарт Республики Казахстан
Приказом Федерального агентства по техническому регулированию и метрологии от 4 сентября 2015 г. N 1281-ст межгосударственный стандарт ГОСТ 33437-2015 введен в действие в качестве национального стандарта Российской Федерации с 1 июля 2016 г.
5 ВВЕДЕН ВПЕРВЫЕ
Информация об изменениях к настоящему стандарту публикуется в ежегодном информационном указателе «Национальные стандарты», а текст изменений и поправок — в ежемесячном информационном указателе «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячном информационном указателе «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет
1 Область применения
Настоящий стандарт распространяется на фруктовые и овощные соки, нектары и сокосодержащие напитки, фруктовые и овощные концентрированные соки, пюре и концентрированные пюре, морсы и концентрированные морсы (далее — соковая продукция) и устанавливает потенциометрический метод определения (измерения) массовой концентрации хлорид-ионов.
Потенциометрический принцип измерения рН
Диапазон измерения массовой концентрации хлорид-ионов — от 1·10
включительно.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие межгосударственные стандарты:
ГОСТ 8.315-97 Государственная система обеспечения единства измерений. Стандартные образцы состава и свойств веществ и материалов. Основные положения
ГОСТ 12.1.004-91 Система стандартов безопасности труда. Пожарная безопасность. Общие требования
ГОСТ 12.1.007-76 Система стандартов безопасности труда. Классификация и общие требования безопасности
ГОСТ 12.1.018-93 Система стандартов безопасности труда. Пожаровзрывобезопасность статического электричества. Общие требования
ГОСТ 12.1.019-79 * Система стандартов безопасности труда. Электробезопасность. Общие требования и номенклатура видов защиты
* В Российской Федерации действует
ГОСТ Р 12.1.019-2009 «Система стандартов безопасности труда. Электробезопасность. Общие требования и номенклатура видов защиты».
ГОСТ OIML R 76-1-2011 Государственная система обеспечения единства измерений. Весы неавтоматического действия. Часть 1. Метрологические и технические требования. Испытания
ГОСТ 1277-75 Серебро азотнокислое. Технические условия
ГОСТ 1770-74 (ИСО 1042-83, ИСО 4788-80) Посуда мерная лабораторная стеклянная. Цилиндры, мензурки, колбы, пробирки. Общие технические условия
ГОСТ ISO 3696-2013* Вода для лабораторного анализа. Технические требования и методы испытаний
* В Российской Федерации действует
ГОСТ Р 52501-2005 «Вода для лабораторного анализа. Технические условия».
ГОСТ 4233-77 Реактивы. Натрий хлористый. Технические условия
ГОСТ 4461-77 Реактивы. Кислота азотная. Технические условия
ГОСТ 4919.1-77 Реактивы и особо чистые вещества. Методы приготовления растворов индикаторов
ГОСТ ИСО 5725-1-2003* Точность (правильность и прецизионность) методов и результатов измерений. Часть 1. Основные положения и определения
* В Российской Федерации действует
ГОСТ Р ИСО 5725-1-2002 «Точность (правильность и прецизионность) методов и результатов измерений. Часть 1. Основные положения и определения».
ГОСТ ИСО 5725-6-2003* Точность (правильность и прецизионность) методов и результатов измерений. Часть 6. Использование значений точности на практике
* В Российской Федерации действует
ГОСТ Р ИСО 5725-6-2002 «Точность (правильность и прецизионность) методов и результатов измерений. Часть 6. Использование значений точности на практике».
ГОСТ ИСО/МЭК 17025-2009 Общие требования к компетентности испытательных и калибровочных лабораторий
ГОСТ 25336-82 Посуда и оборудование лабораторные стеклянные. Типы, основные параметры и размеры
ГОСТ 25794.2-83 Реактивы. Методы приготовления титрованных растворов для окислительно-восстановительного титрования
ГОСТ 26313-2014 Продукты переработки фруктов и овощей. Правила приемки и методы отбора проб
ГОСТ 26671-2014 Продукты переработки фруктов и овощей, консервы мясные и мясорастительные. Подготовка проб для лабораторных анализов
ГОСТ 29227-91 (ИСО 835-1-81) Посуда лабораторная стеклянная. Пипетки градуированные. Часть 1. Общие требования
Примечание — При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодному информационному указателю «Национальные стандарты», который опубликован по состоянию на 1 января текущего года, и по выпускам ежемесячного информационного указателя за текущий год. Если ссылочный стандарт заменен (изменен), то при пользовании настоящим стандартом следует руководствоваться заменяющим (измененным) стандартом. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, применяется в части, не затрагивающей эту ссылку.
3 Сущность метода
Метод основан на определении содержания хлорид-ионов потенциометрическим титрованием азотнокислым серебром с ионоселективным электродом в присутствии фонового электролита (азотной кислоты). Конечную точку титрования определяют по перегибу на кривой титрования, который находят графическим или расчетным методом.
4 Средства измерений, вспомогательное оборудование, посуда и реактивы
Весы неавтоматического действия по
ГОСТ OIML R 76-1 с пределом допускаемой погрешности однократного взвешивания ±0,005 г.
Титратор, с функцией потенциометрического титрования, в комплекте с рХ-метром (иономером), с диапазоном измерений активности от минус 20,00 до 20,00 ед. рН(рХ) (потенциала от минус 2000,0 до 2000,0 мВ) и основной относительной погрешностью титрования ±1,0%.
Электрод хлорид-селективный* с кристаллической мембраной, с диапазоном измерения от 3·10
(от 0,22 до 3,5 pCI).
* Например, электроды типа ЭЛИС-131Сl или ЭМ-Сl-01. Данная информация является рекомендуемой, приведена для удобства пользователей настоящего стандарта и не исключает возможность использования других типов электродов с аналогичными характеристиками.
Электрод сравнения одноключевой хлорсеребряный (Ag/AgCI) с потенциалом (200±5) мВ относительно н.в э.* и электрическим сопротивлением от 2 до 20 кОм при температуре (20±0,5)°С.
* Электродом сравнения служит нормальный водородный электрод (н.в.э.), потенциал которого принимается равным нулю при любой температуре.
Рабочий эталон активности хлорид-ионов с пределами допускаемой абсолютной погрешности ±0,01 pCI.
Государственные (межгосударственные) стандартные образцы состава хлорид-ионов по
ГОСТ 8.315 с границами допускаемой относительной погрешности аттестованного значения ±1% при Р =0,95.
Секундомер механический любого типа.
Пипетки градуированные 1-2-1-5, 1-2-1-10 по
Цилиндры мерные 1-100-2, 1-250-2 по
Колбы мерные 1-100-2, 1-250-2, 1-1000-2 по
Стаканы низкие Н-1-250 по
Серебро азотнокислое по
Источник: gostassistent.ru
ГОСТ 16321.1-70 Серебряно-медные сплавы. Метод определения содержания серебра
Текст ГОСТ 16321.1-70 Серебряно-медные сплавы. Метод определения содержания серебра
ГОСУДАРСТВЕННЫЙ СТАНДАРТ СОЮЗА ССР
Метод определения содержания серебра
Silver-copper alloys. Method for determination of silver content
Дата введения 1972-01-01
Постановлением Комитета стандартов, мер и измерительных приборов при Совете Министров СССР от 26. VIII 1970 г. N 1328 срок введения установлен с 01.01.72
Проверен в 1985 г. Постановлением Госстандарта от 26.02.85 N 383 срок действия продлен до 01.01.91**
** Ограничение срока действия снято по протоколу N 5-94 Межгосударственного Совета по стандартизации, метрологии и сертификации (ИУС N 11/12, 1994 год). — .
ВЗАМЕН ГОСТ 7979-56 в части разд.II
* ПЕРЕИЗДАНИЕ (июль 1986 г.) с Изменениями N 1, 2, утвержденными в августе 1980 г., феврале 1985 г. (ИУС 10-80, 5-85).
Настоящий стандарт распространяется на серебряно-медные сплавы и устанавливает потенциометрический метод определения содержания серебра (при массовой доле серебра от 49,5 до 97,3%).
Метод основан на потенциометрическом титровании иона серебра раствором хлористого натрия с применением блока автоматического титрования. В качестве электрода сравнения применяют хлорсеребряный электрод, заполненный насыщенным раствором азотнокислого калия. Индикаторным электродом служит серебряная проволока.
(Измененная редакция, Изм. N 2).
1. ОБЩИЕ ТРЕБОВАНИЯ
1.1. Общие требования к методу анализа — по ГОСТ 22864-83.
2. АППАРАТУРА, РЕАКТИВЫ И РАСТВОРЫ
Кислота азотная по ГОСТ 4461-77 и разбавленная 1:1.
Серебро по ГОСТ 6836-80* марки Ср 999,9.
* На территории Российской Федерации действует ГОСТ 6836-2002. — .
Бюретка с автоматической установкой нуля вместимостью 50 см.
Блок автоматического титрования лабораторный.
Натрий хлористый, 0,1 н. раствор; готовят из фиксанала 0,1 г·экв. При отсутствии фиксанала растворяют в воде 5,85 г хлористого натрия по ГОСТ 4233-77 и доводят объем до 1 дм водой.
Титр 0,1 н. раствора хлористого натрия устанавливают следующим образом: навеску серебра 0,45 г (берут три параллельных навески) помещают в стакан вместимостью 250 см, растворяют при нагревании в 10 см азотной кислоты, разбавленной 1:1, нагревают до удаления окислов азота и разбавляют водой до 100 см. Раствор титруют, как указано в разд.4.
3. ПОДГОТОВКА К АНАЛИЗУ
Навеску 0,5 г (берут три параллельных навески) помещают в стакан вместимостью 250 см, растворяют при нагревании в азотной кислоте, разбавленной 1:1. Раствор нагревают до удаления окислов азота и разбавляют водой примерно до 100 см.
(Измененная редакция, Изм. N 2).
4. ПРОВЕДЕНИЕ АНАЛИЗА
4.1. Подготовленный для анализа раствор титруют потенциометрическим методом 0,1 н. раствором хлористого натрия до заданной разности потенциалов на блоке автоматического титрования.
(Измененная редакция, Изм. N 1).
5. ПОДСЧЕТ РЕЗУЛЬТАТОВ АНАЛИЗА
5.1. Массовую долю серебра () в процентах вычисляют по формуле
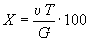
,
где — количество 0,1 н. раствора хлористого натрия, израсходованное на титрование, см;
— титр раствора хлористого натрия по серебру, г/см;
5.2. Абсолютные допускаемые расхождения результатов параллельных определений при доверительной вероятности 0,95 не должны превышать 0,10% — при массовой доле серебра от 49,5 до 80,0% и 0,15% — при массовой доле серебра свыше 80,0%.
(Измененная редакция, Изм. N 2).
Электронный текст документа
Методы анализа: Сб. ГОСТов. —
М.: Издательство стандартов, 1986
Источник: allgosts.ru
Потенциометрическое титрование по методу осаждения
Метод осаждения основан на применении при титровании реакций, сопровождающихся образованием каких-либо трудно растворимых соединений.
При этом предпочтение следует отдавать реакциям, отвечающим следующим условиям:
- образующийся осадок должен быть практически нерастворим
- выпадение осадка должно происходить достаточно быстро (т.е. не должно сказываться явление образования пересыщенных растворов)
- результаты титрования не должны в заметной степени искажаться явлениями адсорбции (соосаждения)
- должна существовать возможность фиксировать точку эквивалентности при титровании.
Отмеченные требования сильно ограничивают круг реакций, практически используемых в титриметрическом анализе.
Наиболее важное значение имеют методы, основанные на реакциях осаждения трудно растворимых солей серебра, протекающих по уравнению:
где через Х — обозначены анионы, дающие осадки с катионом Ag + .
Для установления точки эквивалентности при титровании рабочим раствором азотнокислого серебра используются различные методы:
- безиндикаторный метод (Гей-Люссака)
- с применением индикаторов (метод Мора, метод Фольгарда)
- метод потенциометрической индикации точки эквивалентности.
Потенциометрическое титрование по методу осаждения основано на измерении величины разности потенциалов между индикаторным электродом и электродом сравнения в любой момент титрования, построения кривой титрования и установления из нее объема титранта, затраченного до точки эквивалентности.
В качестве индикаторных электродов используется металлические электроды второго рода, численное значение потенциала которых определяется концентрацией аниона, способного образовывать трудно растворимое соединение с ионами металла электрода.
Величина потенциала серебряного электрода, покрытого слоем осадка хлорида серебра, определяется соотношением:
и зависит от концентрации хлорид-иона в анализируемом растворе.
В качестве электродов сравнения чаще всего используются вторичные электроды сравнения, изготовленные на основе металлических электродов второго рода. При этом особое внимание следует обращать на состав внутреннего раствора электрода сравнения: он не должен содержать определяемые анионы. Именно по этой причине, при использовании хлорсеребряного электрода сравнения в качестве внутреннего раствора вместо насыщенного раствора хлорида калия используется 1М раствор сульфата аммония.
Потенциометрическое определение галогенид-ионов
при совместном присутствии
Поскольку величины произведения растворимости трудно растворимых соединений различных галогенид-ионов с катионом серебра существенно различаются, существует возможность количественного определения каждого из галогенидов при их совместном присутствии в анализируемом растворе.
Поскольку величина произведения растворимости иодида серебра
ПРAgI = 8.3 10 -17 значительно меньше величины произведения растворимости хлорида серебра ПРAgCl = 1.8 10 -10 , прибавление в анализируемый раствор, содержащий эти анионы, первыми начинают осаждаться иодид-ионы.
Переход только иодид-ионов в осадок будет происходить до тех пор, пока концентрация прибавляемых катионов серебра в анализируемом растворе не станет достаточной для осаждения хлорид ионов. Величина этой концентрации рассчитывается из величины произведения растворимости:
С другой стороны, концентрация ионов серебра в растворе над осадком иодида серебра определяется соотношением:
В момент завершения процесса осаждения иодид-иона и начала процесса осаждения хлорид-иона, величина концентрации ионов серебра в анализируемом растворе должна удовлетворять каждому из приведенных уравнений. В соответствии с отмеченным, будет справедливо уравнение:
Последнее уравнение позволяет рассчитать соотношение концентраций хлорид- и иодид-ионов в растворе, при котором начинается их совместное осаждение:
Таким образом, если в анализируемом растворе исходная концентрация хлорид-ионов составляет 0.01 г-ион/л, то процесс совместного осаждения хлорид- и иодид-ионов начнется только тогда, когда концентрация иодид-ионов составит величину:
Поскольку соединение считается практически полностью переведенным в осадок, если его концентрация в растворе над осадком меньше величины 10 -6 моль/л, в момент начала осаждения хлорид-иона, иодид-ионы анализируемого раствора находятся в осадке.
Величина потенциала индикаторного электрода, а следовательно и измеряемая величина разности потенциалов индикаторного электрода и электрода сравнения, в процессе титрования иодид-иона определяется только величиной концентрации иодид-иона в растворе до полного его перевода в осадок.
Затем величина потенциала индикаторного электрода, а следовательно и измеряемая величина разности потенциалов индикаторного электрода и электрода сравнения, будут определяется уже только величиной концентрации хлорид-иона в растворе.
Таким образом, на кривой потенциометрического титрования регистрируются два скачка, первый из которых соответствует процессу титрования иодид-иона, а второй – процессу титрования хлорид иона.
При выполнении титрования следует учитывать следующее. В начале процесса титрования иодид-ионов численное значение величины потенциала электрода сравнения оказывается больше, чем величина потенциала индикаторного электрода. В этой связи измеряемая разность величин потенциалов индикаторного электрода и электрода сравнения оказывается в области отрицательных значений. В ходе дальнейшего титрования иодид-ионов, а также в ходе процесса титрования хлорид-ионов, измеряемая разность потенциалов принимает положительные значения.
В этой связи следует своевременно произвести операцию переключения потенциометра в соответствующий режим измерения.
Определение величины произведения растворимости трудно растворимых соединений по результатам потенциометрического титрования
В точке эквивалентности при титровании галогенид-иона катионом серебра анализируемый раствор будет содержать осадок состава AgX в равновесии с насыщенным раствором этого же соединения. При этом равновесные концентрации галогенид-иона и иона серебра будут равны между собой и определяются величиной произведения растворимости:
Величина измеряемого в точке эквивалентности потенциала системы рассчитывается из соотношения:
где — наклон электродной функции в координатах Е – рС.
Последнее уравнение позволяет рассчитать величину произведения растворимости трудно растворимого соединения AgX в используемом растворителе, если известны величины потенциала системы в точке эквивалентности Еэ, стандартный потенциал Ео и наклон электродной функции .
Для установления величины наклона электродной функции следует выбрать на кривой потенциометрического титрования две точки, находящиеся на кривой до точки эквивалентности и характеризующиеся величинами потенциалов Е1 и Е2, численные значения которых различаются не менее, чем на 30 мВ.
Величины потенциалов системы в этих точках определяются соотношениями:
где и — концентрации галогенид-иона в выбранных точках 1 и 2, численные значения которых рассчитываются по правилу эквивалентов.
Тогда из соотношения:
можно рассчитать численное значение величины наклона электродной функции , которое позволяет рассчитать величину стандартного потенциала Ео, при известных Е1 и [X — 1].
И, наконец, используя соотношение:
рассчитывается величина произведения растворимости соединения AgX в используемом растворителе.
Источник: studfile.net