Документ из архива «Методы определения содержания свинца, цинка, серебра в питьевой воде», который расположен в категории » «. Всё это находится в предмете «химия» из , которые можно найти в файловом архиве . Не смотря на прямую связь этого архива с , его также можно найти и в других разделах. Архив можно найти в разделе «книги и методические указания», в предмете «химия» в общих файлах.
Онлайн просмотр документа «165896»
Текст из документа «165896»
- Сущность метода
Метод основан на образовании (при рН 7,0—7,3) соединения свинца с сульфарсазеном (плюмбоном), окрашенного в желто-* оранжевый цвет. Свинец предварительно экстрагируется дитизоном в четыреххлористом углероде (при рН 9,2—9,6). Образовавшийся дитизонат свинца разрушается соляной кислотой. При этом ионы свинца переходят в водный раствор, в котором определяется свинец.
Чувствительность метода составляет (объем исследуемой воды 1000 см 3 ) — 0,5 мкг.
Проверка на содержание серебра часть 2
- Аппаратура, материалы и реактивы
Фотоэлектроколориметр (ФЭК); кюветы с толщиной слоя 2 см. Эксикатор по ГОСТ 25336—82.
Колба для перегонки по ГОСТ 25336—82.
Стеклянный аппарат с дефлегматором для перегонки органических растворителей.
Фильтры беззольные (белая лента) диаметром 5; 7 см.
Посуда мерная стеклянная лабораторная по ГОСТ 1770—74, ГОСТ 20292—74 вместимостью: колбы мерные 100, 500, 1000 см 3 , пипетки 1,5 см 3 с делениями 0,01 и 0,1 см 3 ; цилиндры измерительные 10, 25, 100, 500 и 1000 см 3 с притертыми пробками.
Пробирки колориметрические вместимостью 15 см 3 по ГОСТ 25336—82.
Воронки делительные 50, 200 см 3 по ГОСТ 25336—82.
Капельница стеклянная лабораторная по ГОСТ 25336—82.
Воронки стеклянные типа I по ГОСТ 25336—82.
Пробирки с притертыми пробками вместимостью 10 см 3 по ГОСТ 25336—82.
Пробирки с оттянутым концом.
Стаканчики для взвешивания (бюксы) по ГОСТ 25336—82.
Аммиак водный по ГОСТ 3760—79, 25%-ный раствор.
Гидроксиламен солянокислый по ГОСТ 5456—79.
Дитизон (дифенитиокарбазон) по ГОСТ 10165—79.
Вода дистиллированная по ГОСТ 6709—72.
Натрия гидроокись по ГОСТ 4328—77.
Натрий лимоннокислый по ГОСТ 22280—76.
Натрий углекислый кристаллический по ГОСТ 84—76.
Натрий тетрабориокислый (бура) по ГОСТ 4199—76.
Калий-натрий виннокислый по ГОСТ 5845—79.
Калий железистосинеродистый по ГОСТ 4207—75.
Кальций хлористый кристаллический.
Кислота азотная по ГОСТ 4461—77
Кислота соляная по ГОСТ 3118—77. . Кислота аскорбиновая
Углерод четыреххлористый по ГОСТ 20288—74
Феноловый красный (фенолсульфофталеин)
Свинец азотнокислый по ГОСТ 4236—77
Вода дистиллированная по ГОСТ 6709—72
3.3 Подготовка к анализу
3.3.1 Приготовление основного стандартного раствора азотнокислого свинца.
0,160 г РЬ(NO3)2 ( высушенного до постоянной массы при 100—105°С, растворяют в мерной колбе вместимостью 1 дм 3 в небольшом количестве дистиллированной воды, подкисленной 0,5 см 3 азотной кислоты (1:5), и объем раствора доводят до метки дистиллированной водой. 1 см 3 этого раствора содержит 100 мкг. РЬ 2+ .
Перечистка серебра. Определение пробы серебра в контактах
3.3.2 Приготовление рабочего стандартного раствора азотнокислого свинца
Раствор готовится в день определения разбавлением основного раствора 1 :100.
В мерную колбу вместимостью 100 см 3 вносят 1 см 3 основного стандартного раствора Pb(N03)2 и доводят до метки 0,05 н раствором соляной кислоты. 1 см 3 этого раствора содержит 1 мкг РЬ 2+ .
3.3.3 Приготовление 3%-ного раствора аскорбиновой кислоты3 г аскорбиновой кислоты растворяют в дистиллированной воде
и доводят объем до 100 см 3 . Необходимо применять свежеприготовленный раствор.
3.3.4 Приготовление 20 %-ного раствора солянокислого гидроксиламина
20 г солянокислого гидроксиламина растворяют в 50 см 3 дистиллированной воды. Прибавляют 3—4 капли 0,1 %-ного раствора фенолового красного и очищенного аммиака до появления розовой окраски. Очищают от свинца взбалтыванием раствора в делительной воронке с порциями по 10 см 3 0,01 %-ного раствора дитизона в четыреххлористом углероде до тех пор, пока зеленая окраска не перестанет изменяться. Избыток дитизона удаляют встряхиванием раствора с чистым четыреххлористым углеродом (порциями по 10 см 3 ) до тех пор, пока четыреххлористый углерод не будет бесцветным. После этого к раствору гидроксиламина прибавляют очищенную соляную кислоту (1:1) до появления желтой окраски и доводят объем раствора очищенной дистиллированной водой до 100 см 3 .
3.3.5 Приготовление 0,01 %-ного раствора дитизона в четыреххлористом углероде
Навеску 0,050 г очищенного дитизона растворяют в очищенном четыреххлористом углероде в мерной колбе вместимостью 500 см 3 . После растворения дитизона раствор в колбе доводят четыреххлористым углеродом до метки.
3.3.6 Приготовление 10 и 1 %-ного раствора углезистосинеродистого калия
10 г KаFe (CN)6-3H20 растворяют в 90 см 3 очищенной дистиллированной воды. 1%-ный раствор готовят разведением 10%-ного раствора в 10 раз. Необходимо применять свежеприготовленные растворы.
3.3.7 Приготовление 1 г раствора хлористого кальция растворяют в очищенной дистиллированной воде в мерной колбе вместимостью 1 дм 3 и доводят объем водой до метки.
3.3.8 Приготовление 25%-ного раствора гидроокиси натрия 25 г NaOH растворяют в 75 см 3 очищенной дистиллированной воды
3.3.9. Приготовление 1 н раствора углекислого натрия 53 г Na2CС и 143 г Na2CO3-10H2O x. ч. растворяют в очищенной дистиллированной воде в мерной колбе вместимостью 1 дм 3 и доводят объем до метки
3.3.10 Приготовление 0,05 М раствора тетраборнокислого натрия (бура)
19,07 г перекристаллизованной буры Na2B407-10Н2О растворяют в мерной колбе вместимостью 1 дм 3 в небольшом количестве очищенной дистиллированной воды и доводят объем до метки
3.3.11 Приготовление 33%-ного раствора виннокислого калия – натрия 50 г виннокислого калия-натрия растворяют в 100 см 3 дистиллированной воды. Для удаления свинца раствор взбалтывают в делительной воронке, с порциями по 10 см 3 0,01%-ного раствора дитизона в четыреххлористом углероде до тех пор, пока зеленая окраска дитизона не перестанет изменяться. Избыток дитизона удаляют встряхиванием раствора с чистым четыреххлористым углеродом (порциями по 10 см 3 ) до тех пор, пока четыреххлористый углерод не станет бесцветным
Источник: studizba.com
Определение содержания хлоридов в воде.
Хлориды в воде определяются путем их осаждения азотнокислым серебром (AgNO3)с образованием белого осадка хлористого серебра (AgCl), нерастворимого в азотной кислоте и растворимого в аммиаке и других едких щелочах.
Азотнокислое серебро осаждает также углекислые и фосфорнокислые соли, образуя такой же белый осадок, как и с солями хлора. Поэтому углекислые и фосфорнокислые соли надо предварительно исключить из реакции, что достигается прибавлением азотной кислоты, в которой они растворяются.
Методика определения
Для определения хлоридов 1/3 пробирки заполняют испытуемой воды, подкисляют 2-3 каплями азотной кислоты и затем добавляют несколько капель 10% азотнокислого серебра. В присутствии небольшого количества хлоридов образуется белая муть или легкая опалесценция, при значительном же количестве образуется белый творожистый осадок.
Количественное определение хлоридов
Посуда:
1. колба на 50-100 мл;
Реактивы:
1. индикатор – 10% раствор хромовокислого калия (К2СrO4);
2. титрованный раствор азотнокислого серебра (AgNO3), 1 мл которого может осадить 1 мг хлора.
Принцип метода
Содержание хлоридов в воде вычислят по количеству израсходованного раствора азотнокислого серебра. В качестве индикатора применяют хромовокислый калий К2СrO4, который начинает вступать в реакцию с азотнокислым серебром лишь после осаждения всех хлористых солей; после этого лишняя капля прилитого раствора азотнокислого серебра даст в соединении с хромовокислым калием хромовокислое серебро Ag2СrO4, в связи с чем желтоватый цвет титруемой жидкости изменится в красноватобурый, что и будет служить показателем конца осаждения хлоридов Методика определения:
В колбу наливают 10 исследуемой воды, добавляют 1-2 капли 10% раствора К2СrO4 и прибавляют по каплям титрованный раствор AgNO3 из бюретки, до изменения цвета (с желтого в кирпично-красный). Считают количество капель, израсходованных на титрование.
Расчет содержания хлоридов в воде производится по формуле:
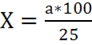
(мг),

где a — число капель раствора AgNO
Источник: helpiks.su
Определение содержания анионов в поверхностных водах





В поверхностных водах, кроме анионов HCO3 — , СО3 2- , OН — , которые определялись в предыдущих работах, содержится ряд других анионов (SO4 2- , Cl — , HSiO3 — , NO3 — , PO4 3- и др.).
Хлориды по общему содержанию в природных водах занимают первое место среди анионов. Они появляются в природных водах при растворении горных пород, содержащих хлориды, выбрасываются в большом количестве при извержении вулканов, являются постоянным компонентом стоков многих предприятий. Содержание их колеблется от десятых долей до тысячи мг/л. Однако в воде рек концентрация хлоридов невелика – она превышает обычно 10-30 мг/л, поэтому повышенное количество хлоридов указывает на загрязнение источника сточными водами. Концентрация хлорид-ионов не должна превышать для питьевой воды 350 мг/л.
Лимитирование верхнего предела концентраций SO4 2- и Cl — обусловлено тем, что более высокие концентрации этих ионов придают воде солоноватый вкус и могут вызвать нарушение в работе желудочно-кишечного тракта у людей. При некоторых соотношениях SO4 2- и Cl — вода становится агрессивной по отношению к некоторым типам бетона.
В природных водах кремниевая кислота может находиться в формах метакремниевой H2SiO3 (H2О·SiO2), ортокремниевой H4SiO4 (SiO2·2H2О) и поликремниевой H2SiO5 (2SiO2·H2О) кислот. Все эти кислоты при обычных для природных вод значениях рН малорастворимы и образуют в воде коллоидные растворы. Силикаты – нежелательная примесь в воде, питающей котлы, так как дает силикатную накипь на стенках котлов.
Под эвтрофикацией вод понимают обогащение их биогенными элементами (азотом, фосфором, углеродом или веществами, их содержащими); следствие эвтрофикации – интенсивный рост водорослей и других растений, накопление в водоемах органических веществ и других продуктов отмирания организмов. Это создает условия дляувеличения численности организмов-редуцентов, питающихся мертвым органическим веществом и разлагающих его до исходных минеральных элементов и СО2.
Редуценты в процессе жизнедеятельности интенсивно поглощают кислород. Конечный результат явлений – обескислороживание водной среды и замена аэробных (с участием кислорода) процессов на анаэробные, протекающие в бескислородной среде. Результат анаэробных процессов – выделение в среду сероводорода, метана и других ядовитых загрязняющих веществ.
Таким образом, обогащение вод необходимыми для жизни химическими элементами вызывает вторичный крайне отрицательный экологический и санитарно-гигиенический эффект. Явление вызывается природными и антропогенными факторами. Различия в их действии связаны не только с интенсивностью, но и с механизмом отдельных процессов. При эвтрофикации развиваются сине-зеленые водоросли, многие из которых ядовиты. Выделяемые ими вещества относятся к группе фосфор- и серосодержащих органических соединений (нервнопаралитических ядов).
Природная эвтрофикация прoтекает как правило, медленно и зависит от минералогического состава пород и грунтов, окружающих водоемы.
Водоемы с большими запасами воды и расположенные среди кристаллических пород мало подвержены эвтрофикации. Они в течение тысячелетий могут оставаться в олиготрофиом (бедном питательными веществами) состоянии. Пример такого водоема – озеро Байкал. Медленная эвтрофикация характерна также для озер ледникового происхождения. Это основные резервуары озерной чистой воды.
Такие водоемы вместе с тем в силу малой насыщенности жизнью и низких температур имеют слабую способность к самоочищению. Поэтому они весьма чувствительно реагируют на загрязнения.
Антропогенной эвтрофикации в настоящее время подвержены практически все внутренние водоемы и некоторые моря. Факторами ее являются минеральные удобрения, а в ряде случаев моющие средства, компоненты которых – поверхностно-активные вещества (ПАВ), изготавливаемые на фосфорной основе. Источниками эвтрофикации вод являются также бытовые и промышленные стоки, животноводческие комплексы, подогретые воды, рекреационные воздействия, преобразования текущих вод в стоячие и другие результаты человеческой деятельности.
Оборудование: нитратомер ЭКО-01, нитратоселективный и хлорсеребряный электроды, пенал для определения фосфатного числа, бюретки для титрования, оловянная палочка.
Реактивы: 0,028 нраствор нитрата серебра, раствор хромовокислого калия, раствор сульфомолибдата аммония, раствор KNO3 − 0,1 н.
Порядок выполнения работы
Определение хлорид-ионов
Метод основан на титрометрическом осаждении хлоридов в нейтральной среде или слабощелочной среде нитратом серебра в присутствии бихромата калия в качестве индикатора.
В пробу воды объемом 100 мл добавляют 10 капель раствора хромово-кислого калия, хорошо перемешивают и оттитровывают раствором азотнонокислого серебра. Раствор титранта добавляют до тех пор, пока в воде не появится устойчивый бурый оттенок, свидетельствующий об образовании хромата серебра. Содержание хлорид-ионов в пробе воды составит, мг/л:
где V1 – объем раствора нитрата серебра, пошедшего на титрование, мл; N1 – нормальность раствора нитрата серебра; Э – миллиграм-эквивалент хлора; V2 – объем исследуемой воды.
Определение фосфатов
Сущность заключается в том, что сульфомолибдатный раствор, введенный в испытуемую пробу воды в присутствии погруженной с нее оловянной палочки, реагирует с фосфатами, в результате чего вода окрашивается в синий цвет, интенсивность которого тем больше, чем выше концентрация фосфатов в воде.
В мерную пробирку наливают 2 мл отфильтрованной пробы воды, доводят объем жидкости сульфомолибдатным раствором до 10 мл. Затем в раствор опускают очищенную наждачной бумагой и ополоснутую дистиллированной водой оловянную палочку. Через 5 мин (за это время раствор в пробирке вместе с оловянной палочкой должен быть 2. 3 раза перемешен легким встряхиванием) оловянную палочку вместе с пробкой вынимают из пробирки и сравнивают окраску испытуемого раствора с окраской стандартной цветной шкалы.
Для этого пенал, в котором находится штативчик с фосфатной шкалой, снимают с задней стенки лабораторного ящика, вынимают штативчик и в него вставляют (через верхнее отверстие) мерную пробирку так, чтобы она оказалась в специальном гнезде на фоне молочного стекла рядом с ячейками цветной шкалы.
Позади штативчика должен находиться источник света расположенный так, чтобы окраска исследуемого раствора сравнивалась с окраской штатной шкалы в рассеянном проходящем свете.
Фосфатное число воды соответствует цифре, стоящей против ячейки шкалы, окраска которой совпадает с окраской раствора в пробирке или наиболее близка к ней. Результаты определения выражены в виде концентраций фосфат ионов PO4 3- (мг/л). Фосфатную шкалу следует хранить в футляре. Она должна быть на свету только во время колориметрирования.
Определение нитратов
Определение нитратов проводят с помощью нитратомера, используя ионоселективный электрод.
Предварительной частью работы является подготовка нитратомера. Сначала электроды готовят к работе. Для этого внутрь хлорсеребряного электрода (вспомогательного) заливают насыщенный раствор KCl и выдерживают сутки в стакане с насыщенным раствором. Между испытаниями такой электрод хранят в дистиллированной воде.
Ионоселективный электрод ЭМ-NO3-01 заполняют после промывки при-электродным раствором, который содержит 10,11 г KNO3 и 0,37 г KCl на 1 л раствора. Выдерживают в растворе KNO3 с концентрацией 10 -1 моль/л в течение суток.
Приготовленные таким образом электроды готовы к работе. Их подключают в соответствующие гнезда прибора и производят калибровку системы. Для этого электроды сначала погружают в 10 -4 М раствор KNO3 и включают прибор нажатием кнопки «вкл». Затем нажимают кнопку «изм». ВНИМАНИЕ! Эту кнопку можно нажимать только в том случае, если электроды погружены в раствор.
С помощью регулировки ручек выставляется «0» на шкале прибора.
Отжать кнопку «изм» и перенести электроды, предварительно вымыв в дистилляте и высушив фильтровальной бумагой, в стандартный раствор с концентрацией 10 -3 М KNO3. Нажать кнопку «изм» и ручкой «крутизна» выставить значение 56 мВ (при нажатой кнопке «диап» шкала прибора соответствует 100 мВ, при отжатой – 200 мВ). Для проверки правильности калибровки перенести электроды в 10 -2 М раствор KNO3. Показания прибора должны соответствовать 112 мВ. Если показания не соответствуют 112 мВ, произвести повторную настройку прибора по растворам.
Требования к отчету
В отчете приводится описание хода выполнения работы, результаты расчета содержания анионов. Сделать предположение о характере подстилающих пород и поступающих стоков. Выявить последствия для водной экосистемы от избыточного поступления анионов.
Лабораторная работа № 7
⇐ Предыдущая Стр 6 из 17 Следующая ⇒
Не забудь поделиться страницей с друзьями:
Источник: infopedia.su