Химические связи — это силы, которые удерживают атомы в молекуле и кристалле. В зависимости от электроотрицательности химические связи бывают разные, и эти различия влияют на свойства веществ.
Химические связи
Из базового курса химии известно, что все вещества во Вселенной состоят из атомов и молекул. Возникает вопрос: что заставляет атомы держаться вместе, а не хаотично разлетаться в пространстве? Все дело в химических соединениях, которые удерживают частицы в определенных состояниях. Представьте себе два надувных шарика, которые свободно парят по воздуху.
Эти шарики никак не реагируют друг на друга, и даже если случайно столкнутся, то разойдутся в разные стороны. Но если шарикам придать полярные электрические заряды, то они начнут притягиваться.
Электрическое взаимодействие — одна из фундаментальных сил, которая удерживает частицы друг с другом. Опыт с шариками легко провести в реальности, так как для придания электрического заряда достаточно потереть шарики о шерстяные вещи или волосы. Но каким образом нейтральные атомы получают заряд в природе?
Определяем тип химической связи
Ионная связь
Все атомы, исключая инертные газы, стремятся получить или отдать электроны для формирования устойчивой 8-электронной оболочки. При «перетекании» заряженных частиц от одного атома к другому возникают устойчивые электронные конфигурации, а заряды притягиваются друг к другу, формируя ионную связь. Рассмотрим механизм связывания ионов на простом примере.
Натрий — активный метал, атом которого имеет электронную конфигурацию 2-8-1. Сера — активный неметалл, у которого электроны располагаются по схеме 2-8-6. Видно, что у атомов натрия и серы последние электронные орбиты неустойчивы, так как количество электронов на них не равно 8. Когда натрий и сера «встречаются», они образуют новое вещество — сульфид натрия:
В этой реакции натрий отдает электроны, а сера присоединяет по следующей схеме:
В результате перехода электронов от натрия к сере, натрий теряет электрон с последней орбиты, образуя 8-электронную оболочку на второй. Сера, наоборот, притягивает к себе 2 электрона, дополняя третью орбиту до полного 8-электронного комплекта. В итоге атомы сульфида натрия становятся стабильными, а само соединение — устойчивым.
В отличие от всех остальных атомов, благородные одноатомные газы исходно имеют 8-электронные устойчивые уровни, в результате чего и характеризуются высокой инертностью. Например, чтобы заставить гелий или неон вступить в химическую реакцию, потребуется искусственным образом ионизировать каждый атом. Все остальные элементы «охотно» вступают в реакции, дабы стабилизировать электронные орбиты.
Ковалентная связь
Помимо ионной связи, существует ковалентная связь, которая возникает при формировании общих электронных пар. Сами же электронные пары образуются при наложении электронных облаков двух атомов. Рассмотрим принцип образования ковалентной связи.
Представим два атома азота, которые приблизились на достаточное расстояние так, что их электронные облака перекрывают друг друга. Нуклиды имеют положительный заряд, в то время, как электронное облако образовало достаточно мощный отрицательный заряд, что и обеспечивает притяжение ядератомов. В этом электронном облаке образовались общие пары заряженных частиц и возникла ковалентная связь. Каким образом?
Типы Химических Связей — Как определять Вид Химической Связи? Химия 9 класс
Известно, что атом азота имеет электронную конфигурацию 2-5, а это значит, что ему не хватает 3 электронов для создания устойчивой 8-электронной внешней оболочки. При пересечении электронных облаков, атомы азота «подготавливают» по 3 частицы для формирования новых пар, в результате чего атомы теперь имеют общий устойчивый 8-электронный уровень. Свойство образовывать такие уровни называется валентностью, а числовая характеристика говорит о количестве электронов, которые могут быть «подготовлены» для образования пар. Таким образом, азот — это трехвалентный химический элемент.
Электроотрицательность
В предыдущем примере мы рассмотрели связь двух атомов азота. Если же два разных атома неметаллов образовали ковалентную связь, то один из них имеет «больший» электрический заряд, поэтому общие электронные пары смещаются в сторону более «сильного» ядра. Сила ядра определяется его электроотрицательностью: чем больше электроотрицательность ядра, тем лучше он образует электронные пары.
Полярные соединения формируются между частицами, разница в электоотрицательности ядер у которых находится в диапазоне от 0,4 до 2. Если разница меньше 0,4, то связь считается неполярной. Ионные соединения формируются между элементами, у которых разница в электроотрицательности больше 2. К примеру, металлы натрий, калий, литий или кальций образуют ионное соединение с активными неметаллами, в основном с галогенами, а также с молекулами некоторых солей и щелочей.
Силы Ван-дер-Ваальса
До этого мы говорили о силах, которые удерживают атомы вместе. Существуют также межмолекулярные силы, благодаря которым молекулы удерживаются друг с другом и образуют газы, жидкости и твердые тела. Эти силы носят имя Ван-дер-Ваальса — нидерландского физика, описавшего межмолекулярное взаимодействие.
Молекулы вещества могут преодолевать силы Ван-дер-Ваальса, если их энергия теплового движения достигнет определенного уровня. Если молекулы вещества практически не движутся, то силы крепко удерживают их на месте, и вещество представляет собой твердое тело. При тепловой энергии, эквивалентной температуре плавления, молекулы начинают плавное движение относительно друг друга, а вещество переходит в состояние жидкости. Когда же энергия достигает точки кипения, то молекулы начинают хаотично разлетаться, а вещество становится газом. Силы Ван-дер-Ваальса одинаково действует на все молекулы вне зависимости от типа атомной связи.
Наша программа позволяет выбрать два химических элемента и определить полярность связи в полученных молекулах. Калькулятор сравнивает значение электроотрицательности элементов и в случае, если разница находится в диапазоне 0,4-2,0, определяет связь как полярную. В иных ситуациях связь определяется как неполярная (меньше 0,4) или ионная (больше 2). Рассмотрим подробнее.
Примеры работы калькулятора
Программа содержит данные обо всех элементах периодической таблицы. Выберем наиболее популярные химические элементы и определим тип их связи. К примеру, хлорид натрия NaCl имеет следующие свойства:
- Электроотрицательность Na: 0,98 eV
- Электроотрицательность Cl: 3,16 eV
- Тип связи: ионная (не ковалентная связь)
- Разница электроотрицательности: 2,1800 eV
Хлороводород HCl характеризуется как:
- Электроотрицательность H: 2,10 eV
- Электроотрицательность Cl: 3,16 eV
- Тип связи: полярная ковалентная связь
- Разница электроотрицательности: 1,0600 eV
Если мы выберем водород H2, то получим:
- Электроотрицательность H: 2,10 eV
- Тип связи: неполярная ковалентная связь
- Разница электроотрицательности: 0,0000 eV
Таким путем вы можете выбрать любые два элемента периодической таблицы и определить тип химической связи.
Заключение
Тип химической связи между атомами зависит от электроотрицательности ядер. Узнать данный параметр можно в специальной таблице электроотрицательности, но легче воспользоваться онлайн-калькулятором, который мгновенно выдаст не только значения, но и тип химической связи.
Источник: bbf.ru
Определить тип химической связи в молекулах серебро
Привет Лёва Середнячок
определите вид химической связи в соединениях: Naf, SiO2,H2S, HCI,O2, BaO, SiF4.,NH3, Br2, O3, Fe
4 (19 оценок)

Енотик111117 5 лет назад
Светило науки — 4 ответа — 0 раз оказано помощи
NaF ионная
SiO2 ковалентная полярная
H2S ковалентная полярная
HCl ковалентная полярная
O2 ковалентная неполярная
BaO ионная
SiF4 ковалентная полярная
NH3 ковалентная полярная
Br2 ковалентная неполярная
O3 ковалентная неполярная
Fe металлическая
Источник: vashurok.com
Строение молекул. Химическая связь
Молекула — электрически нейтральная частица, образованная из двух или более связанных ковалентными связями атомов.
Химическая связь — это взаимодействие атомов, обуславливающее устойчивость молекулы или кристалла как целого.
Химическая связь может образовываться путем предоставления от каждого из атомов по одному или нескольким неспаренным электронам (кратные связи) с образованием электронных пар (ковалентная связь). В образовании химической связи участвуют только электроны внешней электронной оболочки, а внутренние электронные уровни не затрагиваются. В результате, при образовании химической связи у каждого атома образуется заполненная электронная оболочка внешнего электронного уровня, состоящая из двух (дуплет) или восьми (октет) электронов.
Химическая связь характеризуется длиной и энергией. Длина химической связи это расстояние между ядрами связанных атомов. Энергия химической связи показывает сколько необходимо затратить энергии на разведение двух атомов, между которыми существует химическая связь, на расстояние, при котором эта химическая связь будет разорвана.
Виды химической связи
Ионная химическая связь
Ионная связь — очень прочная химическая связь, образующаяся между атомами с большой разностьюэлектроотрицательностей, при которой общая электронная пара переходит преимущественно к атому с большей электроотрицательностью.
Результатом этого является образование соединения противоположно заряженных ионов:
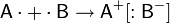
Это притяжение ионов как разноимённо заряженных тел. Ионная связь — крайний случай поляризации ковалентной полярной связи.
Образуется между типичными металлом и неметаллом (Me + неМе).
При этом электроны у металла полностью переходят к неметаллу, образуются ионы (частицы, имеющие заряд).
Например, типичные металлы литий (Li), натрий (Na), калий (K), кальций (Ca), стронций (Sr), барий (Ba) образуют ионную связь с типичными неметаллами, в основном с галогенами.
Кроме галогенидов щелочных металлов, ионная связь также образуется в таких соединениях, как щелочи и соли. Например, в гидроксиде натрия (NaOH) и сульфате натрия (Na2SO4) ионные связи существуют только между атомами натрия и кислорода (остальные связи — ковалентные полярные).
Ковалентная химическая связь
Ковалентная полярная химическая связь образуется при взаимодействии атомов, значение электроотрицательностей которых отличаются, но не резко, происходит смещение общей электронной пары к более электроотрицательному атому.
Электроотрицательность (ЭО) — способность атома химических элемента смещать к себе общие электронные пары, участвующие в образовании химической связи.
Ковалентная полярная связь образуется между разными неметаллами (неМе + неMe).
Это наиболее распространенный тип химической связи, которой встречается как в неорганических, так и органических соединениях.
Такая связь существует в молекулах следующих сложных веществ: Н2О, H2S, NH3 и др.
К ковалентным связям в полной мере относятся и те связи, которые образованы по донорно-акцепторному механизму, например в ионах гидроксония (Н3О+) и аммония (NH4+).
Металлическая химическая связь
Связь в металлах и сплавах между атом-ионами посредством обобществленных электронов называется металлической.
Металлическая связь — химическая связь, которая обусловлена взаимодействием положительных ионов металлов, составляющих кристаллическую решётку, с электронным газом из валентных электронов.
Металлическая химическая связь образуется в простых веществах-металлах (Me).
Сущность процесса образования металлической связи состоит в следующем: атомы металлов легко отдают валентные электроны и превращаются в положительные заряженные ионы. Относительно свободные электроны, оторвавшиеся от атома, перемещаются между положительными ионами металлов. Между ними возникает металлическая связь, т.е. электроны как бы цементируют положительные ионы кристаллической решетки металлов.
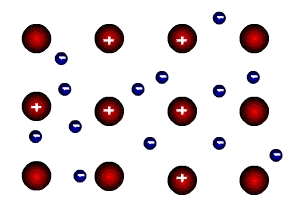
Металлическая связь существует в металлах в твердом в жидком состоянии. В соответствии с положением в периодической системе атомы металлов имеют небольшое число валентных электронов (1-3 электрона) и низкую энергию ионизации (отрыва электрона). Поэтому валентные электроны слабо удерживаются в атоме, легко отрываются и имеют возможность перемещаться по всему кристаллу.
В узлах кристаллической решетки металлов находятся свободные атомы, положительно заряженные ионы, а часть валентных электронов, свободно перемещаясь в объеме кристаллической решетки, образует «электронный газ» , обеспечивающий связь между атомами металла.
Связь, которую осуществляют относительно свободные электроны между ионами металлов в кристаллической решетке, называется металлической связью.
Металлическая связь возникает за счет обобществления атомами валентных электронов. Однако между этими видами связи есть существенное различие. Электроны, осуществляющие ковалентную связь, в основном пребывают в непосредственной близости от двух соединенных атомов.
В случае металлической связи электроны, осуществляющие связь, перемещаются по всему куску металла. Этим определяются общие признаки металлов: металлический блеск, хорошая проводимость теплоты и электричества, ковкость, пластичность и т. д.
Общим химическим свойством металлов является их относительно высокая восстановительная способность.
Источник: school332.ru