Правильный ответ на вопрос «Определите массу осадка образующегося при сливании 120 г 10,3%-ного раствора бромида натрия с избытком раствора нитрата серебра . » по предмету Химия. Развернутая система поиска нашего сайта обязательно приведёт вас к нужной информации. Как вариант — оцените ответы на похожие вопросы. Но если вдруг и это не помогло — задавайте свой вопрос знающим оппонентам, которые быстро дадут на него ответ!
Новые вопросы по химии
При сжигании этана образовался углекислый газ объемом 32 л. Какие объемы исходных газов было использовано? (н. у.)
Запишите уравнения химических реакций, характеризующие свойства: а) MgO и SO3; б) Mg (OH) 2 и H2SO4. Уравнения реакций с участием электролитов запишите также в ионной форме.
Осуществите превращения Cu—CuO—CuSo4—Cu (OH) 2—CuCl2
Ксилол 100% консентрация, чем разбавить чтоб получить 40%
Запишите схемы образования химических связей для веществ состав которых отображают формулами kcl и cl2
Главная » Химия » Определите массу осадка образующегося при сливании 120 г 10,3%-ного раствора бромида натрия с избытком раствора нитрата серебра
ЕГЭ по химии 2023. Разбор задачи 34 — образовался раствор с единственным растворенным веществом…
Источник: abiturient.pro
Определите массу осадка который образуется в результате реакции обмена между раствором нитрата серебра и раствором нитрата серебра и раствором содержащим 13, 35 г хлорида алюминия решение с дано и найти,
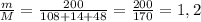
2AgNO₃ + Al(Cl)₂ = 2AgCl(осадок) + Al(NO₃)₂
2 моль 2 моль
1,2 моль Х моль
Х(AgCl) = 1,2 моль
m(AgCl) = n*M = 1,2 * 143,5 = 172,2г
0,0(0 оценок)
3AgNO3+ALCl3=3AgCl+Al (NO3)3
M (AlCl3)=27+35,5*3=133,5
M (3AgCl)=3*(108+35,5)=430,5

13,35 x
133,5 430,5
x=(13,35*430,5)/133,5=43,05
0,0(0 оценок)
3AgNo3+AlCl3=3AgCl+Al(NO3)3
m(AlCl3)=13.35г
n(AlCl3)=13.35/133.5=0.1 моль
n(AlCl3)/n(Agcl)=1/3
n(AgCl)=0.3
m(AgCl)=0.3*(108+35.5)=43.05
0,0(0 оценок)
1.)Mg + 2HCl = MgCl2 + H2 ; Судя по условию, соляная к-та в избытке.
Найдем кол-во магния:
n(Mg) = m(Mg)/M(Mg) = 4,8/24 = 0,2 моль
Из уравнения реакции видим: n(H2) = n(Mg) = 0,2 моль
Тогда, V(H2) = 0,2 * 22,4 = 4,48 л.
2.) 3AgNO3+AlCl3=3AgCl+Al(NO3)3 M в-ва(AlCl3)=200*6.675/100=13.35г.n(AlCl3)=13.35/133.5=0.1МОЛЬ.n(AlCl3):n(AgCl)=1:3сл-но n(AgCl)=0.3моль/M=0.3*142.5=42.75г
0,0(0 оценок)
Mg + 2HCl = MgCl2 + H2
Задание 34 ЕГЭ по химии (пример 38)
Количество вещества магния:
n(Mg) = m(Mg)/M(Mg) = 4,8/24 = 0,2 (моль)
n(H2) = n(Mg) = 0,2 (моль)
V(H2) = 0,2·22,4 = 4,48 л
3AgNO3 + AlCl3 = 3AgCl + Al(NO3)
Масса вещества AlCl3 в растворе: m(AlCl3) = 200·0,1 = 20 (г)
Количество вещества n(AlCl3) = 20/133 = 0,15 (моль)
n(AgCl) = 0,15·3= 0,75 (моль) m(AgCl) = 143·0,75 = 107,25 (г)
Zn + 2HCl = ZnCl2 + H2
Количества вещества цинка:
n = m/M = 6,5/65 = 0,1 (моль)
n(H2) = n(Zn) = 0,1 моль
Объема H2: V = Vm·n = 0,1·22,4 = 2,24 (л)
3AgNO3 + AlCl3 = 3AgCl + Al(NO3)3
Масса вещества AlCl3 в растворе: m(AlCl3) = 100·0,2 = 20 (г)
Количество вещества n(AlCl3) = 20/133 = 0,15 (моль)
n(AgCl) = 0,15·3= 0,75 (моль) m(AgCl) = 143·0,75 = 107,25 (г)
0,0(0 оценок)
3AgNO3+AlCl3=3AgCl+Al(NO3)3 M в-ва(AlCl3)=200*6.675/100=13.35г.n(AlCl3)=13.35/133.5=0.1МОЛЬ.n(AlCl3):n(AgCl)=1:3сл-но n(AgCl)=0.3моль/M=0.3*142.5=42.75г
0,0(0 оценок)
уравнение реакции 3agno3+alcl3=3agcl+al(no3)3 хлорид серебра выпадает в осадок находим кол-во чистого вещ-ва m(alcl3)= 200г*0,06675=13,35г а теперь кол-во вещества хлорида алюминия n(alcl3)= 13,35г/133,5г/моль=0,1моль т.к. по уравнению кол-во вещества хлорида алюминия 1 моль, а осадка 3 моля составим пропорцию n(agcl3)= 0,1*3/1= 0,3 моль n(agcl)=143,5 г/моль *0,3 моль= 43,05 г. все
0,0(0 оценок)

Решение в файле .
0,0(0 оценок)
Уравнение реакции 3AgNO3+AlCl3=3AgCl+Al(NO3)3 Хлорид серебра выпадает в осадок Находим кол-во чистого вещ-ва m(AlCl3)= 200г*0,06675=13,35г А теперь кол-во вещества хлорида алюминия n(AlCl3)= 13,35г/133,5г/моль=0,1моль Т.к. По уравнению кол-во вещества хлорида алюминия 1 моль, а осадка 3 моля составим пропорцию n(AgCl3)= 0,1*3/1= 0,3 моль n(AgCl)=143,5 г/моль *0,3 моль= 43,05 г. Все
0,0(0 оценок)
М(CuSO₄·5H₂O) = 250 г/моль
М(CuSO₄) = 160 г/моль
Возьмём х моль CuSO₄·5H₂O
Тогда масса CuSO₄·5H₂O составит 250х грамм, а масса CuSO₄ — 160х грамм
Массовая доля сульфата меди в растворе составит
160х / (95 + 250х) = 0,05
m(CuSO₄·5H₂O) = 250 · 0,0322 = 8 г
Источник: mozgotvet.com
Определите массу осадка который образуется в результате реакции обмена между раствором нитрата серебра и раствором
При взаимодействии нитрата серебра с хлоридом алюминия синтезируется нерастворимая соль хлорида серебра.
Процесс описывается следующим уравнением:
3 моль нитрата серебра вступает во взаимодействие с 1 молем трихлорида алюминия. При этом синтезируется 3 моль нерастворимого в воде хлорида серебра.
Вычислим химические количества имеющегося вещества.
М AlCl3 = 27 + 35,5 х 3 = 133,5 грамм/моль;
N AlCl3 = 1335 / 133,5 = 10 моль;
30 моль нитрата серебра вступает во взаимодействие с 10 моль трихлорида алюминия. При этом синтезируется 30 моль нерастворимого в воде хлорида серебра.
М AgCl = 108 + 35,5 = 143,5 грамм/моль;
Вес осадка составит:
м AgCl = 30 х 143,5 = 430,5 грамм;
Источник: znatachok.com