Порядок заполнения оболочек атома углерода (C) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ — до 6, на ‘d’ — до 10 и на ‘f’ до 14
Углерод имеет 6 электронов, заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
2 электрона на 2p-подуровне
Степень окисления углерода
Атомы углерода в соединениях имеют степени окисления 4, 3, 2, 1, -1, -2, -4.
Степень окисления — это условный заряд атома в соединении: связь в молекуле между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается, то степень окисления положительная.
Источник: k-tree.ru
Типы гибридизации атома углерода | Химия ЕГЭ 10 класс | Умскул
1) Строение атома углерода.
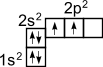
Э лектронное строение атома углерода изображается следующим образом: 1s 2 2s 2 2p 2 или схематически
Углерод в органических соединениях четырехвалентен.
Это связано с тем, что при образовании ковалентной связи атом углерода переходит в возбужденное состояние, при котором электронная пара на 2s- орбитали разобщается и один электрон занимает вакантную p-орбиталь. Схематически: 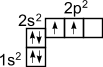 ––
–– 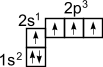
В результате имеется уже не два, а четыре неспаренных электрона.
2) Сигма и пи-связи.
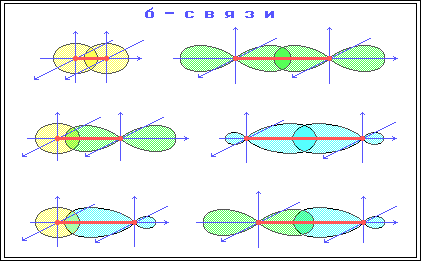
П ерекрывание атомных орбиталей вдоль линии, связывающей ядра атомов, приводит к образованию σ-связей.
Между двумя атомами в химической частице возможна только одна σ-связь. Все σ-связи обладают осевой симметрией относительно межъядерной оси.
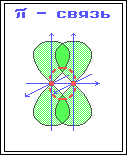
П ри дополнительном перекрывании атомных орбиталей, перпендикулярных линии связи и параллельных друг другу, образуются
π-связи.
В результате этого между атомами возникают кратные связи:
Тройная (σ + π + π)
3) Гибридизация.
Поскольку четыре электрона у атома углерода различны (2s- и 2p- электроны), то должны бы быть различны и связи, однако известно, что связи в молекуле метана равнозначны. Поэтому для объяснения пространственного строения органических молекул используют метод гибридизации.
1. При обобществлении четырех орбиталей возбужденного атома углерода (одной 2s- и трех 2p- орбиталей) образуются четыре новых равноценных sp 3 — гибридных орбитали, имеющие форму вытянутой гантели. Вследствие взаимного отталкивания sp 3 — гибридные орбитали направлены в пространстве к вершинам тетраэдра и углы между ними равны 109 0 28′ (наиболее выгодное расположение). Такое состояние атома углерода называют первым валентным состоянием.
Строение атома углерода. Химия 10 класс
2. При sp 2 -гибридизации смешиваются одна s- и две р-орбитали и образуются три гибридные орбитали, оси которых расположены в одной плоскости и направлены относительно друг друга под углом 120°. Такое состояние атома углерода называют вторым валентным состоянием.
3. При sp-гибридизации сливаются одна s- и одна р-орбитали и образуются две гибридные орбитали, оси которых расположены на одной прямой и направлены в разные стороны от ядра рассматриваемого атома углерода под углом 180°. Такое состояние атома углерода называют третьим валентным состоянием.
ТИПЫ ГИБРИДИЗАЦИИ в органических веществах.
Источник: studfile.net
3. Особенности строения атома углерода
Рассмотрим строение атома углерода — главного элемента органических соединений. Учтём, что атомы могут находиться как в основном, так и в возбуждённом состоянии. Возбуждённое состояние возникает, когда электроны получают дополнительную энергию и могут переходить с одной орбитали на другую.
Заряд ядра атома
Число электронов
Число электронных слоёв
Число валентных электронов
Электронно-графическая схема основного состояния

Электронная формула основного состояния
1s 2 2s 2 2p 2
Число неспаренных электронов в основном состоянии
Электронно-графическая схема возбуждённого состояния

Электронная формула возбуждённого состояния
1s 2 2s 1 2p 3
Число неспаренных электронов в возбуждённом состоянии
Атом углерода не проявляет выраженной способности присоединять или отдавать электроны и превращаться в ионы. Для него характерно образование ковалентных связей.
В возбуждённом атоме углерода четыре неспаренных электрона, и он может участвовать в образовании четырёх ковалентных связей. Атом углерода небольшой, и образуемые им связи прочные.
Ещё одно важное отличие атомов углерода — это их способность связываться друг с другом в цепи и циклы.
Источник: www.yaklass.ru