Представленный материал проверяет знания учащихся 11 класса о строении ядра атома, альфа- и бетта- распадов, написание ядерных реакций.
Скачать:
Предварительный просмотр:
МОУ Истринская СОШ № 3
Самостоятельная работа в 11 классе по теме:
«Строение ядра. Ядерные реакции»»
Климова Ирина Николаевна,
1. В результате серии радиоактивных распадов радон 220 86 Rn превращается в таллий 208 81 Tl. Сколько и распадов он при этом испытывает ?
2.Определите строение ядер атомов углерода и серебра.
3. Напишите ядерные реакции:
26 13 Al (n, ) Х, 239 94 Pu ( , Х) р
4. При бомбардировке изотопа азота 15 7 N нейтронами из образовавшегося ядра выбрасывается протон. Напишите ядерную реакцию. Полученное ядро испытывает — распад. Напишите ядерную реакцию.
1. Определите строение ядер германия и радия.
2. В результате серии радиоактивных распадов уран 235 92 U превращается в торий 219 90 Th. Сколько и распадов он при этом испытывает ?
Химия 8 класс (Урок№26 — Строение атома. Состав атомных ядер. Изотопы.)
3. При бомбардировке — частицами алюминия образуется новое ядро и нейтрон. Напишите ядерную реакцию. Полученное ядро испытывает — распад. Напишите ядерную реакцию.
4. Напишите ядерные реакции:
Х (р, 22 11 Na) , 56 25 Mn (X, 55 26 Fe) n
- 3 — и 1 — распадов.
- Строение ядер:
6 протонов и 6 нейтронов в ядре атома германия,
47 протонов и 61 нейтрон в ядре атома серебра,
3. 26 13 Al + 1 0 n 4 2 He + 23 11 Na ,
239 94 Pu + 4 2 He 242 95 Am + 1 1 р
4. 15 7 N + 1 0 n 1 1 p + 15 6 С
15 6 C 4 2 He + 11 4 Be
1. Строение ядер:
32 протона и 41 нейтрон в ядре атома углерода,
88 протона и 138 нейтрона в ядре атома радия,
2. 4 — и 6 — распадов.
3. 27 13 Al + 4 2 He 30 15 P + 1 0 n
30 15 P 0 -1 e + 30 16 S
4. 25 12 Mg + 1 1 р 22 11 Na + 4 2 He ,
56 25 Mn + 0 1 e + 55 26 Fe + 1 0 n
А.П.Рымкевич «Сборник задач по физике», М., «Просвещение»,1984
По теме: методические разработки, презентации и конспекты

Самостоятельная работа по биологии по теме «Строение клетки» 9 класс
Данная самостоятельная работа может быть использована как в конце урока после закрепления вновь изученного материала, так и в начале следующего урока при проверке знаний. Она состоит из двух вариантов.

Самостоятельная работа 5 класс по теме «Действия с дробями»
Работа расчитана на 10 минут, ребенок выполняет задание и в ответ указывает цвет правильного результата. Цветовая гамма позволяет облегчить проверку, точнее, ускорить ее, и дает возможность моментальн.

Строение атома углерода. Химия 10 класс
Самостоятельная работа (9 класс) по темам: Введение. Углеводы. Липиды.
Самостоятельная работа (9 класс) по темам:Введение. Углеводы. Липиды. 1. В каких клетках содержится больше углеводов?а) в растительных; б) в животных; в) одинаковое количество в тех и други.

Самостоятельная работа 8 класс по теме: «Обработка среза окантовочным швом и косой обтачкой. Обработка среза двойной строчкой.»
Самостоятельная работа 8 класс.
Самостоятельная работа 10 класс по теме «Das Aussehen»
Самостоятельная работа расчитана на учеников общеобразовательных школ ,где немецкий язык — основной. Самостоятельная работа имеет грамматический уклон (союзы obwohl, trotzdem, предлоги: trotzt, .

Подготовка к контрольной работе 11 класс по теме: Строение атома. периодический закон Д.И.Менделеева, учебник О.С.Габриелян
Вариант контрольной работы для подготовки учащихся к контролю знаний по теме: Строение атома.Периодический закон Д.И.Менделеева.
Контрольная работа 9 класс по теме «Строение атома и атомного ядра»
Контрольная работа для 9 класса по теме «Строение атома и атомного ядра» содержит задания разных уровней сложности.
Источник: nsportal.ru
ГДЗ к Сборнику задач по физике за 7-9 классы к учебникам А.В. Перышкина
64. Строение атомного ядра
Начните вводить часть условия (например, могут ли , чему равен или найти ):
64. Строение атомного ядра
- 1370. Сколько электронов входит в состав нейтрального атома углерода, серебра, урана?
- 1371. Определите массу (в а.е.м*. с точностью до целых чисел) и заряд (в элементарных зарядах) ядер атомов следующих элементов: кислорода 8 16 О; калия 19 39 К ; меди 29 64 Cu.
- 1372. Определите (с точностью до целых чисел), во сколько раз масса ядра атома магния 12 24 Mg больше массы ядра атома водорода 1 1 Н.
- 1373. Для ядра атома азота 7 14 N определите: а) массовое число; б) массу ядра в а. е. м. (с точностью до целых чисел); в) зарядовое число; г) заряд ядра (в элементарных зарядах).
- 1374. Для атома брома 35 80 Br определите: а) число электронов в атоме; б) заряд всех электронов в атоме (в элементарных зарядах).
- 1375. Какое количество нуклонов содержат ядро атома: а) бора 5 10 B; б) олова 50 119 Sn; в) полония 84 210 Po?
- 1376. Определите состав ядер атомов: а) гелия 2 4 He; б) алюминия 13 27 Al; в) фосфора 15 31 P.
- 1377. Сколько нуклонов, протонов, нейтронов, электронов содержат нейтральные атомы: 3 7 Li; 9 19 F; 10 20 Ne; 30 65 Zn ?
- 1378. Сколько нуклонов, протонов, нейтронов, электронов содержат нейтральные атомы: 8 15 O; 8 16 O; 8 17 O? Что объединяет эту группу атомов?
- 1379. При естественном радиоактивном распаде радий 88 226 Ra испускает α-частицу. Какой химический элемент при этом образуется? Запишите эту реакцию.
- 1380. Изотоп свинца 82 209 Pb при радиоактивном распаде испускает β-частицу. В ядро какого элемента при этом превращается ядро изотопа свинца? Запишите эту реакцию.
- 1381. В результате какого радиоактивного распада плутоний 94 239 Pu превращается в уран 92 235 U ? Запишите эту реакцию.
- 1382. В результате какого радиоактивного распада натрий 11 22 Na превращается в магний 12 22 Mg ? Запишите эту реакцию.
- 1383. Допишите недостающие символы в реакции радиоактивного распада:
- 1384. Какое ядро получается из ядра криптона 36 97 Kr после шести β-распадов? Запишите эта реакции.
- 1385. Сколько электронов испускает ядро ксенона 54 140 Хе при превращении в стабильное ядро церия 58 140 Ce? Запишите эти реакции.
- 1386. Изменяются ли массовое число, масса и порядковый номер элемента при испускании ядром γ-кванта?
- 1387. При бомбардировке изотопа бора 5 10 B нейтронами из образовавшегося ядра выбрасывается α-частица. Ядро какого элемента при этом получается? Запишите эту реакцию.
- 1388. Элемент резерфордий получили, облучая плутоний 94 242 Pu ядрами неона 10 22 Ne. Напишите реакцию, если известно, что в результате образуется еще четыре нейтрона.
- 1389. Используя таблицу Менделеева, допишите недостающие символы X, Z, А ядерных реакций:
- 1390: Вычислите дефект массы и энергию связи ядра бора 5 11 B, если масса атома бора равна 11,009305 а. е. м., масса атома водорода равна 1,007825 а. е. м., масса нейтрона — 1,008665 а. е. м.
Комментарии
Нашли о и ш бку?
Выделите её мышкой и нажмите CTRL + ENTER
Большое спасибо всем, кто помогает делать сайт лучше! =)
Источник: 5terka.com
Строение атома углерода

Углерод (С) – шестой элемент периодической таблицы Менделеева с атомным весом 12. Элемент относится к неметаллам и имеет изотоп 14 С. Строение атома углерода лежит в основе всей органической химии, т. к. все органические вещества включают молекулы углерода.
Атом углерода
Положение углерода в периодической таблице Менделеева:
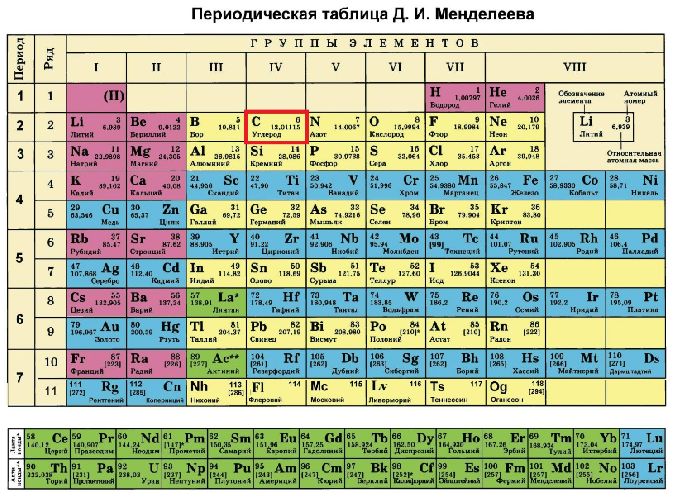
- шестой порядковый номер;
- четвёртая группа;
- второй период.
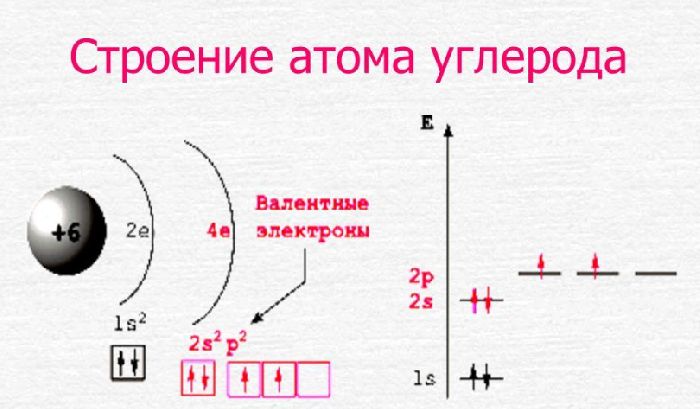
Опираясь на данные из таблицы, можно заключить, что строение атома элемента углерода включает две оболочки, на которых расположено шесть электронов. Валентность углерода, входящего в состав органических веществ, постоянна и равна IV. Это значит, что на внешнем электронном уровне находится четыре электрона, а на внутреннем – два.
Из четырёх электронов два занимают сферическую 2s-орбиталь, а оставшиеся два – 2p-орбиталь в виде гантели. В возбуждённом состоянии один электрон с 2s-орбитали переходит на одну из 2p-орбиталей. При переходе электрона с одной орбитали на другую затрачивается энергия.
Таким образом, возбуждённый атом углерода имеет четыре неспаренных электрона. Его конфигурацию можно выразить формулой 2s 1 2p 3 . Это даёт возможность образовывать четыре ковалентные связи с другими элементами. Например, в молекуле метана (СН4) углерод образует связи с четырьмя атомами водорода – одна связь между s-орбиталями водорода и углерода и три связи между p-орбиталями углерода и s-орбиталями водорода.
Схему строения атома углерода можно представить в виде записи +6C)2)4 или 1s 2 2s 2 2p 2 .
Физические свойства
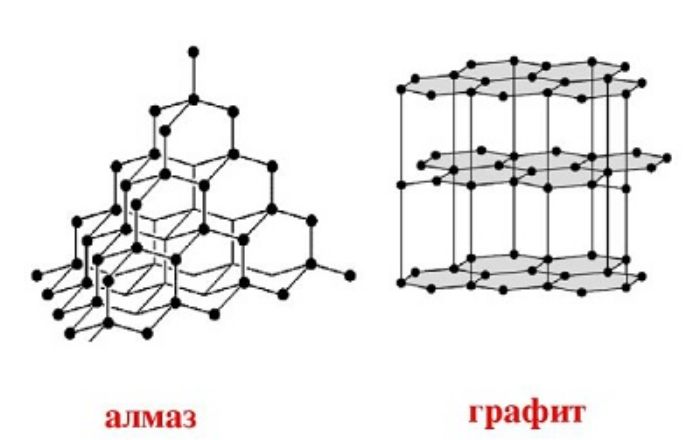
Углерод встречается в природе в виде горных пород. Известно несколько аллотропных модификаций углерода:
- графит;
- алмаз;
- карбин;
- уголь;
- сажа.
Все эти вещества отличаются строением кристаллической решётки. Наиболее твёрдое вещество – алмаз – имеет кубическую форму углерода. При высоких температурах алмаз превращается в графит с гексагональной структурой.
Химические свойства
Атомное строение углерода и его способность присоединять четыре атома другого вещества определяют химические свойства элемента. Углерод реагирует с металлами, образуя карбиды:
- Са + 2С → СаС2;
- Cr + C → CrC;
- 3Fe + C → Fe3C.
Также реагирует с оксидами металлов:
- 2ZnO + C → 2Zn + CO2;
- PbO + C → Pb + CO;
- SnO2 + 2C → Sn + 2CO.
При высоких температурах углерод реагирует с неметаллами, в частности с водородом, образуя углеводороды:
С + 2Н2 → СН4.
С кислородом углерод образует углекислый газ и угарный газ:
Угарный газ также образуется при взаимодействии с водой:
C + H2O → CO + H2.
Концентрированные кислоты окисляют углерод, образуя углекислый газ:
Активность углерода возрастает при нагревании. При низких температурах элемент относительно стабилен.
Что мы узнали?
Углерод – типичный неметалл с шестью электронами на s- и р-орбиталях. В активном состоянии приобретает валентность IV и способен присоединять четыре атома вещества. Углерод может быть представлен в виде угля, сажи, графита, алмаза. Элемент реагирует с металлами, неметаллами, кислотами, кислородом, оксидами.
Источник: obrazovaka.ru