Ко II группе анионов относятся ионы Cl – , Br – , I – и S 2– , образующие в разбавленных растворах азотной кислоты малорастворимые соединения с ионами Ag + . Групповой реагент – раствор AgNO3 в присутствии 2 н. HNO3.
Большинство хлоридов и бромидов хорошо растворимо в воде. Малорастворимы хлориды и бромиды серебра, ртути, свинца и меди (I). Иодид-ионы обладают восстановительными свойствами.
Опыт 4. Характерные реакции на ион Cl –
Описание 1. Реакция с нитратом серебра.
К 2-3 каплям раствора, содержащего хлорид-иона, добавляют 2-3 капли раствора нитрат серебра. Образуется белый творожистый осадок AgCl:
Cl – + Ag + → AgCl↓.
Осадок не растворяется в HNO3, но растворяется в NH3:
Описание 2. Реакция с катионами Pb 2+ .
Растворимые соли Pb 2+ реагируют с хлорид-ионами с образованием белого осадка:
Pb 2+ + 2Cl – → PbCl2↓.
В горячем растворе осадок растворяется полностью, а при охлаждении вновь выпадает.
Опыт 5. Характерные реакции на ион Br –
Гель с ионами серебра «Венера»
Описание 1. Реакция с нитратом серебра.
К 2-3 каплям раствора, содержащего бромид-ионы, добавляют 2-3 капли раствора нитрата серебра. Образуется бледно-жёлтый осадок AgBr:
Br – + Ag + → AgBr↓.
Окраска осадка зависит от размеров частиц. Часто осадок получается белым. В отличие от AgCl осадок AgBr не растворяется в гидроксиде аммония.
Описание 2. Реакция с сильными окислителями (KMnO4, KBrO3, CrO3 и др.).
Сильные окислители в кислой среде окисляют бромид-ионы до молекулярного брома:
10Br – + 2MnO4 – + 16H + → 5Br2 + 2Mn 2+ + 8H2O.
Молекулярный бром окрашивает раствор в бурый цвет, а над раствором появляются бурые пары брома, особенно при нагревании (реакцию надо проводить под тягой!). Образующийся бром можно экстрагировать из водной фазы органическими растворителями, слой которых окрашивается после экстракции в жёлто-бурый цвет.
Опыт 6. Характерные реакции на ион I –
Описание 1. Реакция с нитратом серебра.
К 2-3 каплям раствора, содержащего иодид-ионы, добавляют 2-3 капли раствора нитрата серебра. Образуется светло-жёлтого осадка AgI:
I – + Ag + → AgI↓.
Осадок AgI практически не растворим в HNO3 и NH3.
Описание 2. Реакция с хлорной водой.
К 1-2 каплям раствора, содержащего иодид-ионы, добавляют 2-3 капли 1М серной кислоты, 1-2 капли хлорной воды и 1-2 капли раствора крахмала. Появляется синее окрашивание. Вместо крахмала можно добавить несколько капель CHCl3, CCl 4 или С6Н6 и встряхнуть. Хлорная вода окисляет ионы I – до молекулярного иода I2:
2I – + Cl2 → I2 + 2Cl – .
Выделяющийся иод окрашивает раствор в жёлто-коричневыйцвет. Органические растворители хорошо экстрагируют I2 из водной фазы, в результате чего органический слой окрашивается в фиолетово-розовый цвет.
«Качественные реакции на анионы III группы».
Общая характеристика анионов III группы
К III группе анионов относятся ионы NO2 – и NO3 – . Анионы
III группы не имеют группового реагента.
Как понять что вещество выпадает в осадок или образуется газ
Нитрит-ионы являются анионами слабой кислоты и подвергаются гидролизу в водных растворах. Ионы NO2 – обладают окислительными и восстановительными свойствами, а ионы NO3 – – восстановительными.
Все нитриты хорошо растворимы в воде. Все нитраты (кроме нитратов висмута и ртути) также хорошо растворимы в воде.
Опыт 7. Характерные реакции на ион NO2 –
Описание 1. Реакция с реактивом Грисса–Илосвая.
Реактив Грисса–Илосвая (смесь сульфаниловой кислоты HSO3C6H4NH2 с α-нафтиламином C10H7NH2) с нитрит-ионами в нейтральных и уксуснокислых растворах придает раствору ярко-красный цвет за счёт образования азокрасителя. В кислой среде в присутствии нитрит-ионов образуется азотистая кислота, реагирующая с сульфаниловой кислотой с образованием соли диазония:

Соль диазония вступает в реакцию азосочетания с
α-нафтиламином, образуя азокраситель красного цвета:
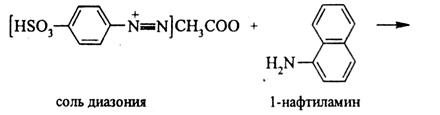

Описание 2. Реакция с солями аммония.
Нитрит-ионы при нагревании окисляют ионы аммония NH4 + и карбамид до свободного N2:
Эти реакции используют с целью удаления нитрит-ионов.
Описание 3. Реакция с иодидом калия.
К 2-3 каплям раствора, содержащего нитрит-ионы, добавляют 1-2 капли 2М соляной кислоты или уксусной кислоты и 2-3 капли раствора иодида калия. Иодид калия в разбавленных кислых растворах окисляется нитрит-ионами до молекулярного иода I2:
2NO2 – + 2I – + 4H + → I2 + 2NO + 2H2O.
Выделившийся иод окрашивает раствор в бурый цвет. При добавлении крахмала появляется синее окрашивание.
Описание 4. Реакция с перманганатом калия.
К 2-3 каплям раствора KMnO4 прибавляют 2-3 капли 1М серной кислоты, несколько капель раствора, содержащего нитрит-ионы, и слегка подогревают. Осуществляется превращение иона NO2 – до NO3 – :
5NO2 – + 2MnO4 – +6H + → 5NO3 – + 2Mn 2+ + 3H2O.
При этом раствор KMnO4 обесцвечивается.
Опыт 8. Характерные реакции на ион NO3 –
Описание 4. Реакция с дифениламином.
На стеклянную пластинку помещают 2-3 капли раствора дифениламина в концентрированной серной кислоте и 1-2 капли раствора, содержащего нитрат-ионы.
Дифениламин (C6H5)2NH в среде концентрированной H2SO4 окисляется нитрат-ионами вначале в бесцветный дифенилбензидин, а затем в дифенилдифенохинондиимин, окрашенный в интенсивно-синий цвет. Предполагают следующий механизм окисления дифениламина в кислой среде. Вначале происходит необратимое окисление дифениламина в дифенилбензидин:
дифениламин дифенилбензидин (бесцветный)
Затем происходит обратимое окисление дифенилбензидина до окрашенного в синий цвет дифенилдифенохинондиимина:
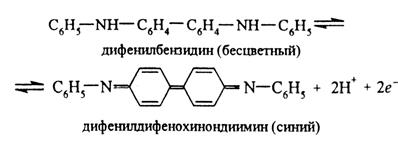
Описание 2. Реакция с металлическим цинком или алюминием.
К 3-4 каплям раствора, содержащего нитрат-ионы, прбвляют несколько капель 2М гидроксида натрия и 1-2 кусочка металлического алюминия. Пробирку закрывают не очень плотно ватой, поверх которой помещают влажную красную лакмусовую бумагу и нагревают на водяной бане. Выделяющийся аммиак окрашивает предварительно увлажнённую индикаторную бумагу в синий цвет. Нитрат-ионы в щелочной среде восстанавливаются металлическим цинком до аммиака:
Лабораторная работа №5
«Анализ смеси анионов»
Цель работы: провести качественный анализ раствора, в котором возможно присутствие анионов 1, 2 и 3 аналитической группы.
В противоположность катионам, анионы в большинстве случаев не мешают обнаружению друг друга, поэтому их открывают дробным методом, т.е. в отдельных порциях исследуемого раствора. В соответствии с этим при анализе анионов групповые реагенты применяют обычно не для разделения групп, а лишь для того, чтобы установить их наличие или отсутствие. Если установлено отсутствие анионов всей группы, то не следует проводить реакции на отдельные анионы. В этом смысле проведение групповых реакций значительно облегчает работу и экономит время. Существуют некоторые смеси анионов, для определения состава которых необходимо проведение систематического анализа.
Поскольку в данной работе вы познакомились лишь с элементами качественного анализа анионов, то задача на смесь анионов будет включать не все, а некоторые анионы 1,2 и 3 аналитических групп: SO4 2- , CO3 2- , PO4 3- , Cl — , J — , NO3 — ,NO — 2.
Подготовка к выполнению работы и проведение анализа.
1. Повторить технику выполнения основных операций (см. приложение)
2. Изучить основные аналитические реакции указанных анионов, используя растворы их солей.
3. Ознакомиться с рекомендациями к выполнению контрольных анализов (см.приложение)
4. после этого получить у лаборантов контрольный (анализируемый) раствор и выполнить лабораторную работу в соответствии со схемой анализа (см. схему 4 в приложении) и приведенным ниже ходом выполнения. Результаты анализа представить в виде таблицы (образец — табл.1).
Источник: infopedia.su
Большая Энциклопедия Нефти и Газа
Осадок роданида серебра адсорбирует на своей поверхности AgN03 или KSCN в зависимости от того, какая соль находится в избытке в растворе [981]; это свойство осадка необходимо принимать во внимание при титриметрическом определении серебра. [1]
Это происходит потому, что осадок роданида серебра адсорбирует ионы серебра, которые вступают в реакцию с роданидом аммония при энергичном взбалтывании раствора. Кроме того, следует иметь в виду, что хлорид серебра медленно реагирует с роданидом аммония вследствие меньшей растворимости роданида серебра ( произведение растворимости AgCl равно 1 8 — Ю-10, a AgSCN равно 1 16 — Ю-12, поэтому для получения отчетливого конца титрования рекомендуется предварительно удалять осадок центрифугированием. Описанный ниже метод дает возможность определять как малые ( 10 — 20 цг), так и большие количества хлор-иона с достаточно высокой точностью. [2]
Эта окраска иногда бывает неустойчива и исчезает при встряхивании, так как осадок роданида серебра содержит обычно некоторое количество адсорбированных ионов серебра, поэтому необходимо титровать до появления устойчивой красной краски. [3]
К слабокислому анализируемому раствору прибавляют 25 % — ный раствор роданида аммония в количестве, достаточном для растворения выпадающего в начале осадка роданида серебра . Если присутствует соль ртути ( II), прибавляют еще избыток раствора роданида: 5 мл на каждые 10 мг ртути. Экстрагируют небольшими порциями 5 % — ного раствора пиридина в хлороформе, соединяют экстракты и промывают их один раз равным объемом 2 % — ного раствора роданида. [4]
К слабокислому анализируемому раствору прибавляют 25 % — ный раствор роданида аммония в количестве, достаточном для растворения выпадающего в начале осадка роданида серебра . [5]
Титрование бромидов по гетоду Фольгарда происходит более ч ткс, чем титрование хлоридов, так как осадок AgBr менее раствор. чем осадок роданида серебра . [6]
Метод Фольгарда W 8 — 9 основан на осаждении ионов хлора избытком нитрата серебра в кислой среде ( подкисление азотной кислотой) и обратном титровании избытка ионов серебра раствором роданида калия ( или аммония), образующим осадок роданида серебра . [7]
Роданид-ионы можно осадить в виде роданида серебра из раствора, содержащего свободную разбавленную азотную кислоту. При желании отделить роданид-ионы от серебра осадок роданида серебра можно обработать сероводородом: роданистоводородная кислота переходит в раствор, в остатке остается сульфид серебра. Метод пригоден для отделения следов роданида. [8]
Роданид-ионы можно осадить в виде роданида серебра из раствора, содержащего свободную разбавленную азотную кислоту. При желании отделить роданид-ионы от серебра осадок роданида серебра можно обработать сероводородом: роданистоводородная кислота переходит в раствор, в остатке остается сульфид серебра. Метод пригоден для отделения следов роданида. [9]
Один из авторов2 настаивая на применении метода Фольгарда, рекомендует отфильтровывать осадок роданида серебра , когда почти все серебро осаждено. Тогда конец титрования наблюдается более четко. [10]
Это явление имеет некоторое значение для аналитических методик, в которых используется осаждение. Например, в одном из распространенных методов определения ионов серебра используется титрование стандартным раствором, содержащим роданид-ионы. Мелкие частицы осадка роданида серебра могут адсорбировать значительное количество ( например, 5 %) остающихся в растворе ионов серебра. Эти адсорбированные ионы не титруются, если не обеспечивается их контакт с добавляемым роданидом путем энергичного встряхивания гетерогенной смеси. [11]
Раствор разбавляют водой в 3 раза и добавляют 10 мг Fe в виде нитрата. Раствор с осадком гидроокиси железа кипятят, осадок отфильтровывают и отбрасывают. Полученный раствор разбавляют водой до 5 % — ной HNO3 и титруют серебро раствором роданида калия в присутствии железоаммонийных квасцов. Осадок роданида серебра фильтруют на разборном фильтре, сушат и измеряют активность. [12]
Раствор разбавляют водой в 3 раза и добавляют 10 мг Fe в виде нитрата. Раствор с осадком гидроокиси железа кипятят, осадок отфильтровывают и отбрасывают. В фильтрате восстанавливают серебро глюкозой, осадок элементарного серебра центрифугируют, промывают 5 % — ной H2SO4 и растворяют в концентрированной HNOs. Полученный раствор разбавляют водой до 5 % — ной HNO3 и титруют серебро раствором роданида калия в присутствии железоаммонийных квасцов. Осадок роданида серебра фильтруют на разборном фильтре, сушат и измеряют активность. [13]
Однако установление точки эквивалентности встречает затруднения. Таким образом, при титровании может быть сделано ошибочное заключение, что точка эквивалентности еще не достигнута. Это может быть объяснено следующим. Вследствие обратимости реакций в точке эквивалентности в растворе, кроме молекул роданида железа, остается очень малое количество ионов Fe и CNS, а также и ионов Ag, CNS и Cl из осадков AgCNS H AgCl. Между остающимися ионами возможны реакции образования наименее растворимых веществ и в частности осадка роданида серебра , но реакция образования последнего практически незаметна. При энергичном же взбалтывании оеадка реакция идет гораздо быстрее. [14]
Источник: www.ngpedia.ru
9 Примеры реакции осаждения: подробные пояснения
В этой статье мы увидим примеры реакций осаждения с подробными пояснениями.
Химическая реакция, в которой два иона объединяются с образованием одного из нерастворимых продуктов в водном растворе, который выпадает в осадок. Осадок показан стрелкой вниз в химической реакции. Он используется для проверки элементов, присутствующих в решении. это тип двойника реакция смещения.

Кредиты изображений: Википедия
Примеры реакции осаждения
Нитрат серебра и хлорид калия
Нерастворимая соль или осадок хлорид серебра AgCl является продуктом реакции между нитратом серебра AgNO3 и хлорид калия KCl. Хлорид серебра AgCl представляет собой нерастворимый в воде твердый осадок белого цвета. Реакция протекает в водном растворе. Так что ионы образуются для замены каждого другой и для образования соли.

Сульфат железа и гидроксид натрия
Гидроксид железа (II) Fe(OH)2 представляет собой нерастворимую соль, образующуюся при взаимодействии сульфата железа FeSO4 и гидроксида натрия. NaOH вступает в реакцию. Сульфат натрия Na2SO4 образуется как побочный продукт. Гидроксид железа (II) представляет собой твердое вещество зеленого цвета.

Нитрат серебра и хлорид натрия
Нерастворимая соль или осадок хлорида серебра AgCl является продуктом реакции нитрата серебра AgNO3 и хлорид натрия NaCl. Нитрат натрия также образуется как побочный продукт. Хлорид серебра AgCl представляет собой нерастворимый в воде твердый осадок белого цвета. Реакция протекает в водном растворе. Так образуются ионы, которые заменяют друг друга и образуют соль.

Хлорид кальция и гидроксид калия
Гидроксид кальция Са(ОН)2 выпадает в осадок. реакция хлорида кальция CaCl2 и гидроксида калия KOH. Реакция протекает только в водной среде. Гидроксид кальция Ca(OH)2 представляет собой нерастворимый в воде твердый осадок белого цвета.

Гидроксид магния и соляная кислота
Хлорид магния MgCl2 представляет собой нерастворимую соль, образующуюся, когда гидроксид магния Mg(OH)2 и соляная кислота HCl реагируют друг с другом. Хлорид магния MgCl2 представляет собой бесцветное или белое твердое вещество, а вода образуется как побочный продукт.

Гидроксид натрия и медный купорос
Гидроксид меди Cu(OH)2 выпадает в осадок, когда гидроксид натрия NaOH и сульфат меди CuSO4 реагируют друг на друга. Гидроксид меди Cu(OH)2 представляет собой твердое вещество синего цвета, образованное сульфатом натрия Na2SO4 в качестве сопутствующего продукта.

Хлорид стронция и сульфат натрия
Сульфат стронция SrSO4 водонерастворимая соль, выпадающая в осадок, когда хлорид стронция SrCl2 и сульфат натрия Na2SO4 реагируют друг на друга. Хлорид натрия NaCl также образуется как побочный продукт. Сульфат стронция SrSO4 представляет собой нерастворимый в воде твердый осадок белого цвета.

нитрат свинца и йодид калия
Иодид свинца Pbl2 осаждается реакцией нитрата свинца Pb(NO)3 и йодид калия KI. Нитрат калия KNO3 образуется как побочный продукт. Для реакции требовались водные условия. Иодид свинца Pbl2 представляет собой твердое вещество желтого цвета.

Сульфат железа и гидроксид натрия
Гидроксид железа (III) Fe(OH)3 представляет собой нерастворимую соль, образующуюся при взаимодействии сульфата железа Fe2(SO)4 и гидроксида натрия. NaOH вступает в реакцию. Сульфат натрия Na2SO4 образуется как побочный продукт. Гидроксид железа (III) представляет собой твердое вещество коричневого цвета.

Сульфид калия и сульфат кадмия
Сульфид кадмия CdS образуется в результате реакции сульфида калия K2S и сульфат кадмия CdSO4. Сульфат калия образуется как побочный продукт. Сульфид кадмия CdS представляет собой твердое вещество желтого цвета, нерастворимое в воде. Для реакции требовалась водная среда.

Факты
- Химическая реакция, в которой два иона объединяются с образованием одного из нерастворимых продуктов в водном растворе, который выпадает в осадок.
- Осадок показан стрелкой вниз в реакции.
- это тип двойника реакция смещения.
- Он влияет на тип и размер ионов, концентрацию водного раствора, рН раствора, растворимость и т. д.
Часто задаваемые вопросы:
Вопрос: Что такое реакция осаждения?
Ответ: Реакция осаждения,
Химическая реакция, в которой два иона объединяются с образованием одного из нерастворимых продуктов в водном растворе, который выпадает в осадок. Осадок показан стрелкой вниз в химической реакции. Он используется для проверки элементов, присутствующих в решении. Это тип реакции двойного замещения.
Вопрос: Какие факторы влияют на реакцию осаждения?
Ответ: Факторы, влияющие на реакцию осаждения:
Тип и размер ионов, концентрация водного раствора, рН раствора, растворимость и т.д.
Вопрос: Какие примеры осадков встречаются в природе?
Ответ: Осадки выпадают в природе,
Наиболее распространенными примерами осадков являются дождь, снегопад, град, мокрый снег, роса и т. д.
Источник: ru.lambdageeks.com