Красивый вид серебра, его способность хорошо воспринимать полировку, его пластичность и стойкость на воздухе пе только при обычной температуре, но и при нагревании — общеизвестны.
Из всех металлов серебро обладает наивысшей отражательной способностью по отношению к белому свету.
1. Физические Свойства серебра
Главнейшие физические свойства серебра следующие:
| атомный вес | 107,880 |
| атомный номер | 47 |
| удельный вес при 18° | 10,50 |
| атомный объем | 10,21 |
| температура плавления | 960,5° |
| температура кипения | 1955° |
| твердость по Бринелю при нагрузке 2О0 кг | 32,3 |
| твердость по шкале Мооса | 2,7 |
| удельная электропроводность при 25° | 62,97*~10 |
| температурный коэффициент электросопротивления при 25° | 0,00427 |
| удельная теплоемкость | 0,055 |
| коэффициент линейного расширения (0—100°) | 19,8 |
| теплопроводность при 0° | 4,15 |
| кристаллическая структура | куб с центрированными, гранями |
| параметр кристаллической решетки | 4,077А |
| удельная магнитная восприимчивость при 18° на грамм | —0,20 -10~6 « |
| отражательная способность для луча | 94% |
Химия 9 класс. Физические свойства металлов
2. Химические соединения серебра
В химических соединениях серебро образует одновалентные катионы.
Кислородные соединения серебра. Приливая щелочи в горячий раствор серебряной соли, можно получить бурый осадок окиси серебра AgO3:
Окись серебра весьма слабо (1 : 3000) растворима в воде и придает раствору основные свойства вследствие образования ионов Ag и ОН. Эта реакция показывает на отличие серебра от золота. Серебро обладает более ясно выраженными металлическими 4 свойствами и не образует амфотерных окислов, свойственных золоту.
Гидрат окиси серебра является малоустойчивым соединением и при 60° разлагается:.
При нагревании выше 250° Ag2O диссоциирует на металл и кислород.
Серебро в расплавленном состоянии растворяет значительные количества (более 20 объемов) кислорода, который при затвердевании металла выделяется. Вследствие этого при быстром остывании на металле образуются наросты и возможно разбрызгивание. В твердом состоянии растворимость кислорода в серебре весьма мала (менее 1 объема).
Сернистое серебро получается при действии сероводорода на растворы солей серебра:
Сернистое серебро черного цвета. То же соединение образуется на поверхности серебряных предметов под действием сероводорода. Оно также может быть получено сплавлением серебра с серой. Сернистое серебро встречается в природе в виде серебряного блеска.
Интересно знать. Строение, химические и физические свойства благородных металлов
Серебро легко растворяется В азотной и концентрированной кислотах:
Третья реакция идет быстро при нагревании.
Азотнокислое серебро, или ляпис — кристаллы ромбической системы. AgNO2 очень хорошо растворимо В воде: в насыщенном водном растворе при 20° его содержится 68,3%, при 50° — 80,0% и при 100° 90,1% в 100 г -насыщенного спиртового раствора 25 г. Азотнокислое серебро плавится при 200°. При действии света и при соприкосновении с органическими веществами эта соль восстанавливается с выделением черного мелкозернистого металлического серебра. Азотнокислое серебро поступает в продажу в виде 1 кристаллов или в сплавленной в форме палочки. Палочки азотно-серебряной соли применяются в медицине для прижигания под именем «адского камня» (lapis infemalis) или «ляписа».
Сернокислое серебро — бесцветное, растворимое в воде соединение. Из водного раствора может быть получено в кристаллической форме.
Из растворов серебра в крепкой серной кислоте кристаллизуется кислая соль AgHSO4. Водой эта соль разлагается.
Галоидные соли серебра AgF, AgCl, AgBr, AgJ образуются обменным разложением соответствующих гадоидоводородных кислот с раствором азотнокислого серебра. Растворимо в воде только фтористое серебро, остальные нерастворимы и выпадают в виде творожистых осадков. AgCl — белого цвета; AgBr и AgJ — желтоватого. Галоидные соединения серебра на свету изменяются с выделением свободных галоидов. Это свойство широко используется в фотографии.
Хлористое серебро AgCl практически нерастворимо в воде. AgCl растворяется в соляной кислоте с образованием комплексного соединения Н[AgCl2]
и очень хорошо растворяется в водном растворе аммиака с образованием комплексного соединения:
Получающийся хлор аммиакат серебра легко растворим в воде. (При стоянии раствора аммиак постепенно испаряется, и хлористое серебро выпадает в форме хорошо образованных кристаллов.
Серноватистонатриевая соль Na2S2O3 (гипосульфит) также реагирует с хлористым серебром:
давая растворимую в воде двойную соль.
Аналогичная реакиия с образованием растворимой соли серебра идет с синеродистыми солями. Например:
AgCl + 2КСN = К•[Ag(CН)2] + КСl.
При сплавлении хлористого серебра с содой хлористое серебро разлагается:
2AgCl + Na2O2 = 2Ag + 2NaCl + СO2+ 1/2O2
Этой реакцией пользуются для получения металлического серебра из его хлорида.
Хлористое серебро плавится при 455° и после охлаждения затвердевает в легкую массу, режущуюся ножом (роговое серебро).
Бромистое и йодистое серебро «повторяют свойства хлористого с той только разницей, что с аммиаком и гипосульфитом реакции идут труднее, а йодистое серебро с аммиаком не реагирует.
Синеродистое серебро AgCN получается по реакции:
Оно нерастворимо в воде, но легко растворяется в избытке раствора цианистых солей с образованием комплексных цианидов:
Аналогичным образом образуются и другие двойные цианиды серебра: Ca[Ag(CN)2]2, Na[Ag(CN)2]2 и пр.
Металлическое серебро в присутствии кислорода растворяется, в цианистых солях с образованием двойных цианидов серебра:
4AgNO3 + 8KCN + O2 + 2H2O= 4К[Ag(CN)2] + 4KON
Этой реакцией пользуются при извлечении серебра из руд.
Роданистое серебро получается по реакции:
AgNO3 + KCNS = AgCNS +KNO3
Оно нерастворимо в воде; растворяется в растворах роданистых солей с образованием комплексных роданидов типа Ме [Ag(CNS)2], где Ме = Na, К и т. д.
Хромовокислое серебро Ag2CrO4, красного цвета, практически нерастворимо в воде, растворяется в аммиаке, и азотной кислоте.
Двухромовокислое серебро Ag2CrO7, краснобурого цвета, растворяется в аммиаке и азотной кислоте. Углекислое серебро Ag2CO3, белого цвета, выпадает при реакции:
2AgNO3 + Na2CO3 = Ag2CO3 + 2NaNO3
при кипячении желтеет вследствие частичного разложения:
Ag2CO3= Ag2O + CO2
При пропускании ацетилена через щелочной раствор азотно¬кислого серебра получается ацетиленистое серебро, или карбид серебра AgC2, который обладает взрывчатыми свойствами и в сухом состоянии взрывает даже при умеренном растирании в ступке.
- Аффинаж золота, серебра и металлов платиновой группы, Серебро
- Свойства металлов, Серебро
Оставить комментарий Отменить

Справочник содержания драгоценных металлов. Содержание вторичных драгоценных металлов (золота, серебра, платины, палладия и других ценных металлов) в автомобилях, средствах связи, приборах, реле, конденсаторах, радиостанциях, компьютерах, разъемах, розетках и т.д
Источник: dragomet.ru
Металл серебро

ФИЗИЧЕСКИЕ СВОЙСТВА
СЕРЕБРА
Чистое серебро —тяжёлый
(легче свинца, но тяжелее
меди), необычайно
пластичный серебристобелый металл
C течением времени металл
тускнеет, реагируя с содержащимися
в воздухе следами сероводорода и
образуя налёт сульфида, чья тонкая
пленка придает тогда металлу
характерную розоватую окраску.
3. Свойства
СВОЙСТВА
Кристаллическая структура: кубическая
. Серебро с поверхности довольно быстро
окисляется на воздухе, при этом цвет
поверхности изменяется до чёрного с отливом
различных оттенков. Весьма пластичное,
гибкое, ковкое. Обладает максимальной
среди металлов тепло- и
электропроводностью, растворяется в азотной
кислоте, при добавлеии НСl дает белый
творожистый осадок хлорида серебра (АgCl),
от сероводорода (Н2S) чернеет.
4. Основные диагностические признаки
ОСНОВНЫЕ
ДИАГНОСТИЧЕСКИЕ ПРИЗНАКИ
Серебро
узнается по цвету, блеску,
характерному излому, удельному
весу, ковкости. От платины серебро
отличается меньшими удельным
весом и твёрдостью. Часто
сопровождающие серебро
акантит и аргентит характеризуются
более темным свинцово-серым
или черным цветом.
5. Разновидности серебра
РАЗНОВИДНОСТИ
СЕРЕБРА
Серебро образует с золотом неограниченные
твердые растворы. По соотношению золота и
серебра выделяется следующий ряд: самородное
золото (серебра 0-30%) — электрум (серебра 3070%) — кюстелит (серебра 70-90%) — самородное
серебро (серебра более 90%).
6. Форма нахождения
ФОРМА НАХОЖДЕНИЯ
Наряду с серебросодержащими минералами самородное
серебро входит в состав серебряных руд, но главную массу
этого металла извлекают из полиметаллических руд, где
серебро присутствует в виде изоморфной или тонкой
рассеянной примеси в сульфидах, главным образом в
галените (серебро-свинцовые месторождения Нерчинском
рудного района в Восточном Забайкалье, м-ния
Дальнегорского рудного поля в Приморье и др.).
В зоне окисления серебро неустойчиво. На его поверхности
быстро образуется чёрный налёт акантита. Несмотря на это
самородки серебра иногда встречаются в россыпях.
7. История открытия
ИСТОРИЯ ОТКРЫТИЯ
Серебро известно человечеству с
древнейших времён. Это связано с тем,
что в своё время серебро, равно как и
золото, часто встречалось в
самородном виде — его не
приходилось выплавлять из руд
Еще тогда люди знали, что серебро
обладает бактерицидным действием. Во
времена похода Александра
Македонского в Индию, на его воинов,
пивших воду из естественных водоемов,
обрушились желудочно-кишечные
инфекционные
заболевания. Но что интересного, болели только простые
воины, которые пили воду из оловянных сосудов, а
командный состав из серебряных. Оказалось, что это
серебро растворяется в воде, при этом образуется
коллодий, обладающий высоким бактерицидным
действием.
8. История открытия
ИСТОРИЯ ОТКРЫТИЯ
За 2500 лет до нашей эры в
Древнем Египте носили
украшения и чеканили монеты
из серебра, считая, что оно
дороже золота.
В древней Руси мерой стоимости
различных предметов являлись бруски
серебра. В случаях, когда тот или иной
предмет торговли стоил меньше всего
бруска, от бруска отрубали часть,
соответствующую стоимости вещи. Эти
отрубленные части назывались «рублями»
9. Месторождения серебра
10. Месторождения серебра
МЕСТОРОЖДЕНИЯ СЕРЕБРА
Крупные месторождения по добыче серебра в Мире:
1.CanningtonBHP Billiton (Австралия)
48,80
2.Fresnillo (Proano) Industrias Penoles SA de CV (Мексика) 33,93
3.Дукат «Полиметалл» (Россия)
13,42
4.UchucchacuaCompania de Minas Buenaventura SA (Перу)
10,21
5.Greens CreekKennecott Minerals / Hecla Mining (США)
9,66
Лидеры по добыче
серебра в 2011г:
1. Мексика
4500т
2. Перу
4000т
3. Китай
4000т
4. Австралия
1900т
5. Чили
1400т
11. Применение
По оценкам экспертов в
мире к середине 90-х годов
XX в. накоплено примерно
630-640 тыс. т серебра,
основная часть которого (550
тыс. т) содержится в
ювелирных и декоративных
изделиях, столовом серебре
и церковной утвари. В
слитках находится около 45
тыс. т, в виде монет и
медалей – 40 тыс. т серебра.
Однако в XX-XXI веке более
70% серебра расходуется
уже на промышленные цели,
т.е. из металла, служившего
главным образом для
производства монет,
украшений и бытовой
утвари, серебро
превратилось в
«промышленный» металл.
ПРИМЕНЕНИЕ
12. Применение
ПРИМЕНЕНИЕ
Основными свойствами, благодаря которым серебро
так широко используется промышленностью, являются:
— высокая электро- и теплопроводность
— устойчивость к окислению в обычной среде
— большая пластичность
— высокий коэффициент отражения света.
— Из-за отличной электропроводности серебро широко
применяется в электронике и электротехнике.
— Для создания катодов используемых в батарейках и
аккумуляторах.
— В химической промышленности серебро незаменимо в
качестве катализатора в процессе создания двух
соединений: оксида этилена и формальдегида.
Источник: ppt-online.org
Серебро — Ag — презентация
Студент: Алексеева Т.М. Группа: С5-10-1 Преподаватель: Хайруллина Р. Т.

Изображение слайда
Слайд 2: Содержание
1) История: а)открытие б)название 2) Легенды и мифы 3) Месторождения серебра 4) Применение 5) Свойства серебра: а) физические б) химические 6) Пробы серебра 7) Клеймение изделий 8) Список литературы

Изображение слайда
Слайд 3: История открытия
Серебро известно человечеству с древнейших времён. Это связано с тем, что в своё время серебро, равно как и золото, часто встречалось в самородном виде — его не приходилось выплавлять из руд Еще тогда люди знали, что серебро обладает бактерицидным действием. Во времена похода Александра Македонского в Индию, на его воинов, пивших воду из естественных водоемов, обрушились желудочно-кишечные инфекционные заболевания. Но что интересного, болели только простые воины, которые пили воду из оловянных сосудов, а командный состав из серебряных. Оказалось, что это серебро растворяется в воде, при этом образуется коллодий, обладающий высоким бактерицидным действием.

Изображение слайда
Слайд 4: История открытия
За 2500 лет до нашей эры в Древнем Египте носили украшения и чеканили монеты из серебра, считая, что оно дороже золота. В древней Руси мерой стоимости различных предметов являлись бруски серебра. В случаях, когда тот или иной предмет торговли стоил меньше всего бруска, от бруска отрубали часть, соответствующую стоимости вещи. Эти отрубленные части назывались «рублями «

Изображение слайда
Слайд 5: История названия
Свое название серебро ведет от санскритского слова «аргента», что значит «светлый». От слова аргента произошло и латинское «аргентум». Латинское название серебра « аргентум » как древнегреческое «аргитос», шумерское «ку-баббар» и древнеегипетское «хад», означает «БЕЛОЕ».

Изображение слайда
Слайд 6: История названия
Внешний вид и цвет металла объясняют то, что его называли серебром не только на древнеегипетском, ассирийском, древнегреческом, армянском и латинском языках, но и на некоторых новых языках. Филологи полагают, что романские названия серебра произошли от греч. (корень арг по-санскритски означает пылать, быть светлым), тоже связанного с санскритским arjuna (свет), rajata (белый).

Изображение слайда
Слайд 7: Легенды и мифы
В наше время пишут книги и снимают фильмы об оборотнях “ верфульвах ”, или как называли их на Руси “ вурдалаки ”, в которых главным способом убийства подобных монстров служит серебряная пуля или кинжал. Особенные свойства серебро приобретает после принятия христианства, когда становится “ освященным ” металлом.

Изображение слайда
Слайд 8: Месторождения серебра
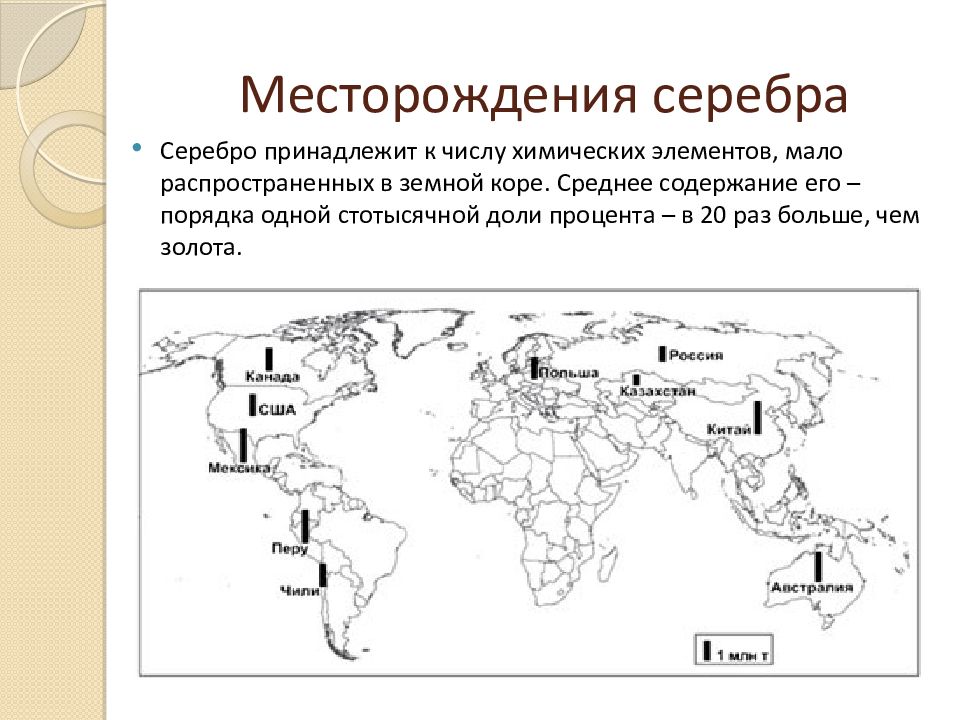
Изображение слайда
Слайд 9: Месторождения серебра
Крупные месторождения по добыче серебра в Мире: 1.CanningtonBHP Billiton ( Австралия ) 48,80 2. Fresnillo (Proano ) Industrias Penoles SA de CV ( Мексика ) 33,93 3.Дукат«Полиметалл » ( Россия) 13,42 4. UchucchacuaCompania de Minas Buenaventura SA ( Перу) 10,21 5. Greens CreekKennecott Minerals / Hecla Mining ( США ) 9,66 Лидеры по добыче серебра в 2011г: 1. Мексика 4500т 2. Перу 4000т 3. Китай 4000т 4. Австралия 1900т 5. Чили 1400т

Изображение слайда
Слайд 10: Месторождения серебра
По данным геологической службы США, мировые запасы серебра составляют 512 тысяч тонн. По оценкам экспертов этих мировых запасов должно хватить еще на 22 года. Следует отметить, что серебро обладает превосходными техническими характеристиками и широкомасштабно используется в промышленности. А спрос на него не только уже долгое время превышает предложение, но и прогнозировано растет.

Изображение слайда
Слайд 11: Применение
По оценкам экспертов в мире к середине 90-х годов XX в. накоплено примерно 630-640 тыс. т серебра, основная часть которого (550 тыс. т) содержится в ювелирных и декоративных изделиях, столовом серебре и церковной утвари. В слитках находится около 45 тыс. т, в виде монет и медалей – 40 тыс. т серебра. Однако в XX-XXI веке более 70% серебра расходуется уже на промышленные цели, т.е. из металла, служившего главным образом для производства монет, украшений и бытовой утвари, серебро превратилось в «промышленный» металл.

Изображение слайда
Слайд 12: Применение
Основными свойствами, благодаря которым серебро так широко используется промышленностью, являются: — высокая электро- и теплопроводность — устойчивость к окислению в обычной среде — большая пластичность — высокий коэффициент отражения света. — Из-за отличной электропроводности серебро широко применяется в электронике и электротехнике. — Для создания катодов используемых в батарейках и аккумуляторах. — В химической промышленности серебро незаменимо в качестве катализатора в процессе создания двух соединений: оксида этилена и формальдегида.

Изображение слайда
Слайд 13: Технология получения
Цианирование — основан на растворении металла в водных растворах цианистых щелочей. На минерал действуют цианидом и кислородом воздуха. С еребро с кислородом не реагирует. Оно покрывается тонкой устойчивой пленкой оксида. Если присутствует цианид, то оксид немедленно растворяется.
Образуется комплексный ион. Получают серебросодержащий раствор, из которого после отфильтрации пустой породы металлическими осадителями (цинковой пылью) осаждают серебро. Затем раствором серной кислоты удаляют примеси из осадка. Оставшуюся пульпу промывают, фильтруют, выпаривают, а затем сплавляют. После получения серебряных слитков их отправляют для дальнейшей очистки на аффинажные заводы.

Изображение слайда
Слайд 14: Технология получения
Амальгамация основана на способности серебра или золота при нормальных условиях вступать в соединение со ртутью, в которой уже растворено небольшое количество серебра. Измельченную руду пропускают вместе с водой по амальгамированной поверхности ртути. В результате частицы серебра, смачиваясь ртутью, образуют полужидкую амальгаму, из которой путем отжима избытка ртути получают твердую часть амальгамы. Ее состав может иметь 1 ч. золота и 2 ч. ртути. После такой фильтрации ртуть испаряют, а оставшееся золото сплавляют в слитки.

Изображение слайда
Слайд 15: Технология получения
Пирометаллургический метод. Аноды из «сырой» меди погружают в электролитические ванны и проводят электролиз. Медь растворяется на аноде и оседает на тонком катоде, а серебро оседает на дно ванны, образуя так называемый «штамп», из которого его и выделяют. Сырой свинец для извлечения из него примеси серебра обрабатывают цинком. Процесс ведется при высокой температуре (450*С).
Серебро лучше растворимо в расплавленном цинке, чем в свинце, и потому переходит в верхний цинковый слой. Расплав расслаивается, и, отделив цинковый слой, захвативший серебро, мы получаем возможность сконцентрировать ценный металл. Свинец отжимают, и остаток перегоняют из графитовой реторты при 1250*С. Цинк улетучивается при этой температуре и в остатке получается серебро, содержащее все-таки примеси свинца, мышьяка и других веществ. Обработка кислородом при 1000*С переводит стояние и в наклонном желобе стекает с поверхности серебра.

Изображение слайда
Слайд 16: Физические свойства серебра
СЕРЕБРО ( Ag « argentum ») – элемент 11 группы, пятого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 47. Серебро — белый блестящий металл, с кубической гранецентрированной решеткой, a = 0,4086 нм. Атомный радиус 1,44 Å Ионный радиус Ag+ 1,13 Å Плотность при 20 °С 10,5 г/см 3 t пл 960,8 ° С T кип 2212 °С ; Теплота плавления 105 кДж/кг (25,1 кал/г ). Серебро обладает наивысшими среди металлов удельной электропроводностью 6297 сим/м (62,97 ом -1 ·см -1 ) при 25 °С, теплопроводностью 407,79 Вт/(м·К.)

Изображение слайда
Слайд 17: Физические свойства серебра
Чистое серебро —тяжёлый (легче свинца, но тяжелее меди), необычайно пластичный серебристо-белый металл C течением времени металл тускнеет, реагируя с содержащимися в воздухе следами сероводорода и образуя налёт сульфида, чья тонкая пленка придает тогда металлу характерную розоватую окраску.

Изображение слайда
Слайд 18: Химические свойства серебра
По своей химической активности серебро занимает промежуточное положение между золотом и медью. С кислородом серебро непосредственно не соединяется, но в расплавленном состоянии растворяет около 20 объемов кислорода на один объем металла. В твердом серебре растворимость кислорода мала, поэтому при затвердевании расплавленного серебра происходит выделение растворенного в нем кислорода, сопровождающееся иногда разбрызгиванием металла.

Изображение слайда
Слайд 19: Химические свойства серебра
С водородом, азотом и углеродом серебро непосредственно не взаимодействует. Фосфор действует на серебро лишь при температуре красного каления с образованием фосфидов. При нагревании с серой серебро легко образует сульфид Ag 2 S. Это же соединение получается при действии на серебро газообразной серы, выделяющейся при термической диссоциации некоторых сульфидов (пирита, пирротина, халькопирита), и при нагреве металла в контакте с этими сульфидами.

Изображение слайда
Слайд 20: Химические свойства серебра
Качественные реакции на хлорид-, бромид- и йодид-ионы Галогенид-ионы можно определить с помощью нитрата серебра AgNO 3. П робирки с иодидом калия KI, бромидом натрия NaBr, хлоридом натрия NaCl. Добавляем нитрат серебра. В пробирках появляются творожистые осадки нерастворимых галогенидов серебра. Осадок хлорида серебра — белого цвета NaCl + AgNO 3 = AgCl ↓ + NaNO 3

Изображение слайда
Слайд 21: Химические свойства серебра
Осадок бромида серебра -бледно-желтого цвета NaBr + AgNO 3 = AgBr ↓+ NaNO 3 Осадок иодида серебра — желтого цвета. KI + AgNO 3 = AgI ↓+ KNO 3 Реакция с нитратом серебра – качественная реакция на хлорид-, бромид- и иодид-ионы.

Изображение слайда
Слайд 22: Пробы серебра
Проба серебра означает соотношение драгоценного металла и металлов, которые добавляют в сплав серебра (лигатура). Делают это для улучшения физических свойств этого драгоценного металла, например для повышения износостойкости, которая в свою очередь предохраняет ювелирное изделие от истирания и как следствие увеличивает срок службы. В качестве такой лигатуру чаще всего используют медь, но так же могут применять и другие металлы: никель, кадмий, алюминий и цинк.

Изображение слайда
Слайд 23: Клеймение изделий
Для серебра существуют лотовая, метрическая и золотниковая пробы. Если изделие изготовлено в конце XIX — начале XX в., пробирное клеймо — в золотниковой системе (пробы 78; 84; 90). Если изделие было произведено до конца XIX в., то оно имело оттиск римскими цифрами — Лотовой пробой. Условно чистое серебро соответствует 16 лотам.
Источник: showslide.ru