ПАЛЛАДИЙ, Pd, элемент 8-й группы периодической системы, аналог родия и рутения — образует вместе с ними триаду легких платиновых металлов; атомный вес 106,7, порядковый номер 46, атомный объем 9,0. Палладий — металл серебристо-белого цвета, мягче и легче плавится, чем платина; легко вытягивается в проволоку и раскатывается в листы.
Подобно платине палладий может быть получен в виде губки и черни. Вильм получил палладистую губку, накаливая PdCl2·2NH3. В коллоидной форме палладий образует черные блестящие волокна (тонкие металлические пластинки), легко растворимые в воде; гидрозоль палладия — тёмно-коричневого цвета, в тонком слое прозрачный; получается восстановлением солей палладия водородом, гидратом гидразина и др.; в качестве защитного коллоида употребляются продукты распада яичного белка (протальбиновая и лизальбиновая кислоты), гуммиарабик, отвар исландского моха. Удельный вес литого палладия (при 22,5°С) 11,4, кованого 11,9; твердость по шкале Моса 4,0; модуль упругости (1,00—1,43)·10 -6 мг/см 2 ; предельное сопротивление на разрыв 21 кг/мм 2 ; сжимаемость 0,6·10 -6 мм 2 /кг; температура плавления 1557°С; в вакууме палладий перегоняется при 735°С. Коэффициент линейного расширения (при 50°С) 1,186·10 -5 ; теплопроводность чистого палладия (при 100°С) 0,1817 cal cм/см 2 сек.°С; теплота плавления 36,3 cal/ч.; удельная теплоемкость (при 100°С) 0,0617 cal/ч.; электропроводность (при 0°С) 9,8·10 4 мо; температурный коэффициент сопротивления (при 0—100°С) 354·10 -5 ; магнитная восприимчивость (при 18°С) +5,8·10 -6 .
Палладий сколько добывается в мире за год.Где применяется палладий#shorts #shorts
Палладий характеризуется высокой способностью окклюдировать водород. Чистый металл (нагретый до 100°С и затем охлажденный) поглощает 600-кратный объем водорода, не теряя металлического вида; палладиевая чернь адсорбирует 873 объема Н2 (при 15°С и нормальном давлении); чернь, суспендированная в воде — 1200 объемов; коллоидный раствор палладия — около 3000 объемов; поглощение Н2 сопровождается выделением тепла (на 1 г водорода — 4200 cal) и увеличением объема металла (приблизительно на 10%).
Образующийся продукт носит название водородистого палладия; представляет ли он твердый раствор Н2 в палладии или же содержит определенные химические соединения вопрос не решенный. При накаливании и уменьшении давления окклюдированный в палладий газ выделяется; при 40—50°С уходит большая часть газа; при накаливании до 440°С весь газ освобождается; водородистый палладий отдает в вакууме до 92% своего водорода.
Сплавы палладия с серебром (до 40% Ag) поглощают водород так же легко, как и чистый палладий. Палладиевая чернь, нагретая в токе кислорода, поглощает около 1000 объемов газа, превращаясь в тёмно-коричневую модификацию, содержащую вероятно окись палладия, PdO. В тонкоразмельченном и коллоидном состоянии палладий поглощает также ацетилен.
С окисью углерода палладий дает довольно прочное соединение, диссоциирующее при 250°С. Соединения четырехвалентного палладия, типа PdX4 неустойчивы и за исключением PdО2 в чистом виде не были выделены, чем палладий отличается от платины; двухвалентный палладий дает соединения типа PdX2. Так же как и платина, палладий легко образует комплексные соединения. В отличие от других платиновых металлов палладий легко растворяется в кислотах — в азотной кислоте на холоде, легче при нагревании, причем раствор окрашивается в буро-красный цвет, растворяется в крепкой соляной и серной кислотах и в йодистоводородной кислоте с выделением водорода. В природе палладий сопутствует платине гл. образом в рудах Бразилии.
золото, платина, серебро, палладий.
Аналитическое определение палладия , производят цианистой ртутью; при действии ее на растворы солей палладия выпадает белый желатиноподобный осадок цианистого палладия. Pd(CN)2; при действии раствора йодистого калия получается тёмно-коричневый осадок йодистого палладия. Красный раствор корня алканны от прибавления незначительного количества хлористого палладия становится сперва оранжево-желтым, затем стально-серым и наконец — зеленым; чувствительной реакцией на палладий является α-нитрозо-β-нафтол, дающий с соединениями палладия коричнево-красный осадок.
Применение палладия . Благодаря способности поглощать и активировать водород палладий применяют в разнообразнейших реакциях гидрирования органических ненасыщенных соединений; в последнее время для этих целей стали применять более дешевый никель. Палладий является лучшим катализатором при окислении SО2 в SО3. Сплав палладия с серебром применяют в зубоврачебной технике; сплав из 80 ч. золота и 20 ч. палладия употребляют для изготовления частей часовых механизмов. Т. к. на воздухе палладий не чернеет и не тускнеет, то им покрывают металлические лимбы астрономических и других точных инструментов, на которых нанесенные деления должны оставаться отчетливыми. Покрытие металлов палладием (палладирование) производят гальванотехническим путем, применяя палладий в виде хлористого палладия, PdCl2, или его соединения с аммиаком, PdCl2·2NH3.
Соединения палладия . Наиболее важное значение имеет хлористый палладий, PdCl2, коричнево-красные кристаллы, получающиеся растворением палладиевой губки в соляной кислоте: реакцию можно ускорить, введя непосредственно в раствор хлор; с щелочными металлами PdCl2 дает двойные соли, формулы PdCl2·2МеСl; PdCl2 применяется как чувствительный реактив на окись углерода, СО, которая его восстанавливает до металла; PdCl2 применяется и для покрытия металлов палладием гальванотехническим путем и в медицинской практике при лечении туберкулеза. Йодистый палладий, PdJ2, получается из растворов солей палладия действием йодистого калия, KJ, в виде характерного черного осадка, нерастворимого в воде и щелочах, но легко растворимого в избытке раствора KJ (раствор коричневого цвета).
Соединения Pd отвечают двум степеням окисления PdO и PdО2 сами окислы в высшей степени неустойчивы; PdО2 неизвестна в свободном состоянии, a PdO действием водорода легко восстанавливается до металла. Гидроокись палладия , Pd(OH)2, получается из растворов солей Pd (чаще PdCl2) действием соды или щелочей; из раствора Pd(OH)2 выпадает в виде коричневого аморфного порошка, растворимого в кислотах.
Цианистый палладий , Pd(CN)2, светло-жёлтый аморфный порошок, не растворяется в воде, легко растворяется в аммиаке. Комплексные соединения палладия по составу и свойствам аналогичны и часто изоморфны комплексным соединениям платины.
Палладий образует три типа этих соединений: М2(PdX2),M2(PdX4) и М2(PdX6); третий тип легко переходит во второй, чем палладий отличается от платины. Наиболее устойчивы аммиачные соединения палладия. Палладозамминовое соединение , PdCl2·2NH3, выпадает в виде осадка из аммиачного раствора окиси палладия при действии соляной кислоты, в холодной воде нерастворимо, при накаливании дает палладиевую губку. Из синеродистых солей палладия известны только соли типа M2Pd(CN)4.
Источник: Мартенс. Техническая энциклопедия. Том 15 — 1931 г.
Источник: azbukametalla.ru
ПАЛЛАДИЙ
ПАЛЛАДИЙ (назван в честь открытия планеты Паллада; лат. Palladium) Pd, хим. элемент VIII гр. периодич. системы, ат. н. 46, ат. м. 106,42; относится к платиновым металлам. Природный палладий состоит из шести стабильных изотопов: 102 Pd (1,00%), 104 Pd (11,14%), 105 Pd (22,33%), 106 Pd (27,33%), lo8 Pd (26,46%) и 110 Pd (11,72%). Наиб. долгоживущий искусств. радиоактивный изотоп 107 Pd (Т 1/2 7·10 6 лет).
Мн. изотопы палладия в сравнительно больших кол-вах образуются при делении ядер U и Pu. В совр. ядерных реакторах в 1 т. ядерного топлива при степени выгорания 3%, содержится 1,5 кг палладия. Поперечное сечение захвата тепловых нейтронов ок. 8·10 -28 м 2 . Конфигурация внеш. электронной оболочки атома 4d 10 ; степени окисления 0, +1, +2 (наиб. часто), +3, + 4 (часто), +5, +6 (очень редко); энергия ионизации Pd 0 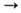 -> Pd +
-> Pd +  Pd 2+
Pd 2+  Pd 3+ соотв. равна 8,336, 19,428 и 32,92 эВ; электроотрицательность по Полингу 2,2; атомный радиус 0,137 нм, ионные радиусы (в скобках даны координац. числа) Pd +f 0,073 нм (2), Pd 2+ 0,078 нм (4, квадрат), 0,100 нм (6), Pd 3 + 0,090 нм (6).
Pd 3+ соотв. равна 8,336, 19,428 и 32,92 эВ; электроотрицательность по Полингу 2,2; атомный радиус 0,137 нм, ионные радиусы (в скобках даны координац. числа) Pd +f 0,073 нм (2), Pd 2+ 0,078 нм (4, квадрат), 0,100 нм (6), Pd 3 + 0,090 нм (6).
П алладий-один из наиб. редких элементов, его средняя концентрация в земной коре 1·10 -6 % по массе. Встречается в самородном виде, в виде сплавов и соединений. Известно ок. 30 минералов, содержащих палладий: аллопалладий (содержит примеси Hg, Pt, Ru, Сu), палладистая платина (7-39% палладия), палладит PdO, станнопалладинит Pd 3 Sn 2 , стибиопаллади-нит Pd 3 Sb (содержит примеси PtAs 2 ), брэггит (Pd, Pt, Ni) S (16-20% палладия) и др. Кол-во палладия в смеси платиновых металлов в разл. месторождениях колеблется от ~25% (ЮАР) до 43-45% (Канада) и 60% (СССР, по оценкам).
Свойства. Палладий-серебристо-белый металл с гранецентрир. кубич. решеткой типа Сu, а = 0,38902 нм, z = 4, пространств. группа Fm3m; т.пл. 1554°С, т. кип. 2940 °С; плотн.
12,02 г/см 3 ; 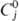 25,8 Дж/моль • К);
25,8 Дж/моль • К);  16,7 кДж/моль,
16,7 кДж/моль, 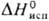 353 кДж/моль;
353 кДж/моль; 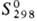 37,65 Дж/моль·К); температурный коэф. линейного расширения 1,17·10 -5 К -1 (273-373 К);
37,65 Дж/моль·К); температурный коэф. линейного расширения 1,17·10 -5 К -1 (273-373 К); 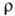 9,96 мкОм • см (25 °С); теплопроводность 75,3 Вт/(м·К); g 0,015 Н/см (при 1554°С в вакууме, палладий 99,998%-ной чистоты); парамагнетик, уд. магн. восприимчивость + 5,231 · 10 -б (20 °С); работа выхода электрона 4,99 эВ. Для отожженного палладия модуль упругости 117 ГПа, сг 1,8-2,0 ГПа, относит. удлинение 25-40%; твердость по Виккерсу 37-39.
9,96 мкОм • см (25 °С); теплопроводность 75,3 Вт/(м·К); g 0,015 Н/см (при 1554°С в вакууме, палладий 99,998%-ной чистоты); парамагнетик, уд. магн. восприимчивость + 5,231 · 10 -б (20 °С); работа выхода электрона 4,99 эВ. Для отожженного палладия модуль упругости 117 ГПа, сг 1,8-2,0 ГПа, относит. удлинение 25-40%; твердость по Виккерсу 37-39.
Палладий упрочняется при холодном деформировании, но становится мягче после отжига. Добавки нек-рых в-в, особенно Ru и Ni, повышают твердость. Палладий легко поддается ковке, штамповке, прокатке, протяжке, хорошо полируется и сваривается. Из него удается получать тончайшие листы и тонкую проволоку.
По хим. св-вам палладий близок к платине и является наиб. активным платиновым металлом. При нагр. устойчив на воздухе до ~ 300 °С, при 350-800 °С тускнеет из-за образования тонкой пленки PdO, выше 850 °С PdO разлагается и вновь становится устойчивым на воздухе. Хорошо раств. в царской водке. В отличие от др. платиновых металлов, раств. в горячих конц.
HNO 3 и H 2 SO 4 . Переходит в р-р при анодном растворении в соляной к-те. При комнатной т-ре взаимод. с влажными Сl 2 и Вг 2 , при нагр.-с F 2 , S, Se, Те, As и Si. Характерная особенность палладия-способность поглощать большие кол-ва Н 2 (до 900 объемов на 1 объем палладия) благодаря образованию твердых р-ров с увеличением параметра кристаллич. решетки; предполагается также образование гидридов.
Поглощенный Н 2 легко удаляется из палладия при нагр. до 100 °С в вакууме. Явления, наблюдаемые при поглощении тяжелого изотопа водорода катодом из палладия в ходе электролиза D 2 O, принимались за свидетельство, «холодного» ядерного синтеза. Палладий взаимод. с расплавл. KHSО 4 , с Na 2 O 2 .
Черный нерастворимый в воде оксид PdO 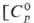 31 ДжДмоль • К),
31 ДжДмоль • К), 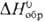 -15 кДж/моль,
-15 кДж/моль, 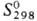 39 ДжДмоль • К)] разлагается на простые в-ва выше 800-850 °С; сильный окислитель. Гидролизом солей Pd(II,III,IV) выделены соотв. черный Pd(OH) 2 (
39 ДжДмоль • К)] разлагается на простые в-ва выше 800-850 °С; сильный окислитель. Гидролизом солей Pd(II,III,IV) выделены соотв. черный Pd(OH) 2 ( 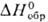 —161,1 кДж/моль), шоколад-но-черный Pd 2 O 3 ·nH 2 O и темно-красный PdO 2 . Оксиды Pd(III,IV)-сильные окислители; при небольшом нагр. разлагаются до PdO.
—161,1 кДж/моль), шоколад-но-черный Pd 2 O 3 ·nH 2 O и темно-красный PdO 2 . Оксиды Pd(III,IV)-сильные окислители; при небольшом нагр. разлагаются до PdO.
Гексафторид PdF 6 получают взаимодействием палладия с атомным F, красно-коричневый тетрафторид PdF 4 -фто-рированием Pd 2 F 6 под давлением F 2 при 300-450 °С, черный «три фторид» Pd II Pd IV F 6 и бледно-фиолетовый д и фторид PdF 2 — взаимодействием палладия или его галогенидов с F 2 . Фториды палладия-сильные окислители, термически неустойчивы и легко гидролизуются водой. Существуют фторопаллада-ты(II и III) состава 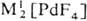
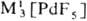 M II [PdF 4 ],
M II [PdF 4 ], 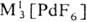 и др. Взаимодействием PdF 6 с О 2 получен оранжевый гексафторопалладат(V) диоксигенила O 2 PdF 6 .
и др. Взаимодействием PdF 6 с О 2 получен оранжевый гексафторопалладат(V) диоксигенила O 2 PdF 6 .
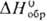
Дихлорид PdCl 2 -красные кристаллы гексагон. синго-нии (т. пл. 680 °С, —163 кДж/моль); легко раств. в воде, в соляной к-те, давая тетрахлоропалладие-вую(II) к-ту H 2 [PdCl 4 ]; получают из простых в-в выше 500 °С.
При растворении в царской водке палладий образует гекса-хлоропалладиевую(IV) к-ту H 2 [PdCl 6 ], разлагающуюся при кипячении до Н 2 [PdCl 4 ] и Сl 2 . Выделены многочисл. хлоропалладаты(IV) M 2 [PdCl 6 ] и хлоропалладаты(II) M 2 [PdCl 4 ], а также их производные, св-ва к-рых используют для выделения и аффинажа палладия. Так, в хлоридном р-ре, содержащем NH 3 , палладий может образовывать плохо р-римый хлоропалладозамин Pd(NH 3 ) 2 Cl 2 (слабокислая среда), нерастворимую соль Вокелена [Pd(NH 3 ) 4 ] [PdCl 4 ] или р-римый дихлорид тетрамминопалладия (II) Pd(NH 3 ) 4 Cl 2 (сильно щелочная среда). Р-р солей Pd 2+ сначала сильно подщелачивают, отделяя осадки гидроксидов металлов (примесей), а затем подкисляют, выделяя палладий в осадок. Осадок Pd(NH 3 ) 2 Cl 2 термически разлагают при 800-900 °С до металла.
Коричневый дибромид PdBr 2 (т.пл. 717°С, 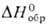 — 120 кДж/моль) плохо раств. в воде, лучше-в бромисто-водородной к-те. Его получают растворением Pd в смеси бромистоводородной к-ты и Вг 2 . Черный дииодид PdI 2 (
— 120 кДж/моль) плохо раств. в воде, лучше-в бромисто-водородной к-те. Его получают растворением Pd в смеси бромистоводородной к-ты и Вг 2 . Черный дииодид PdI 2 ( 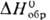 — 63 кДж/моль) не раств. в воде, осаждается из р-ров PdCl 2 , образует иодопалладаты(II), напр. K 2 [PdI 4 ].
— 63 кДж/моль) не раств. в воде, осаждается из р-ров PdCl 2 , образует иодопалладаты(II), напр. K 2 [PdI 4 ].
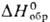
Сульфид PdS (т.пл. 970°С, -77,0 кДж/моль), дисульфид PdS 2 и др. сульфиды палладия не раств. в воде. Известны селениды PdSe, PdSe 2 , Pd 4 Se, теллуриды PdTe, PdTe 2 , Pd 2 Te, Pd 3 Te, Pd 5 Te 2 , фосфиды PdP 2 , Pd 3 P, Pd 5 P, Pd 5 P 2 , арсениды PdAs, Pd 2 As, Pd 3 As, Pd 3 As 2 , силициды PdSi, Pd 2 Si и Pd 3 Si.
Коричнево-желтый нитрат Pd(NO 3 ) 2 хорошо раств. в воде, гидролизуется при кипячении водного р-ра. Выделен темно-красный сульфат PdSO 4 , его оливково-зеленый моногидрат и красновато-коричневый дигидрат, к-рые легко гидролизуются.
П алладий в степени окисления + 2 образует многочисл. комплексные соед. с лигандами, содержащими «мягкие» доноры: CN — , P(III), As(III) и др. Для Pd(IV) наиб. типичны соед., содержащие ион [PdX 6 ] 2- (X = F, Cl, Вг). Известны соединения с нейтральными группами типа Pd(aмин) 2 X 4 и др. Получены комплексные соед. Pd 0 , напр. [Pd(CN) 4 ] 4- , Pd(PF 3 ) 4 (т.пл. — 40°С).
См. также Палладийорганические соединения.
Получение. Из технол. р-ра благородных металлов в царской водке сначала осаждают Аи и Pt. Затем осаждают Pd(NH 3 ) 2 Cl 2 , к-рый очищают перекристаллизацией из аммиачного р-ра НС1, высушивают и прокаливают в восстановит. атмосфере. Порошок палладия переплавляют. Восстановлением р-ров солей палладия получают мелкокристаллический палладий-палладиевую чернь. Электроосаждение палладия проводят из нитритных и фосфатных кислых электролитов, в частности с использованием Na 2 [Pd(NO 2 ) 4 ].
В сер. 80-х гг. ежегодная добыча палладия в капиталистич. и развивающихся странах составляла 25-30 т. При этом из вторичного сырья получали не более 10% палладия. По оценкам 2 / 3 мировой добычи палладия падало на СССР.
Применение. По объему годового потребления в капиталистич. и развивающихся странах палладий опережает др. платиновые металлы. Из областей его применения наиб. важны медицина и стоматология (25-40% ежегодного потребления), электротехника и электроника (30-40%), хим. пром-сть (10-15%), автомобилестроение (5-15%), ювелирная (2-5%) и стекольная пром-сть и др.
Из палладия и его сплавов изготовляют мед. инструменты, детали кардиостимуляторов, зубные протезы, оправки, нек-рые лек. ср-ва. В электронике используют, в частности, палладиевые пасты для произ-ва больших интегральных схем, в электротехнике-электрич. контакты из палладия; для этих целей выпускают пружинящие контакты из палладия с добавками Сг и Zr, а также сплавы Pd-Ag и Pd-Cu.
Способность палладия растворять Н 2 используют для тонкой очистки Н 2 , каталитич. гидрирования и дегидрирования и др. Обычно для этого используют сплавы с Ag, Rh и др. металлами, а также палладиевую чернь. С сер. 70-х гг. 20 в. палладий в виде сплавов с Pt стали использовать в катализаторах дожигания выхлопных газов автомобилей.
В стекольной пром-сти сплавы палладия применяют в тиглях для варки стекла, в фильерах для получения искусств. шелка и вискозной нити.
П алладий открыл У. Волластон в 1803 при исследовании самородной платины.
Источник: xumuk.ru
Механизм и технология палладирования. Структура и свойства покрытий палладием.
1. Что такое палладий? Почему палладий сегодня дороже золота?
Палладий — благородный металл, платиноид, серебристого цвета. Он обладает самой маленькой плотностью и температурой плавления среди шести платиновых металлов.
Свойства палладия определили области его применения и очень высокую цену:
- Низкое переходное сопротивление. Палладий активно применяются в радиоэлектронной и компьютерной технике для обработки электроконтактов, разъемов и переключающих устройств с целью уменьшения переходного сопротивления. Малая его плотность означает, что 1 грамм палладия будет иметь максимальный объем среди платиноидов и, следовательно, расход металла на 1 мкм покрытия будет также минимальным.
- Каталитическая активность. Помимо электротехники палладий используется для увеличения скорости реакций гидрирования и дегидрирования, выполняет многие специализированные каталитические функции в органической химии. Автомобильные каталитические нейтрализаторы представляют собой основное применение палладия. В них палладий помогает преобразовывать оксид углерода СО, углеводороды и оксид азота в выхлопных газах автомобиля в более безопасную воду, азот и диоксид углерода СО2.
- Декоративные свойства. Палладий легкий, но при этом прочный, что особенно полезно для ювелирных изделий и часов. Кроме этого, палладий имеет высокую отражательную способность. Стоит заметить, что применение палладия в ювелирных украшениях — веяние моды, т.к., несмотря на прекрасные декоративные характеристики, можно найти более дешевые альтернативы, не уступающие ему по внешнему виду.
- Высокая микротвердость. Покрытия палладием имеют более высокую микротвердость и износостойкость, чем другими благородными металлами: серебром, золотом или платиной.
- Коррозионную стойкость. Палладий растворим только в царской водке, азотной кислоте и, медленнее, в соляной кислоте. По коррозионной стойкости палладий близок к золоту.
Кроме этого, палладий встречается в тест-полосках на сахар в крови и как покрытие на хирургическом инструменте.
Из негативных свойств палладия можно выделить следующее:
- Способность адсорбировать водород и органику. Данный фактор оказывает неблагоприятное влияние на прочность сцепления его с основным металлом. Также, палладий хорошо сорбирует органические продукты из воздуха, что повышает его переходное сопротивление. В герметизированной системе пленки полимерных продуктов на поверхности палладия могут оказать более заметное влияние на его переходное сопротивление, чем в открытых системах.
- Ограниченная термостойкость. Палладий имеет низкую температуру плавления и ограниченную термостойкость. Под воздействием высокой температуры палладий имеет тенденцию обесцвечиваться или даже деформироваться. Палладий часто не лучший выбор для компонентов, которые часто подвергаются сильному нагреву.
- Склонность к растрескиванию. Твердость палладия означает, что он в некоторой степени склонен к растрескиванию под нагрузкой ввиду высоких внутренних напряжений в покрытии. Можно снизить склонность палладия к растрескиванию путем легирования покрытия другими металлами.
- Цена. В прошлом основной причиной его использования была относительно низкая стоимость, в СССР он предполагался как замена серебра. Однако в последние годы его цена выросла настолько, что палладий стал дороже почти в 2 раза.
2. Электролиты палладирования.
Покрытия палладием наносятся гальванически. Обозначение гальванического палладирования — Пд. Для получения электролитических осадков палладия предложено множество электролитов, в которых осаждаемый металл находится в виде комплексных соединений. Даже когда в качестве исходного продукта используют обычные соли, они всё равно образуют комплекс, реагируя в растворе с другими компонентами. Так, например, PdCl2, растворяясь в НСl, дает соединение, анион которого имеет вид [PdCl4] 2 — .
Электрокристаллизация палладия может происходить как в кислой, так и в нейтральной и щелочной среде. Кислые электролиты не сильно распространены, поскольку они образуют темные пористые осадки с высоким внутренним напряжением. Нейтральные электролиты работают при температуре 25-35°C, pH=7.0-9.0, плотности тока 0,5-1,0 A/дм 2 и позволяют получать матовые и полублестящие твердые покрытия. Для получения блестящих и полублестящих осадков палладия наиболее часто используют щелочные растворы.
Самыми распространенными электролитами палладирования можно считать сульфаматный, фосфатный и аминохлоридный.
2.1 Сульфаматный электролит палладирования.
Осадки, полученные из таких ванн, имеют высокую отражательную способность и твердость. В этих электролитах можно получить покрытия с толщиной до 100 мкм из-за сравнительно низких внутренних напряжений. В состав раствора входит палладий (в виде аминопалладохлорида) 10-12 г/л, сульфамат аммония NH4NH2SO3 — 100 г/л. Электролит используется при рН = 7.5-8.3, температуре 30 о С и плотности тока 0,6-1,0 А/дм 2 .
Электролиз в этом электролите идет с использованием нерастворимых анодов, что приводит к необходимости частой корректировки ванн.
2.2 Аминохлоридный электролит палладирования.
Применяемые на производстве аминохлоридные электролиты отличаются между собой прежде всего концентрацией палладия, что сказывается на рабочем диапазоне плотностей тока. Составы электролитов (в г/л) и режимы работы приведены в таблице ниже:
Источник: zctc.ru