Распространенность в природе и природные источники. Содержание платиновых металлов в земной коре (% по массе): Pt 5•10 -7 , Pd 1•10 -6 , Ir 1•10 -7 , Rh 1•10 -7 , Os 5•10 -6 , Ru 5•10 -7 (по Виноградову).
Руды платиновых металлов бывают коренные и россыпные, а по составу — собственно платиновые и комплексные (мн. коренные месторождения медных и медно-никелевых сульфидных руд, россыпные месторождения Au с Pt, а также Au с осмистым Ir). Известно более 100 минералов платиновых металлов, они бывают двух типов.
В россыпях встречаются самородные Pd и Pt и различные сплавы, в т.ч. с другими платиновые металлы, Fe, реже-с Au (содержат также и др. металлы), например палладиевая платина, железистая платина (Pt, Fe), изоферроплатина Pt 3 Fe, плати-нистый палладий. осмистый иридий, иридиевая платина Pt 4 Ir 2 Fe, платинистый иридий Ir 4 Pt, осмистый иридий Ir 2 Os, ауроосмид (Ir, Os, Au) и др. Минералы второго типа — различные соединения платиновых металлов с S, Fe, As, Bi, Pb, напр, спериллит PtAs 2 , куперит PtS, брэгтит (Pt, Pd, Ni)S, стибиопалладинит Pd 3 Sb, лаурит RuS 2 , холлингуореит (Rh, Pt, Pd, Ir)(AsS) 2 и др. Минералы этого типа встречаются в виде твердых растворов в медно-никелевых сульфидных рудах, являющихся осн. пром. источником платиновые металлы На долю вторичных источников платиновых металлов (лом, отработанные катализаторы и др.) приходится от 10 до 33% ежегодного мирового производства этих металлов. Некоторые изотопы Pd, Ru и Rh накапливаются в продуктах деления U и Pu в ядерных реакторах.
Платина — Самый ДРАГОЦЕННЫЙ Металл на ЗЕМЛЕ!
ХАРАКТЕРИСТИКА ПЛАТИНОВЫХ МЕТАЛЛОВ
Конфигурация внеш. электронных оболочек атома
Атомный и ионный радиусы*, нм
S 0 298 , Дж/(моль•К)

, кДж/моль
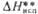
, кДж/моль
* Ионные радиусы даны по Шеннону при координационном числе 6.
** D H пл и D H исп приведены при температурах соотв. плавления и кипения.
Мировые прогнозные ресурсы платиновые металлы (без социалистич. стран) оцениваются в 75050 т (1985), в т.ч. в ЮАР 62000, США 9300, Зимбабве 3100, Канаде 500, Колумбии 150 т. В осн. это запасы Pt (65%) и Pd (30-32%).
Свойства. Платиновые металлы — светло-серые или серебристые тугоплавкие, труднолетучие металлы (см. табл.); Rh, Pd, Ir, Pt кристаллизуются в гранецентрированной кубической решетке, Os и Ru- в гексагональной плотноупакованной. По мех. свойствам платиновые металлы заметно различаются: Pt-мягкая, пластичная, легко вытягивается в тончайшую проволоку и прокатывается в фольгу, почти так же пластичен Pd; Os и Ru-хрупкие, Ir-твердый и прочный.
Наиболее характерные степени окисления для палладия +2, платины +2 и +4, иридия +2 и +3, осмия +4, +6 и +8, родия +3, рутения +3, +4 и +8. платиновые металлы обладают исключительно высокой каталитической активностью, чаще других как катализаторы используют Pt и Pd. Палладий и в меньшей степени Pt хорошо растворяют H 2 , Pd растворяет H 2 лучше всех металлов (до 800 объемов).
Как определить платину в домашних условиях │ Драгметаллы вокруг нас
Платиновые металлы отличаются хим. инертностью, наиболее химически стойка Pt. Палладий растворим в горячих конц. HNO 3 и H 2 SO 4 , Pt и Pd и в меньшей степени RU- в царской водке, Ru в присутствии окислителей взаимод. с H 2 SO 4 и HClO 4 , Rh медленно реагирует с конц. H 2 SO 4 , HBr, Pt медленно взаимод. с кипящей H 2 SO 4 и горячей HNO 3 , медленно раств. в конц. HBr и HI.
Все платиновые металлы растворимы в царской водке после оглавления с KHSO 4 или спекания с неорг. пероксидами. Платиновые металлы взаимодействуют при нагр. со щелочами в присутствии O 2 . С O 2 воздуха платиновые металлы образуют тончайшие оксидные пленки на поверхности: Os при 500-600 0 C, Ru выше 450 0 C, Pt при 900-1000 0 C, Ir и Rh ок. 2000 0 C. Os может гореть на воздухе, a HNO 3 окисляется до OsO 4 .
Известны сотни простых и тысячи комплексных соединений платиновых металлов. В растворах существуют только комплексные ионы платиновых металлов. Устойчивость высоких степеней окисления платиновых металлов в комплексных соед. уменьшается в рядах Ru > Rh > Pd и Os > Ir > Pt. Платиновые металлы, особенно в низких степенях окисления, представляют собой мягкие льюисовские кислоты по Пирсону; в водных растворах устойчивость галргенидных комплексов уменьшается в ряду F — — — — , а в случае многоатомных лигандов, в т.ч. органических,-в ряду донорных атомов О Rh > Pt > Ru > Os > Pd.
Получение. Способ извлечения и разделения платиновых металлов существенно зависит от типа исходного сырья. Переработка россыпей сводится к добыче песка и его обогащению гравитационными методами. Переработка медно-никелевых сульфидных руд обычно включает операции мех. и флотац. обогащения, пирометаллургич. переработки концентратов и гидрометаллургич. рафинирования (аффинаж).
При переработке медно-никелевых сульфидных руд платиновые металлы концентрируются в разл. полупродуктах произ-ва; большая часть, особенно Pd и Pt, концентрируется в анодных шламах (после электролитич. рафинирования Cu и Ni); из них получают концентраты платиновые металлы, которые направляют на аффинажные заводы. Схемы аффинажа платиновые металлы включают после-доват. операции обработки концентрата хим. реагентами.
Напр., для выделения Pd и Pt концентраты платиновых металлов обрабатывают царской водкой. К фильтрату, содержащему Pt, Pd и Au, добавляют FeSO 4 и осаждают Au. Из раствора, содержащего Pd и Pt в виде [PtCl 6 ] 2- и [PdCl 4 ] 2- , добавлением NH 4 Cl осаждают (NH 4 ) 2 [PtCl 6 ], который прокаливают до платиновой губки, затем повторяют растворение в царской водке, осаждение и прокаливание.
Р-р, содержащий Pd, обрабатывают водным NH 3 и соляной кислотой, при этом осаждается Pd(NH 3 ) 2 Cl 2 ; переосаждение повторяют до получения чистого вещества, которое прокаливают до палладиевой губки. Из оставшегося после обработки царской водкой концентрата, используя последоват. операции сплавления, растворения и осаждения, получают чистые (NH 4 ) 3 [RhCl 6 ], (NH 4 ) 3 [RuCl 6 ], (NH 4 ) 2 [IrCl 6 ], которые прокаливают в атмосфере H 2 до Rh, Ru, Ir. В ряде схем аффинажа используют экстракц. методы. Высокочистые платиновые металлы получают методом зонной плавки, вытягиванием монокристаллов из расплава.
Определение. При анализе проб, содержащих от 10 -8 -10 -7 до ~10% платиновых металлов, часто необходимо предварительное концентрирование и разделение платиновые металлы Чаще всего для этого используются метод пробирной плавки (см. Пробирный анализ), сорбционное и экстракционное концентрирование. Метод пробирной плавки основан на высокотемпературном извлечении платиновых металлов расплавленными Pb, Ag, Cu, сплавами Pb с Ag, Cu с Ni, NiS.
При сорбционных методах концентрирования наибольшее применение находят сорбенты с комплексообразующими группами. Для разделения платиновые металлы в виде заряженных комплексов с неорг. и орг. лигандами используют хроматографич. методы. Экстракц. методы основаны на избират. извлечении орг. растворит о-лями из водных растворов соединений платиновые металлы с экстрагентами. Для концентрирования Ru и Os используют избират. отгонку и экстракцию оксидов MO 4 .
Применение. платиновые металлы применяют в виде индивидуальных металлов и их сплавов друг с другом, а также с Au, Ag, Со, Cu и др. Сплавы платиновые металлы обладают большей твердостью, прочностью и устойчивостью к коррозии по сравнению с индивидуальными металлами. Основные области применения платиновых металлов и их сплавов: катализаторы гидрирования, дегидрирования, окисления, дожигания выхлопных газов автомобилей, в топливных элементах; легирующие добавки в сплавах; материалы для высокотемпературных термопар, термометров сопротивления, электрич. печей сопротивления, химически стойкой посуды, электродов, электрических контактов, мед. инструментов, стеклоплавильных аппаратов; осн. компонентов резистивных и конденсаторных материалов; тугоплавкие припои; компоненты постоянных магнитов (напр., сплав Pt-Co); защитные покрытия на металлах; ювелирная промышленность.
История открытия платиновых металлов началась в сер. 18 в., когда испанцы в Южной Америке обнаружили, что при промывке песка вместе с золотом отмывались тяжелые серебристые песчинки, которых иногда было больше золота.
Такой «песок» загрязнял золото, т. к. по внеш. виду он напоминал серебро и в то же время был полностью «бесполезен», его уничижительно назвали серебришком (plata — по-испански серебро). Однако последовательное исследование образцов «тяжелого песка» позволило выделить пять новых элементов. На рубеже 18 и 19 вв. в Великобритании (У. Волластон, С. Теннант), России (А. А. Мусин-Пушкин) и Франции (Л.
Воклен, А. Фуркруа) разработаны методы получения ковкой платины, в 1803 Волластон получил Pd, в 1804 он же выделил Rh, а Теннант -Ir и Os. Значительно позднее, в 1844, после четырех лет исследований уральской руды профессор Казанского университета К. К. Клаус выделил новый металл, который он назвал рутением в честь России (ср.-век. лат. Ruthenia-Россия).
Источник: www.chemport.ru
Платиновые металлы

Пла́тиновые мета́ллы (платиноиды), семейство из шести переходных химических элементов VIII группы короткой формы (8–10-й групп длинной формы) периодической системы : рутений , родий , палладий , осмий , иридий , платина . Обладают схожими физическими и химическими свойствами. Подразделяются на лёгкие (Ru–Pd) и тяжёлые (Os–Pt) платиновые металлы. Вместе с Au и Ag относятся к благородным металлам .
Распространённость в природе
Свойства
В свободном виде платиновые металлы светло-серые или серебристые (Os с голубоватым оттенком), тугоплавкие и труднолетучие. Os, Ir и Pt отличаются очень высокой плотностью (более 20 000 кг/м 3 ). Pt и Pd пластичные , Os и Ru хрупкие , Ir твёрдый и прочный . Платиновые металлы химически инертны, растворяются в царской водке , при нагревании взаимодействуют с расплавленными щелочами , а также с О2, F2 и Cl2. Pt и особенно Pd способны растворять большие количества Н2. Образуют оксиды , халькогениды , фториды , оксифториды, хлориды , хлорокислоты (тетрахлоропалладиевая H2[PdCl4], гексахлороплатиновая H2[PtCl6] и др.), многочисленные комплексные соединения . Высшие степени окисления Ru и Os +8, Rh, Ir и Pt +6, Pd +4.

Образец рутения. Образец рутения.
Получение
Переработка гравитационных концентратов и анодных шламов после рафинирования Cu и Ni, разделение и очистка платиновых металлов ведутся гидрометаллургическими методами. Платиновые металлы также извлекают из вторичных источников. Платиновые металлы производят в виде металлов ( порошки , фольга , проволока , сетка, дробь), сплавов и химических соединений.
Применение
Платиновые металлы применяют в химическом машиностроении и приборостроении ( тигли , покрытия аппаратов, электрические сопротивления и контакты, термопары ), химической технологии ( катализаторы ), автомобилестроении (катализаторы дожигания), лабораторной технике, электротехнике (спирали печей и нагревателей), энергетике (электрокатализаторы для топливных элементов ), медицине (инструменты, детали приборов, протезов , различные препараты ), ювелирном деле; Pt и Pd – как валютный металл. Годовое производство в 2020 г. составило: Pt 217 т, Pd 166 т, Rh 22,7 т, Ir 8,17 т, Ru 29,9 т; Os производится менее 1 т в год. Раков Эдуард Григорьевич . Первая публикация: Большая российская энциклопедия, 2014.
Источник: bigenc.ru
Платиновые металлы
В чистом виде это тугоплавкие металлы (tплав. о С: Ru – 2250, Rh – 1966, Pd – 1552, Os – 3000, Ir – 2450, Pt – 1773).
Родий, палладий, платина хорошо поддаются механической обработке. Рутений, осмий, иридий очень хрупкие, механической обработке поддаются с трудом.
Платиновые металлы очень устойчивы к воздействию агрессивных сред. В виде компактных металлов рутений, родий, иридий нерастворимы даже в “царской водке”. Палладий растворяется в азотной кислоте:
Платина не растворяется в азотной кислоте, но взаимодействует с “царской водкой” и весьма неустойчива в щелочной среде в присутствии окислителей:
3Pt + 12HCl + 4HNO3 = 3PtCl4 + 4NO ↑ + 8H2O
Даже наиболее активные неметаллы при обычных температурах на компактные платиновые металлы не действуют. Более или менее энергичное взаимодействие с неметаллами может быть вызвано только сильным нагреванием. Причем наблюдаются индивидуальные особенности отдельных элементов: по отношению к кислороду устойчивее всех Rh и Pt; по отношению к галогенам – Ir; по отношению к сере – Ru.
Химия платиновых металлов весьма разнообразна.
Соединения в степени окисления +2 характерны для палладия и (отчасти) для платины.
Степень окисления +3 характерна для родия и иридия. Их гидроксиды Rh(OH)3 и Ir(OH)3 не растворимы в воде, имеют слабо выраженные основные свойства. При нагревании легко теряют воду и переходят в оксиды черного цвета Ir2O3 и Rh2O3.
Степень окисления +4 характерна для всех платиновых элементов, а +6 и +8 – характерны для осмия и рутения. Осмий и рутений при сплавлении со щелочью в присутствии окислителя образуют соли осмиевой и рутениевой кислот Ме2ЭО4:
Как осматы, так и рутенаты в обычных условиях неустойчивы. Осматы легко окисляются до OsO4, рутенаты – восстанавливаются до RuO2.
Наибольшее практическое значение имеет платина. Из неё изготавливается лабораторная посуда, нагреватели, термометры сопротивления. Платина часто используется в качестве катализатора.
Соединения элементов платиновой группы значительного практического применения не находят.
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
Источник: studopedia.ru