Для обнаружения ацетона в дистилляте используют в качестве основного метода – газожидкостную хроматографию, метода подтверждающего – химические реакции.
В случае обнаружения на хроматограмме пика, по параметрам соответствующего стандарту ацетона, его наличие подтверждают реакциями образования иодоформа, с нитропруссидом натрия и фурфуролом.
1. Реакция с нитропруссидом натрия (проба Легаля).
При взаимодействии с натрия нитропруссидом вещества, в структуре которых присутствует способная к енолизации СО-группа, образуют окрашенные соединения. При отсутствии в структуре молекулы кетона метильных и метиленовых групп, связанных с СО-группой, реакция проходить не будет.
В щелочной среде с натрия нитропруссидом ацетон дает интенсивно-красную окраску. При подкислении уксусной кислотой окраска переходит в красно-фиолетовую.
Реакция имеет высокую чувствительность, но не специфична для ацетона, в нее вступает метилэтилкетон. Окрашенные соединения другого цвета могут давать присутствующие в диализате ацетофенон, ацетилацетон, ацетоуксусный эфир, диацетил, коричный альдегид и др. Следует учитывать, что положительный результат при взаимодействии с нитропруссидом натрия дадут сероводород и уксусный ангидрид.
Цветная реакция на ацетон
2. Реакция образования йодоформа (проба Либена).
При взаимодействии ацетона с йодом в щелочной среде происходит образование йодоформа.
Выделяется желтый осадок йодоформа с характерным запахом, при рассмотрении под микроскопом можно наблюдать кристаллы желтого цвета в виде шестиугольников или шестиконечных снежинок.
Чувствительность реакции 0,1 мг в 1 мл пробы. Реакция имеет отрицательное судебно-химическое значение, ее дает этиловый спирт, но в отличие от этанола ацетон дает реакцию в мягких условиях — без нагревания и со слабой щелочью.
3. Реакция с фурфуролом.
Основана на способности ацетона участвовать в реакциях конденсации с альдегидами (фурфурол, ванилин и др.)
Реакция не специфична для ацетона, ее дают альдегиды и кетоны.
4. Реакция с о-нитробензальдегида
При взаимодействии о-нитробензальдегида с ацетоном в щелочной среде протекают процессы, приводящие к образованию индиго.
При малых концентрациях ацетона реакция протекает медленно. Сначала появляется желтая окраска, постепенно переходящая в желтовато-зеленую и зеленовато-синюю. Если экстрагировать индиго из щелочной среды хлороформом, то хлороформный слой приобретает синюю окраску.
Предел обнаружения: 100 мкг ацетона в пробе.
Реакция неспецифична. о – нитробензальдегид также дает окраску с ацетофеноном, ацетилацетоном, диацетилом, ацетоуксусным эфиром, ацетальдегидом и др. При указанных выше условиях спиртовые растворы ацетона будут давать сине-красную окраску.
Количественное определение ацетона проводят в дистилляте, получаемом перегонкой в новой порции биологического материала.
Определение содержания проводят методом газожидкостной хроматографии (внутренний стандарт – н-пропанол) и методом обратной йодометрии.
Химия 10 класс (Урок№8 — Альдегиды и кетоны.)
Метод обратной йодометрии проводят аналогично количественному определению формальдегида. В основе метода лежит реакция образования иодоформа. Избыток йода после прохождения реакции оттитровывают тиосульфатом натрия.
Важнейшие способы обработки и анализа рядов динамики Не во всех случаях эмпирические данные рядов динамики позволяют определить тенденцию изменения явления во времени.

ТЕОРЕТИЧЕСКАЯ МЕХАНИКА Статика является частью теоретической механики, изучающей условия, при которых тело находится под действием заданной системы сил.

Теория усилителей. Схема Основная масса современных аналоговых и аналого-цифровых электронных устройств выполняется на специализированных микросхемах.
Логические цифровые микросхемы Более сложные элементы цифровой схемотехники (триггеры, мультиплексоры, декодеры и т.д.) не имеют.
Трамадол (Маброн, Плазадол, Трамал, Трамалин) Групповая принадлежность · Наркотический анальгетик со смешанным механизмом действия, агонист опиоидных рецепторов.
Мелоксикам (Мовалис) Групповая принадлежность · Нестероидное противовоспалительное средство, преимущественно селективный обратимый ингибитор циклооксигеназы (ЦОГ-2).
Менадиона натрия бисульфит (Викасол) Групповая принадлежность •Синтетический аналог витамина K, жирорастворимый, коагулянт.
ЛЕЧЕБНО-ПРОФИЛАКТИЧЕСКОЙ ПОМОЩИ НАСЕЛЕНИЮ В УСЛОВИЯХ ОМС 001. Основными путями развития поликлинической помощи взрослому населению в новых экономических условиях являются все.
МЕТОДИКА ИЗУЧЕНИЯ МОРФЕМНОГО СОСТАВА СЛОВА В НАЧАЛЬНЫХ КЛАССАХ В практике речевого общения широко известен следующий факт: как взрослые.
СИНТАКСИЧЕСКАЯ РАБОТА В СИСТЕМЕ РАЗВИТИЯ РЕЧИ УЧАЩИХСЯ В языке различаются уровни — уровень слова (лексический), уровень словосочетания и предложения (синтаксический) и уровень Словосочетание в этом смысле может рассматриваться как переходное звено от лексического уровня к синтаксическому.
Источник: studopedia.info
Альдегиды при взаимодействии с водородом в присутствии Ni-катализатора образуют первичные спирты, кетоны — вторичные:
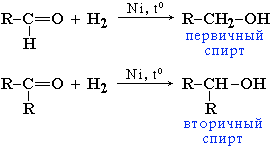
В лабораторных условиях для восстановления альдегидов и кетонов используется алюмогидрид лития LiAlH4
Альдегиды очень легко окисляются в соответствующие карбоновые кислоты под действием таких мягких окислителей, как оксид серебра и гидроксид меди (II):
а) реакция «серебрянного зеркала» — окисление аммиачным раствором оксида серебра:
б) окисление гидроксидом меди (II) с образованием красно-кирпичного осадка Cu2O:
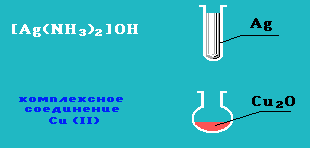
Данные реакции являются качественными на альдегидную группу.
Кетоны не вступают в реакцию «серебряного зеркала». Они окисляются с трудом лишь при действии более сильных окислителей и повышенной температуре. При этом происходит разрыв С–С-связей (соседних с карбонилом) и образование смеси карбоновых кислот меньшей молекулярной массы.
3.5. Получение альдегидов и кетонов
- Окисление спиртов Первичные спирты при окислении образуют альдегиды, которые затем легко окисляются до карбоновых кислот.
Чтобы предотвратить превращение альдегида в кислоту, его отгоняют в ходе реакции (т.кип. альдегида < т.кип. кислоты)
При окислении вторичных спиртов образуются кетоны.
- Гидратация алкинов (реакция Кучерова) Присоединение воды к ацетилену в присутствии солей ртути (II) приводит к образованию ацетальдегида:
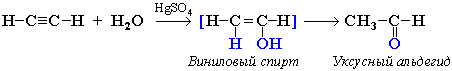
Кетоны получают при гидратации других гомологов ряда алкинов:
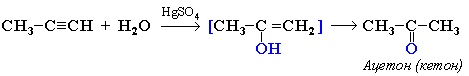
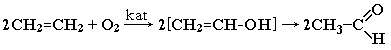
- Окисление алкенов (катализаторы — хлориды Pd и Cu) Этот способ более перспективен, чем гидратация алкинов, при которой используются токсичные ртутные катализаторы.
- Кумольный способ получения ацетона (наряду с фенолом).
Гидратация (реакция Кучерова)
Присоединение воды происходит в присутствии катализатора соли ртути (II) и идет через образование неустойчивого непредельного спирта, который изомеризуется в уксусный альдегид (в случае ацетилена):
или в кетон (в случае других алкинов):
Кумольный способ получения фенола (СССР, Сергеев П.Г., Удрис Р.Ю., Кружалов Б.Д., 1949 г.). Преимущества метода: безотходная технология (выход полезных продуктов > 99%) и экономичность. В настоящее время кумольный способ используется как основной в мировом производстве фенола.
3.6. Применение альдегидов и кетонов
Метаналь (муравьиный альдегид) CH2=O
получение фенолформальдегидных смол;
получение мочевино-формальдегидных (карбамидных) смол;
синтез лекарственных средств (уротропин);
консервант биологических препаратов (благодаря способности свертывать белок).
Этаналь (уксусный альдегид, ацетальдегид) СН3СН=О
производство уксусной кислоты;
Ацетон СН3-СО-СН3
растворитель лаков, красок, ацетатов целлюлозы;
сырье для синтеза различных органических веществ.
3.7. Контрольные вопросы
1. Какие из представленных структур относятся к альдегидам и кетонам?

Ответ 1 : а — альдегид; в — кетон Ответ 2 : a — альдегид; е — кетон Ответ 3 : г — альдегид; д — кетон Ответ 4 : в — альдегид; г — кетон
2. Веществом Б в схеме превращений
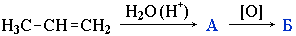
является . Ответ 1 : первичный спирт Ответ 2 : вторичный спирт Ответ 3 : альдегид Ответ 4 : кетон
3. Из 92 г этанола получили 70 г этаналя. Какова массовая доля выхода продукта в % от теоретически возможного? Ответ 1 : 30% Ответ 2 : 56% Ответ 3 : 79% Ответ 4 : 92%
4. КАРБОНОВЫЕ КИСЛОТЫ
Карбоновые кислоты — органические соединения, содержащие одну или несколько карбоксильных групп –СООН, связанных с углеводородным радикалом.
Карбоксильная группа содержит две функциональные группы — карбонил >С=О и гидроксил -OH, непосредственно связанные друг с другом:
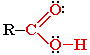
Простейшие карбоновые кислоты
Муравьиная кислота (метановая)
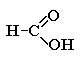
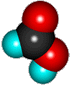
Уксусная кислота (этановая)

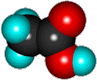
Пропионовая кислота (пропановая)


Для перехода к виртуальной (VRML) модели щелкните на нужной картинке.
Источник: studfile.net
Открытие альдегидов с фуксинсернистой кислотой (Реакция Шиффа)
В две пробирки прибавляют по 10 капель свежеприготовленного бесцветного раствора фуксинсернистой кислоты (реактив Шиффа). В одну пробирку добавляют 3-4 капли 40%-ного раствора формалина, в другую – несколько капель ацетона. Как изменяется окраска раствора? В обе пробирки добавляют по несколько капель концентрированной соляной кислоты. Отмечают наблюдаемые явления.
Все альдегиды и кетоны, содержащие метильную группу, дают цветную реакцию с фуксинсернистой кислотой. Однако, характерная окраска в сильнокислой среде характерна только для формальдегида.
Цветная реакция на ацетон с нитропруссидом натрия (Проба Легаля)
В пробирку помещают 10 капель дистиллированной воды, 2 капли ацетона и 5 капель 1%-ного раствора нитропруссида натрия. Добавляют несколько капель 10%-ного раствора едкого натра. В какой цвет окрасился раствор?
Разливают раствор в две пробирки и в одну из них прибавляют 5-6 капель 30%-ной уксусной кислоты. Сравнивают окраску в обеих пробирках.
Нитропруссид натрия Na2[Fe(CN)5NO] (пентацианоферроат натрия) дает характерную окраску в присутствии кетонов, не исчезающую в среде уксусной кислоты.
Эта цветная реакция используется для открытия ацетона (качественная реакция на группу СН3СО-)
Окисление формальдегида аммиачным раствором оксида серебра (реакция Толленса)
В пробирку помещают маленький кипятильный камешек. Наливают 3 мл 10%-ного раствора едкого натра и нагревают до кипения. Затем щелочь выливают в специальную посуду, а пробирку охлаждают на воздухе (водой не ополаскивать).
В охлажденную пробирку прибавляют 10 капель (0,5мл) свежеприготовленного 1%-ного аммиачного раствора оксида серебра и 5 капель 1%-ного раствора формалина. Пробирку помещают в водяную баню (или стакан с горячей водой). Через некоторое время на стенках пробирки образуется налет металлического серебра (“cеребряное зеркало”).
Альдегиды очень легко окисляются гидроксидами металлов в щелочной среде. При взаимодействии альдегидов с аммиачным раствором оксида серебра протекает реакция в соответствии со следующей схемой (написать уравнение реакции окисления формальдегида).
После окончания опыта раствор из пробирки сливают в специальную посуду для слива отходов серебра.
Окисление формальдегида гидроксидом меди (II) в щелочной среде
В пробирку помещают 10 капель 10%-ного раствора едкого натра и добавляют 4-5 капель 3%-ного раствора сульфата меди (II). К образовавшемуся голубому осадку гидроксида меди (II) прибавляют 8-10 капель 40%-ного раствора формальдегида. Затем смесь взбалтывают и нагревают до кипения. При нагревании цвет осадка меняется на желтый, а затем происходит образование на стенках пробирки красного налета оксида меди (I).
Написать уравнение происходящей реакции.
Эта реакция является качественной реакцией на альдегиды. Кетоны не окисляются этими реактивами.
Реакция дисмутации водных растворов формальдегида
В пробирку помещают 2-3 капли 40%-ного раствора формальдегида. Добавляют 1 каплю индикатора метилового красного. Раствор окрашивается в красный цвет. Это указывает на кислую реакцию. При стоянии растворов формальдегида в них постепенно протекают процессы окисления-восстановления, называемые реакцией дисмутации.
Реакция дисмутации заключается в том, что при участии воды из каждых двух молекул формальдегида одна окисляется до кислоты, а другая восстанавливается в спирт. Написать уравнение данной реакции.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Окислением каких спиртов можно получить следующие соединения: а) 2-метилбутаналь; б) изомасляный альдегид; в) 5,5-диметилгексанон-3; г) метилизобутилкетон?
2. Из каких альдегидов и кетонов при восстановлении могут быть получены следующие спирты: а) 1-пентанол; б) этилпропилкарбинол; в) метилизопропилкарбинол; г) метилтретбутилкарбинол?
3. Какие соединения получатся при действии гидросульфита натрия на: а) пропаналь; б) 2-метилбутаналь; в) метилэтилкетон?
4. Написать уравнение реакции взаимодействия пропионового альдегида с пропанолом-2.
5. Предложить способ распознавания метилпропилкетона и диэтилкетона.
6. Получить реакцией оксосинтеза изомасляный альдегид и написать для него уравнение реакции “серебряного зеркала”.
7. Получите 3-метилпентаналь окислением соответствующего спирта. Напишите для альдегида уравнение реакции с хлоридом фосфора (V).
8. Напишите уравнение альдольной конденсации: а) уксусного альдегида с формальдегидом; б) формальдегида с ацетоном; в) диметилуксусного альдегида.
9. Напишите схемы окисления кетонов: а) бутанона; б) 2-метилпентанона; в) 2,2-диметил-3-гексанона.
10. Предложите химический метод, с помощью которого можно разделить: а)гексаналь и гексан; б) пентаналь и диэтилкетон.
11. Используя в качестве исходного вещества ацетилен, получите 2-бутеналь и напишите для него уравнение реакции с синильной кислотой.
12. Получите метилвинилкетон из следующих веществ: а) ацетона и формальдегида; б) ацетилена и неорганических реагентов.
13. Напишите уравнения реакций в соответствии со следующей схемой: спирт® альдегид ®дигалоидпроизводное® альдегид и укажите условия проведения.
14. Написать уравнение реакции Канниццаро для триметилуксусного альдегида.
15. Написать уравнение реакции сложноэфирной конденсации пропаналя.
ЛАБОРАТОРНАЯ РАБОТА №9
Тема: КАРБОНОВЫЕ КИСЛОТЫ
Цель работы: Практическое ознакомление с некоторыми общими и специфическими свойствами карбоновых кислот на примере отдельных представителей.
Оборудование и реактивы:муравьиная, уксусная, бензойная, сорбиновая, стеариновая (или пальмитиновая) кислоты; растворители: вода, диэтиловый спирт, бензол или другие растворители; хлороформ; 10%-ный раствор гидроксида натрия, 1%-ный раствор нитрата серебра; 5%-ный раствор аммиака, концентрированная серная кислота; известковая (или баритовая) вода; ацетат натрия; 10%-ный раствор серной кислоты; 10%-ный раствор уксусной кислоты или столовый уксус; 2%-ный раствор перманганата калия; 10%-ный раствор карбоната натрия; олеиновая кислота; бромная вода; концентрированная азотная кислота; медь (стружки или проволока); синяя лакмусовая бумага (или универсальная), бани водяные; изогнутые газоотводные трубки; пипетки; прямые газоотводные трубки с оттянутым концом; пробирки.
Теоретическая часть
Карбоновыми кислотаминазывают производные углеводородов, содержащие одну или несколько карбоксильных групп — СООН.
Карбоновые кислоты классифицируют по числу карбоксильных групп (одноосновные и многоосновные), по количеству атомов углерода (низшие и высшие), в зависимости от строения углеводородного радикала (предельные, непредельные, ароматические, оксикислоты, фенолокислоты, альдегидо- и кетокислоты и другие группы). В соответствии с вышеуказанным различают следующие гомологические ряды карбоновых кислот.
| Предельные одноосновные кислоты | Непредельные одноосновные кислоты | ||
| НСООН | муравьиная | СН2=СН-СООН | Акриловая |
| СН3СООН | уксусная | СН2=СН-СН2-СООН | Винилуксусная |
| СН3СН2СООН | пропионовая | СН3СН=СНСООН | кротоновая |
| СН3(СН2)2-СООН | масляная | СН2=С(СН3)-СООН | метакриловая |
| СН3(СН2)3-СООН | валериановая | СН3-(СН=СН)2-СООН | сорбиновая |
| СН3(СН2)4-СООН | капроновая | СН3(СН2)7СН=СН(СН2)7-СООН | Олеиновая (цис-), элаидиновая (транс-) |
| СН3(СН2)5-СООН | энантовая | С17Н31СООН | линолевая |
| СН3(СН2)10-СООН | лауриновая | С17Н29СООН | Линоленовая |
| СН3(СН2)14-СООН | пальмитиновая | СН=С-СООН | Пропиоловая |
| СН3(СН2)16-СООН | стеариновая | СН3С=С-СООН | тетроловая |
| С20Н31СООН | арахидоновая |
Предельные двухосновные кислоты: НООС-СООН – щавелевая, НООС-СН2-СООН – малоновая, НООС-(СН2)2-СООН – янтарная, НООС-(СН2)3-СООН – глутаровая, НООС-(СН2)4-СООН – адипиновая, НООС-(СН2)5-СООН – пимелиновая, НООС-(СН2)6-СООН – пробковая, НООС-(СН2)7- СООН – азелаиновая, НООС-(СН2)8-СООН – себациновая.
Непредельные двухосновные кислоты:НООС-СН=СН-СООН – малеиновая (цис-изомер) и фумаровая (транс-изомер).
Ароматические карбоновые кислоты: одноосновные – С6Н5-СООН –бензойная; СН3-С6Н4-СООН – толуиловые кислоты (орто-, мета-, пара-), двухосновные:
фталевая изофталевая терефталевая
Предельные жирно-ароматические кислоты:С6Н5-СН2-СООН – фенилуксусная.
Непредельные жирно-ароматические кислоты: С6Н5-СН=СН-СООН – коричная
Оксикарбоновые кислоты:одноосновные: НО-СООН – оксимуравьиная, угольная; НО-СН2-СООН – гликолевая; СН3СН(ОН)-СООН – молочная; двухосновные: НООС-СНОН-СООН – тартроновая, НООС-СН2-СНОН-СООН – яблочная, НООС-СНОН-СНОН-СООН – винная;
НООС-СН2-С(ОН)(СООН)-СН2-СООН – лимонная; ароматические оксикислоты (фенолокислоты):
Методы получения
Карбоновые кислоты встречаются в природе в свободном состоянии (муравьиная кислота – в крапиве, яблочная – в фруктах, сорбиновая – в ягодах рябины, брусники, изовалериановая – в валериановом корне), а также в виде сложных эфиров и жиров. Основным источником получения карбоновых кислот является все же органический синтез.
1. Окисление спиртов, альдегидов, кетонов, углеводородов (см. химические свойства указанных соединений).
2. Оксосинтез:
Процесс проводят при высокой температуре и давлении в присутствии карбонилов никеля или кобальта (Ni(CO)4, Co(CO)8).
3. Гидролиз нитрилов (R-C=N) в кислой или щелочной среде при нагревании:
4. Гидролиз тригалогенпроизводных:
5. Магнийорганический синтез(лабораторные методы):
R-Mg-Br + CO2 ® R-COOMgBr
R-COOMgBr + HCI ® R-COOH + MgBrCI
Источник: allrefrs.ru