
Азотная кислота — кислота-окислитель, потому что она имеет наивысшую степень окисления азота +5. Поэтому атом азота легко принимает электроны и восстанавливается до степени окисления +4, +3, +2, +1, 0, -3.
Другие кислоты-окислители: H2SO4, HClO4, H2Cr2O7.
Соляная кислота имеет наименьшую отрицательную степень окисления хлора -1. Он не может принимать электроны и быть окислителем.
2. При взаимодействии разбавленной азотной кислоты с некоторыми металлами (Mg, Zn) может выделиться оксид азота(I) или азот. Напишите соответствующие уравнения окислительно-восстановительных реакций.
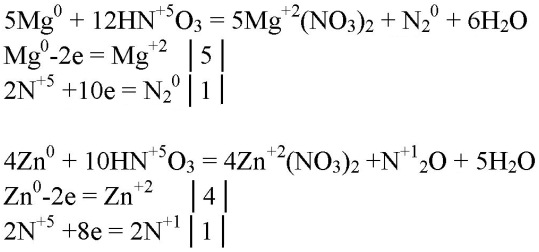
Как растворить золото 585 прбы в азотной кислоте?
3. Напишите молекулярные, полные ионные и сокращённые ионные уравнения реакций, с помощью которых можно различить соляную, серную и азотную кислоты.
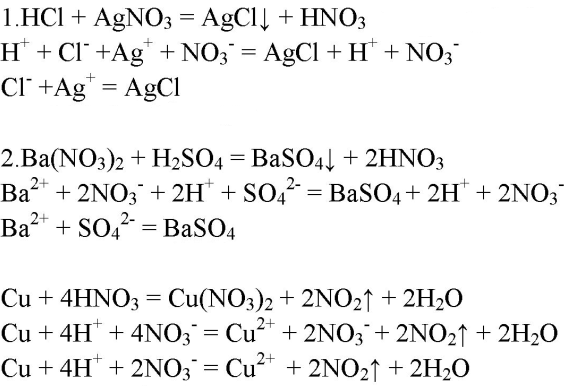
4. Приведите уравнения реакций: а) характерных только для азотной кислоты; б) общих для азотной и других кислот.
Характерные только для азотной кислоты
Общие для азотной кислоты и других кислот
Разлагается при нагревании и под действием света
![]()
По-разному реагирует с металлами
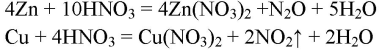
В результате реакции концентрированной азотной кислоты с белками образуются вещества ярко-жёлтого цвета.
![]()
Взаимодействует с основными оксидами
![]()
Взаимодействует с основаниями
![]()
Взаимодействует с солями более слабых и летучих кислот
Опыты по химии. Взаимодействие меди с разбавленной азотной кислотой
![]()
5. Напишите уравнения реакций, протекающих между серебром и разбавленной, а также концентрированной азотной кислотой. Покажите переход электронов и подчеркните окислитель одной чертой, а восстановитель двумя.
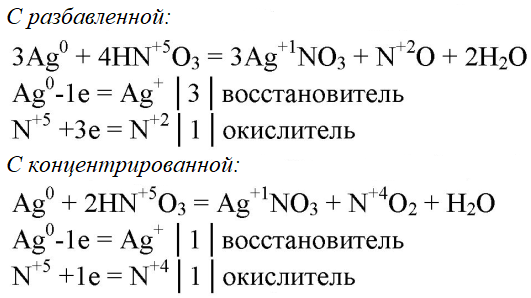
6. Используя рисунок 26, подготовьте компьютерную презентацию на тему «Применение азотной кислоты».
При приготовлении презентации можно использовать следующую информацию:
Азотную кислоту применяют:
- В сельском хозяйстве (для изготовления аммиачной селитры — удобрения);
- В промышленности (изготовление взрывчатых веществ, синтетических красителей, искусственных волокон, пластических масс, в цветной металлургии);
- В медицине (изготовление некоторых лекарств, применяется азотная кислота для борьбы с заболеваниями кожи и ЖКТ, применение нитроглицерина людьми с сердечной недостаточностью);
- В полиграфии (травление печатных форм);
- В ювелирном деле (определение золота в золотом сплаве).
7. Какой объём аммиака (н. у.) потребуется для получения 50 т раствора с массовой долей азотной кислоты 0,5?

Тестовые задания
1. Установите соответствие между исходными веществами и продуктами реакции.
1) HNO3→
2) NH4NO3 + КОН→
3) Cu(NO3)2 + КОН→
4) Zn(NO3)2(тв.) + H2SO4(конц.)→
2. Азотная кислота не взаимодействует:
1) с оксидом углерода(IV)
2) с оксидом меди(II)
3) с карбонатом натрия
4) с гидроксидом алюминия
1) с оксидом углерода(IV)
Источник: gdzwow.com
Вопрос № 7 Напишите уравнения реакций, протекающих между серебром и разбавленной азотной, а также концентрированной азотной кислотой. Покажите переход электронов и подчеркните окислитель одной чертой, а восстановитель — двумя.
Ответ: 
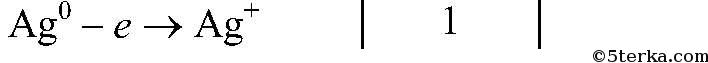 восстановитель, окисляется
восстановитель, окисляется  окислитель, восстанавливается
окислитель, восстанавливается 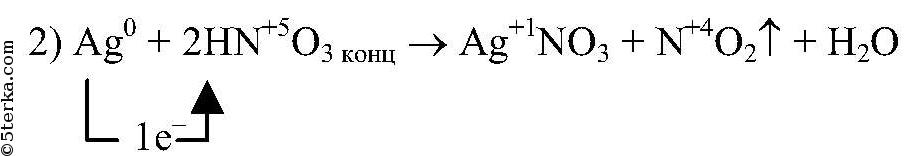
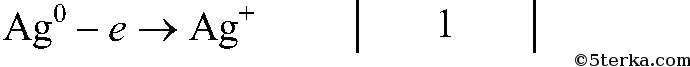 восстановитель, окисляется
восстановитель, окисляется  окислитель, восстанавливается
окислитель, восстанавливается
Источник:

Решебник по химии за 9 класс (Г.Е.Рудзитис, Ф.Г.Фельдман, 1999 год),
задача №7
к главе «Глава IV §§ 21 — 23 стр. 62 — 63».
Источник: 5terka.com
4. Азотная кислота
Азотная кислота HN O 3 — бесцветная дымящая на воздухе жидкость с неприятным запахом. При хранении на свету она разлагается и может окрашиваться в жёлтый цвет за счёт образования бурого оксида азота((IV)):
4HN O 3 = 2H 2 O + 4N O 2 ↑ + O 2 ↑ .

Рис. (1). Азотная кислота
Азотная кислота смешивается с водой в любых соотношениях и в водном растворе полностью распадается на ионы:
HN O 3 → H + + N O 3 − .
Общие свойства кислот
Азотная кислота реагирует с основными и амфотерными оксидами и гидроксидами с образованием нитратов :
CuO + 2HN O 3 = Cu ( N O 3 ) 2 + H 2 O ,
Al ( OH ) 3 + 3HN O 3 = Al ( N O 3 ) 3 + 3H 2 O .
Азотная кислота вступает в реакции обмена с солями других кислот, если образуется газ или осадок:
CaC O 3 + 2HN O 3 = Ca ( N O 3 ) 2 + H 2 O + C O 2 ↑ .
Особые свойства
В отличие от других кислот азотная кислота реагирует с большинством металлов, кроме благородных.
Обрати внимание!
В реакциях азотной кислоты с металлами никогда не образуется водород.
Окислителем в этих реакциях выступает атом азота кислотного остатка, поэтому продуктами реакции являются соединения азота в разной степени окисления. Состав соединений зависит от активности металла и концентрации азотной кислоты. Так, при взаимодействии концентрированной азотной кислоты с медью образуется бурый оксид азота((IV)):
4H N + 5 O 3 + Cu 0 = Cu + 2 ( N O 3 ) 2 + 2N + 4 O 2 + 2H 2 O .

Рис. (2). Медь с концентрированной
азотной кислотой
При взаимодействии разбавленной азотной кислоты с медью продукт реакции — бесцветный оксид азота((II)):
8H N + 5 O 3 + 3Cu 0 = 3Cu + 2 ( N O 3 ) 2 + 2N + 2 O + 4H 2 O .
Обрати внимание!
Концентрированная азотная кислота пассивирует железо и алюминий.
На их поверхности под действием концентрированной кислоты образуется прочная плёнка, которая защищает металл от дальнейшей реакции. Поэтому концентрированную азотную кислоту можно транспортировать в стальных или алюминиевых цистернах.
Азотная кислота способна окислять и другие неорганические и органические вещества. Органические вещества могут воспламеняться при соприкосновении с азотной кислотой, и работа с ней требует аккуратности и осторожности.
Применение
Азотная кислота используется в промышленности для получения:
- минеральных удобрений,
- лекарств,
- взрывчатых веществ,
- пластмасс,
- красителей,
- лаков.
Источник: www.yaklass.ru