Электрохимический ряд напряжений металлов опытным путем установил Алессандро Вольта, на тот момент он выглядел следующим образом: Zn, Pb, Sn, Fe, Cu, Ag, Au. Величина электродного потенциала зависела оттого, насколько далеко отстояли друг от друга члены ряда. Но причина этого была неизвестна. В 1853 г. русский учёный Николай Николаевич Бекетов (1827-1911) сделал в Париже сообщение на тему “Исследование над явлениями вытеснения одних элементов другими”. В этой работе он обобщил различные исследования способности одних металлов вытеснять другие из растворов их солей.
Первоначально Бекетов предполагал, что способность одних металлов вытеснять из растворов солей другие металлы связана с их плотностью: более лёгкие металлы способны вытеснять металлы более тяжелые. Но опыты говорили о ином. Непонятно было и то, как связан “вытеснительный ряд” с рядом напряжений Алессандро Вольта.
Со временем накапливалось всё больше экспериментальных данных того, что некоторые правила вытеснения нарушаются при определенных условиях. Бекетов обнаружил, что водород под давлением 10 атмосфер вытесняет серебро из раствора нитрата серебра. Английский химик Уильям Одлинг (1829-1921) описал множество случаев подобных аномалий. Например, медь вытесняет олово из концентрированного подкисленного раствора хлорида олова (II) и свинец – из кислого раствора хлорида свинца (II). Медь, олово и свинец находятся в ряду правее кадмия, однако могут вытеснять его из кипящего слабо подкисленного раствора хлорид кадмия.
Электрохимический ряд активности металлов и его связь с процессом электроэкстракции
Теоретическую основу ряда активности (и ряда напряжений) заложил немецкий физикохимик Вальтер Нернст (1864-1941). Вместо качественной характеристики – “склонности” металла и его иона к тем или иным реакциям – появилась точная количественная величина. Такой величиной стал стандартный электродный потенциал металла, а соответствующий ряд, выстроенный в порядке изменения потенциалов, называется рядом стандартных электродных потенциалов.
Электрохимический ряд напряжений металлов (ряд Бекетова) это последовательность расположения металлов и их ионов в порядке возрастания стандартных электродных потенциалов в растворах электролитов. Электродом сравнения обычно служит стандартный водородный электрод, электродный потенциал которого условно принимается равным нулю.
| Восстановленная форма | Число отданных електронов | Окисленная форма | Стандартный электродный потенциал, В |
| Li | 1e | Li + | -3,05 |
| K | 1e | K + | -2,925 |
| Rb | 1e | Rb + | -2,925 |
| Cs | 1e | Cs + | -2,923 |
| Ba | 2e | Ba 2+ | -2,91 |
| Sr | 2e | Sr 2+ | -2,89 |
| Ca | 2e | Ca 2+ | -2,87 |
| Na | 1e | Na + | -2,71 |
| Mg | 2e | Mg 2+ | -2,36 |
| Al | 3e | Al 3+ | -1,66 |
| Mn | 2e | Mn 2+ | -1,18 |
| Zn | 2e | Zn 2+ | -0,76 |
| Cr | 3e | Cr 3+ | -0,74 |
| Fe | 2e | Fe 2+ | -0,44 |
| Cd | 2e | Cd 2+ | -0,40 |
| Co | 2e | Co 2+ | -0,28 |
| Ni | 2e | Ni 2+ | -0,25 |
| Sn | 2e | Sn 2+ | -0,14 |
| Pb | 2e | Pb 2+ | -0,13 |
| Fe | 3e | Fe 3+ | -0,04 |
| H2 | 2e | 2H + | 0,00 |
| Cu | 2e | Cu 2+ | 0,34 |
| Cu | 1e | Cu + | 0,52 |
| 2Hg | 2e | Hg2 2+ | 0,79 |
| Ag | 1e | Ag + | 0,80 |
| Hg | 2e | Hg 2+ | 0,85 |
| Pt | 2e | Pt 2+ | 1,20 |
| Au | 3e | Au 3+ | 1,50 |
Как получить хлорид серебра
Место каждого элемента в ряду напряжений условно, т.к. величина электродного потенциала зависит от температуры и состава раствора, в который погружены электроды, в частности от концентрации ионов. Большое значение также имеет состояние поверхности электрода (гладкая, шероховатая). Стандартный электродный потенциал относится к водным растворам при температуре 25 °С, давлении газов 1 атмосфера и концентрации ионов 1 моль/л.
Из электрохимического ряда напряжений металлов вытекает ряд важных следствий:
- Каждый металл способен вытеснять (замещать) из растворов солей все другие металлы, стоящие правее данного металла;
- Все металлы, расположенные левее водорода, способны вытеснять его из кислот;
- Чем дальше расположены друг от друга два металла в ряду напряжений, тем большее напряжение может давать созданный из них гальванический элемент.
Восстановление водородом из оксидов
Металлы, которые водород не восстанавливает из их оксидов
Металлы, которые водород восстанавливает из их оксидов
K, Ba, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr
Fe, Cd, Co, Ni, Sn, Pb, W, Sb, As, Bi, Cu, Hg, Ag
Источник: himgdz.ru
Электролиз
Электролизом называют химические реакции, которые протекают под действием электрического тока на электродах в растворах и расплавах электролитов.
Катодом называют отрицательно заряженный электрод. На его поверхности ионы, молекулы или атомы присоединяют электроны, т. е. протекает реакция электрохимического восстановления катионов.
Анодом называют положительно заряженный электрод. На его поверхности происходит отдача электронов, т. е. реакция окисления.
Для установления продуктов электролиза водных растворов солей используют так называемый электрохимический ряд напряжений металлов, а также ряд восстановительной активности анионов.
Электрохимический ряд напряжений металлов:
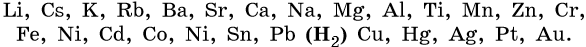
Ряд восстановительной активности анионов:
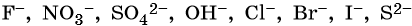
Рассмотрим несколько примеров реакций электролиза, протекающих на инертных, т.е. не вступающих в какие-либо химические реакции, электродах.
Прогнозировать происходящие при электролизе водных растворов процессы можно с помощью ряда напряжений металлов и некоторых экспериментально обоснованных закономерностей.
Для катодных процессов существуют следующие закономерности:
1. Катионы металлов, стандартные электродные потенциалы которых выше, чем у водорода, т.е. расположенные в этом ряду правее его (Cu, Hg, Ag, Pt, Au), при электролизе полностью восстанавливаются на катоде в виде металла: Me n+ + nе – → Me 0 .
2. Катионы металлов с малой величиной стандартного электродного потенциала (Li + , Na + , K + , Rb + , …, до Al 3+ включительно) при электролизе на катоде не восстанавливаются, а вместо них восстанавливаются молекулы воды: 2H2O + 2e – → Н2 + 2ОН – .
3. Катионы металлов со стандартными электродными потенциалами меньше, чем у водорода, но больше, чем у алюминия (Mn 2+ , Zn 2+ , Cr 3+ , Fe 2+ , …, до H), при электролизе восстанавливаются на катоде одновременно с молекулами воды, т.е. одновременно идут два процесса:
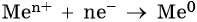
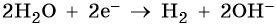
При электролизе водных растворов кислот и щелочей на катоде всегда выделяется водород.
Для анодных процессов:
1. При электролизе водных растворов щелочей, кислородсодержащих кислот и их солей, в которых атомы неметаллов или металлов находятся в высшей степени окисления (NO3 – , SO4 2– , PO4 3– , ClO4 – , MnO4 – и т.п.), а также фторид-ионов F – на аноде будут окисляться не анионы, а гидроксид-ионы и молекулы воды и выделяться кислород:
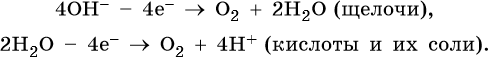
2. При электролизе хлоридов, бромидов, йодидов у анода будут разряжаться анионы и выделяться соответствующие галогены:
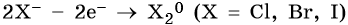
3. При электролизе анионов, содержащих неметалл в промежуточной степени окисления (SO3 2– , NO2 – и др.), они сами окисляются на аноде:
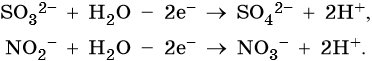
Усвоение учебного материала по данной теме на ЕГЭ проводят с помощью заданий повышенного уровня сложности.
Пример 1. Установите соответствие между формулой вещества и продуктами, которые могут образовываться на катоде в результате электролиза его водного раствора.

Нитрат меди (II). Медь в электрохимическом ряду напряжений металлов стоит после водорода. Следовательно, при электролизе она выделится на катоде в виде металла: Cu 2+ + 2е – → Cu 0 . На аноде при этом будет происходить окисление молекул воды и выделяться кислород: 2H2O – 4e – → О2 + 4Н + . Уравниваем процессы окисления и восстановления:
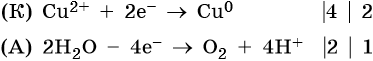
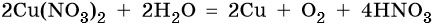
Нитрат серебра. Серебро в электрохимическом ряду напряжений металлов стоит после водорода. Следовательно, при электролизе оно выделится на катоде в виде металла: Ag + + 1е – → Ag 0 . На аноде при этом будет происходить окисление молекул воды и выделяться кислород: 2H2O – 4e – → О2 + 4Н + . Уравниваем процессы окисления и восстановления:
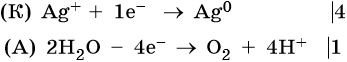
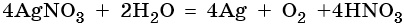
Хлорид железа (II), FeCl2. Железо в ряду напряжений стоит после алюминия и до водорода. При электролизе на катоде восстанавливаются и металл, и молекулы воды, т. е. одновременно идут два процесса: Fe 2+ + 2е – → Fe 0 ; 2H2O + 2e – → Н2 + 2ОН – . На аноде будет выделяться хлор: 2Cl – – 2e – → Cl2 0 .
Уравниваем процессы окисления и восстановления:
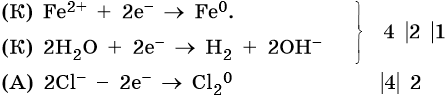
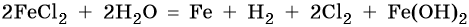
Сульфат калия. Катион калия в ряду напряжений металлов стоит до алюминия. Поэтому катион калия при электролизе на катоде не восстанавливается, а вместо него восстанавливаются молекулы воды: 2H2O + 2e – → Н2 + 2ОН – . На аноде будут окисляться молекулы воды: 2H2O – 4e – → О2 + 4Н + .
Уравниваем процессы окисления и восстановления:
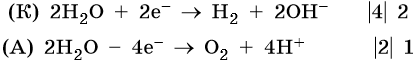
После сокращения получаем:
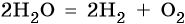
Ответ: А – 1; Б – 5; В – 6; Г – 2.
Источник: himi4ka.ru
Электрохимический ряд напряжений (пример)

Что такое электрохимический ряд напряжений металлов
Электрохимический ряд напряжений это последовательность, где металлы расположены в порядке увеличения их стандартных электрохимических потенциалов, отвечающих полу-реакции восстановления катиона металла.
На основании взаимодействия металлов (например, магния, цинка, железа, олова, свинца, меди, серебра) с растворами соответствующих солей, а также с кислотой (например, хлороводородной) располагают металлы в ряд: Mg, Zn, Fe, Ni, Sn, Pb, Cu, Ag.

Каждый последующий металл вытесняется из раствора его соли предыдущим металлом. В этом ряду помещают и водород между свинцом и медью. В свете электронной теории де лается вывод, что тенденция отдавать электроны и переходить в водный раствор в виде положительно заряженных ионов у металлов как простых веществ ослабевает при переходе в указанном ряду слева направо.
Почему назвали электрохимическим рядом напряжений
Этот ряд называют также электрохимическим рядом напряжений металлов, желая этим подчеркнуть, что он установлен в растворах электролитов и принципиально отличается от рядов, устанавливаемых термохимическим путем, например по вытеснению одних металлов другими из их оксидов (хлоридов, фторидов и т. д.).
Название «электрохимический ряд напряжений металлов» неточное! Речь должна идти об определении стандартных электродных потенциалов металлов, т. е. потенциалов, возникающих на границе между металлом и раствором с одномолярной концентрацией ионов этого металла. Потенциалы эти определяют по нормальному водородному электроду, условно принятому за ноль. В качестве потенциала сравнения берут потенциал одного из металлов, погруженного в раствор его соли (например, медь или серебро).

Рис. 2 . Установка для определения электрохимического ряда напряжений металлов:
1—вертикальная рама, 2 — ванночка для электролита, 3 — стеклянные трубки, 4 — пружинящие хомутики, 5 — пористые диафрагмы, 6 — полихлорвиниловые трубки, 7 — штекерные гнезда, 8 — проводники, 9 — зажимы, 10 — символы металлов, 11 — пластины металлов, 12 — резиновые кружки-держатели пластин, 13 — проводники для подключения прибора к гальванометру.
Как определяют ряд напряжений
В настоящее время установка для определения электрохимического ряда напряжений металлов осваивается промышленностью. До появления промышленного образца ограничимся некоторыми рекомендациями по его самодельному изготовлению (рис. 2). Для прибора нужна вертикальная рама 1 из металла, пластмассы, фанеры или другого материала размером 350X300X Х15 мм, на которой крепят ванночку для электролита 2 (310Х X30X60 мм) и стеклянные трубки (l=150 мм и 25 мм, 3— 6 шт.).
Ванночку изготавливают из оргстекла, а стеклянные трубки— из демонстрационных пробирок или подбирают готовые трубки соответствующих длину и диаметра. Ванночку и стеклянные трубки закрепляют на раме с помощью пружинящих хомутиков 4, расположенных на поперечной планке рамы. Нижние отверстия стеклянных трубок герметично закрывают пористыми диафрагмами 5, которые представляют собой плоские диски из необожженной керамики, имеющие диаметр, соответствующий диаметру стеклянной трубки.
Для закрепления диафрагмы на стеклянной трубке изготовляют специальное приспособление: диафрагму зажимают между двумя уплотнительными резиновыми шайбами и стягивают накидной гайкой из оргстекла. Устройство для закрепления диафрагмы герметично соединяют со стеклянной трубкой при помощи отрезка хлорвиниловой или резиновой трубки 6 (длина отрезка 40 мм).
Для изготовления диафрагмы можно воспользоваться рекомендациями, данными в статье Л. В. Буглая [4]. На верхней панели рамы размещены штекерные гнезда 7 (0 4 мм) с проводниками 8, заканчивающимися зажимами 9. На передней стенке рамы нанесены химические знаки металлов 10 в той же последо вательности, в какой они размещаются в электрохимическом ряду напряжений металлов: цинк, железо, никель, олово, медь, серебро. В комплект с прибором должны входить пластинки перечисленных выше металлов 11 (размер пластинок 100X8X15 мм). В связи с тем, что серебро — дефицитный и дорогостоящий металл, можно использовать посеребренную пластинку или ограничиться пятью металлами (серебро исключить).
Чтобы пластинки металлов не проваливались в трубки, их следует вставить в резиновые кружочки 12, диаметр которых чуть больше диаметра трубок. Для соединения пар металлических пластинок с гальванометром используют два проводника 13, один конец которых имеет штекер (диаметр его соответствует диаметру штекерного гнезда рамы), а второй конец — лепесток для подсоединения к клеммам гальванометра.
Предлагаемый в данном пособии прибор имеет преимущества перед вышеупомянутым; он более надежен и удобен в работе и дает более точные результаты. В приборе, показанном в школьном учебнике, происходит подсыхание полосок фильтровальной бумаги, нередко неравномерное, что отрицательно сказывается на результатах опыта. Прибор позволяет демонстрировать опыты в нескольких параллельных классах без перезарядки.
Для иллюстрации электрохимического ряда напряжений металлов с помощью данного прибора стеклянные трубки 3 заполняют растворами солей соответствующих металлов одинаковой молярной концентрации и погружают в них металлические пластинки. Ванночку 2 заполняют раствором соли любого электролита, например хлорида калия. С помощью проводников со штекерами 13 соединяют попарно металлические пластинки 11 с гальванометром. Отклонение стрелки гальванометра будет тем большим, чем дальше отстоят друг от друга металлы.
Аналогичные опыты могут быть спроецированы на экран с помощью графопроектора, а также используют чашки Петри для раствора солей и соответствующие металлы в виде стерженьков.
Статья на тему Электрохимический ряд напряжений
Похожие страницы:
КАК ОЧИСТИТЬ РТУТЬ В химических лабораториях часто возникает необходимость очистить жидкий металл. Метод, описанный в этой заметке, пожалуй, самый простой.
РЕЗОНАНС НАПРЯЖЕНИЙ Если по неразветвленной цепи (рис. 5-30), состоящей из активного сопротивления r, индуктивности L и емкости С, проходит ток i = Iм sin ωt то напряжение.
Определение молекулярного веса пара На основе закона Авогадро можно определять молекулярные веса не только газов, но и всех веществ, переходящих.
Простые эфиры Простыми эфирами называются органические соединения, молекулы которых состоят из двух углеводородных радикалов, связанных с атомом кислорода. Примером может.
Ряд активности металлов это последовательность в которой металлы расположены в порядке увеличения их стандартных электрохимических потенциалов. Металлы в ряду активности.
Атомарный водород это химический элемент который неустойчив почти сразу переходит в обычный водород выделяя при этом некоторую температуру. Даже при.
Понравилась статья поделись ей
Leave a Comment
Для отправки комментария вам необходимо авторизоваться.
Источник: znaesh-kak.com