Построение мицеллы золя (продолжение).
Задача. Золь сульфата бария получен смешением равных объемов растворов нитрата серебра и серной кислоты. Написать формулу мицеллы золя и определить, к катоду или аноду в электрическом поле будет перемещаться гранула?
V= , если объемы равные по условию задачи,то = .Отсюда m1 < m2, т.е. H2SO4 (избыток).
Строение мицеллы золя:
ядро адсорбционный дифуз. дисперсионная среда
Так как гранула отрицательно заряжена, то частица будет перемещаться в электрическом поле к положительному аноду.
Задача. Золь бромида серебра получен путем смешивания равных объемов 0.008н раствора бромида кали и 0.0096н раствора нитрата серебра. Определить знак заряда частицы зол и ее направление в электрическом поле.
Решение: Химическая реакция KBr + AgNO3 = AgBr + KNO3
1н — 119г 1н — 170г
0.008н -хг х= =0.952г 0.0096г – хг х= =1.632г избыток AgNO3
Структура мицеллы золя:
Cамостоятельно обозначить границы адсорбционного и диффузионного слоев, гранулы и ее заряда, мицеллы золя, дисперсионной среды, границы золя. Движение к катоду или аноду?
Розово Голубое Очарование Драгоценных Камней ✨ , Родий Серебро+7 928 394 26 55…
Методы получения коллоидных систем: 1.дисперсионный – раздробление грубодисперсных веществ до размеров 1-100 нм, 2. конденсационный – укрупнение частиц за счет слипания атомов или молекул веществ.
Коагуляция – процесс укрупнения коллоидных частиц в результате их слипания.
Седиментация – процесс выпадения или всплытия коллоидных частиц под действием силы тяжести или силы выталкивания. Далеко зашедшая коагуляция.
Коагуляция и седиментация – два взаимопродолжающихся процесса.
(невидимая) -осадок, всплытие
-цветовые изменения в системе
Факторы, вызывающие коагуляцию: повышение температуры, добавление электролита, прибавление золя с противоположным зарядом гранулы (взаимная коагуляция).
Эти факторы снижают поверхностную энергию и уменьшают поверхность раздела двух фаз.
Причина состоит в том, что диффузионный слой мицеллы золя десольватируется, сжимается. Теряется его способность отталкивать соседние коллоидные частицы. Возрастает действие сил межмолекулярного притяжения. Идет коагуляция с переходом в седиментацию.
Та наибольшая величина ξ(кси) -потенциала, при которой коагуляция протекает с заметной скоростью, называется критической. Для многих золей она составляет 25 – 30 мв. При значениях ξ(кси) –потенциала выше 30мв золи практически устойчивы. Чем величина ξ(кси) –потенциала ниже критической, тем с большей скоростью коагулируют золи. В изоэлектрическом состоянии коагуляция золей протекает с предельной скоростью.
Повышение температуры приводит к повышению коагуляции потому, что тепловое движение частиц снижает сольватацию(гидратацию).
Чаще всего коагуляцию вызывают добавкой электролитов. Для начала явной коагуляции необходимо прибавить к золю некоторое минимальное количество электролита (с), называемое порогом коагуляции. При концентрациях электролита, меньших порога, коагуляция протекает в скрытом состоянии.
Разбор кармических задач для тех кто родился 10.06.1989
Коагулирующая способность Р иона называется величина, обратная порогу коагуляции. Р= Коагуляцию золей вызывают те из ионов прибавляемого электролита, заряд которых противоположен заряду гранулы золя. Согласно правилу Шульце – Гарди чем выше валентность коагулирующего иона, тем сильнее выражено его коагулирующая способность.
Коагулирующая способность ионов одной и той же валентности зависит от гидратации ионов. Чем больше гидратация, тем больше порог коагуляции и ниже коагулирующая способность иона. Порог коагулции у золей невелик и выражается в миллимолях или миллиграмм-эквивалентах на 1л золя ( или ).
Дл золя As2S3 c отрицательной гранулой электролиты К + , Ba 2+ , Al 3+ вызывают коагуляцию. Р(К + ) : Р(Ba 2+ ) : Р(Al 3+ ) =1:72:540. Чем выше степень окисления, тем выше коагулирующая способность и меньше порог коагуляции.
Задача 1.В три колбы налито по 100см 3 (мл) золя Fе(ОН)3.
Для того, чтобы вызвать коагуляцию золя, потребовалось добавить: в первую колбу – 10.5 мл 1н.раствора хлорида калия, во вторую — 62.5мл 0.001н.раствора фосфата натрия. Вычислить порог коагуляции каждого электролита и определить знак заряда частиц золя.
Решение: заряд ионов металлов одинаков(+). А количество веществ для коагуляции разное. Не они коагулянты, а анионы. Гранула мицеллы золя заряжена положительно.
Для КСl: масса его в растворе (10.5мл·1н):1000=0.0105г или 10.5мг СКСl=10.5:(100+10.5)=95мг/л
Для Na2SO4 : масса его в растворе (62,5·0.01н):1000=0.000625г или 0.625мг. С Na2SO4=0.625: (100+62,5)=3.8 мг/л
Для Na3PO4 : масса его в растворе (37.0·0.001н):1000= 0.000037г или 0.037мг. С Na3PO4 =0.037: (100+37)=0.27 мг/л.
Задача 2. Пороги коагуляции золя Fе(ОН)3 для электролитов КJ и K2Cr2O7 соответственно равны10,0 и 0,195 ммоль на 1л золя. Во сколько раз коагулирующая способность бихромата калия больше, чем у иодида калия?
Задача 3. Пороги коагуляции электролитов для золя иодида серебра в ммоль/л оказались равными
Какой заряд частиц данного золя? Вычислить коагулирующую способность каждого из электролитов.
Решение: Коагуляцию вызывают катионы. Поэтому гранула заряжена отрицательно.
Глина и песок имеют в воде отрицательный заряд гранулы мицеллы золя. Пример мутная вода реки Урал.
Для её очистки применяют сульфат алюминия. Коагулянт взаимодействует с водой
Строение мицеллы золя:
Гранула положительно заряжена, а в реке отрицательно. Происходит притяжение и совместное выпадение золей.
Тест
Коагуляция. Определение порога коагуляции.
1.Закончите предложение: процесс укрупнения коллоидных частиц в результате их слипания – это …
2. Закончите предложение: процесс выпадения коллоидных частиц в осадок под действием силы тяжести или всплытия их под действием сил выталкивания – это … (коагуляция, седиментация, поверхностная энергия.)
3. Закончите предложение: седиментация – это далеко зашедшая … .
4.Два взаимопродолжающиеся процесса – это:
А. коагуляция и поверхностная энергия. Б.коагуляция и седиментация. В. седиментация и поверхностная энергия.
5.Исключите лишнее. Коагуляция классифицируется на: А. скрытую Б. невидимую В. явную Г.неявную.
6. Найдите соответствие:
| Коагуляция | Явления при коагуляции |
| 1. Скрытая 2. Явная | А.выпадение осадка или всплытие частиц Б.образование хлопьев В.помутнение дисперсионной среды Г.изменение цвета дисперсионной среды Д.изменения не фиксируются невооруженным взглядом. |
7.Взаимная коагуляция – это осаждение золей при добавлении золя с зарядом :
А.одинаковым с гранулой мицеллы золя Б. противоположным грануле мицеллы золя.
8.Факторы, снижающие поверхностную энергию коллоидной системы:
А. изменение температуры Б. добавление электролита В. добавление другого золя с противоположным зарядом гранулы Г. все ответы верны.
9.Критическим кси-потенциалом для коллоидных систем является поверхностная энергия в мВ:
А. 10 Б. 15 В. 25-30 Г. более 30.
10. При критическом кси-потенциале для коллоидных систем скорость коагуляции:
А. минимальная Б. максимальная В. постоянная.
11.При изменении рН системы белков коагуляция с последующей седиментацией :
А. наблюдается Б. не наблюдается.
12. Минимальное количество электролита, добавленного в дисперсную систему, вызывающее явную коагуляцию, называют:
А. кси-потенциалом Б. порогом коагуляции В. сольватацией.
13. Закончите предложение: величина, обратная порогу коагуляции, называется … .
14.Правило Шульце – Гарди определяет коагулирующее действие иона электролита от:
А. концентрации Б. температуры В. валентности.
15. Коагулирующая способность ионов электролита с одинаковой валентностью от гидратации их:
А. зависит Б. не зависит.
16. При больщой гидратации:
А. порог коагуляции больше, Р меньше. Б. порог коагуляции меньше, Р больше.
17. Единица измерения коагуляции: А. ммоль/л Б. мг-экв/л В. мВ.
Ранжирование: «5»- 20 баллов. «4»- 16-19 баллов. «3»- 12-15 баллов. «2»- менее 11 баллов.
Источник: helpiks.su
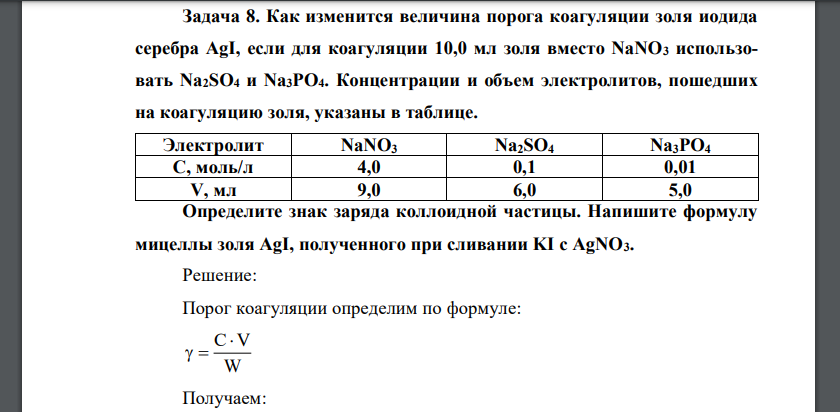
Как изменится величина порога коагуляции золя иодида серебра AgI, если для коагуляции 10,0 мл золя
Порог коагуляции определим по формуле: Получаем: Определим изменение порогов коагуляции: Таким образом, если вместо NaNO3 использовать Na2SO4, порог коагуляции уменьшится в 47 раза, Na3PO4 – в 630 раз. Данные электролиты различаются зарядами анионов, т.е. коагулирующим действием обладают анионы. По правилу Шульце-Гарди получаем, что гранула заряжена положительно, потенциалопределяющими ионами являются катионы. Запишем формулу мицеллы золя AgI, полученного при сливании KI с AgNO3 Ответ: в 47 раз; в 630 раз

Похожие готовые решения по химии:
- Покажите применимость теории Смолуховского к коагуляции золя селена раствором хлорида калия, определив
- Определите скорость оседания частиц радиусом 1·10–6 м, образующихся после помола кофе в воде (η = 1·10–3 Н·с/м2 )
- Вязкость аллилового спирта определялась по методу истечения жидкости из капилляра, радиус которой равен
- Рассчитайте растворимость соли А в воде и ее произведение растворимости по значениям удельного сопротивления
- Взяты вещества: гептан и гептиловая кислота. Какое из них будет лучше растекаться по воде, если работы
- По изотерме адсорбции бензола при 293 К рассчитайте удельную поверхность адсорбента, если площадь,
- По уравнению Ленгмюра вычислите величину предельной адсорбции и площадь, занимаемую одной молекулой
- Вычислите величину электрокинетического потенциала ζ золя свинца в метиловом спирте, если за 10 мин уровень раствора
- Используя приведенные в корреляционной таблице данные, требуется: 1. Найти числовые характеристики выборки – средние
- В результате хроматографирования на бумаге анализируемого раствора, содержащего смесь двух катионов X 2+ и Z 2+, с использованием
- Покажите применимость теории Смолуховского к коагуляции золя селена раствором хлорида калия, определив
- По корреляционной таблице требуется: 1) вычислить условные средние ̅ , ̅ и построить ломаные регрессии; 2) вычислить
При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Telegram и логотип telegram являются товарными знаками корпорации Telegram FZ-LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.
Источник: www.evkova.org
Примеры решения типовых задач. Задача 1. Пороги коагуляции золя электролитами оказались равными (моль/л): C(NaNO3) = 0,25; C[Fe (NO3)3] = 0,0005; C[Mg(NO3)2] = 0,02
Задача 1. Пороги коагуляции золя электролитами оказались равными (моль/л): C(NaNO3) = 0,25; C[Fe (NO3)3] = 0,0005; C[Mg(NO3)2] = 0,02. Какие ионы электролитов являются коагулирующими? Как заряжены частицы золя?
Решение: Все применяемые в качестве коагулянтов электролиты содержат нитрат анион. Если коагулирующей способностью обладали бы анионы коагулянта, то пороги коагуляции для всех электролитов должны были быть одинаковыми. Однако, в ряду Na + , Mg 2+ , Fe 3+ значения порогов коагуляции резко уменьшаются. То есть, с ростом заряда катиона коагулянта порог коагуляции падает.
Как известно, коагулирующей активностью обладают ионы, противоположно заряженные по отношению к коллоидной частице. Поэтому можно заключить, что коллоидная частица изучаемого золя имеет отрицательный заряд.
Ответ: коагулирующими являются ионы Na + , Mg 2+ , Fe 3+ . Коллоидная частица заряжена отрицательно.
Задача 2. Золь кремниевой кислоты Н2SiO3 был получен при взаимодействии растворов К2SiO3 и HCl. Напишите формулу мицеллы золя и определите, какой из электролитов был в избытке, если противоионы диффузного слоя в электрическом поле движутся к катоду?
Решение: Если противоионы диффузного слоя движутся к катоду, то они имеют положительный заряд, а коллоидная частица – отрицательный. Следовательно, потенциал образующими ионами в процессе мицеллообразования оказались отрицательно заряженные анионы SiO3 2- .
Из сказанного следует, что в избытке была взята кремневая кислота, а мицелла имеет формулу, приведенную ниже:
Задача 3. Какой объем 0,0025 м КI надо добавить к 0,035 л 0,003 н Рb(NO3)2, чтобы получить золь иодида свинца и при электрофорезе коллоидная частица двигались бы к аноду. Напишите формулу мицеллы золя.
Решение: Так как коллоидная частица двигается к аноду, значит коллоидная частица заряжена отрицательно. Следовательно, при образовании золя в избытке оказался иодид калия, а мицелла имеет формулу:
Пользуясь законом эквивалентов можно подсчитать объемы реагирующих растворов для полной нейтрализации: V1C1(1/z) = V2C2(1/z).
где C(1/z) – молярная концентрация эквивалента, моль/л.
Задача 4. Свежеполученный и очищенный осадок Al(OH)3 разделили на 3 части. К первой добавили небольшое количество растворов, содержащих (перечисление по порядку добавления) Al2(SO4)3, HCl и Н2SO4, соответственно. Во всех трех случаях образовались золи гидроксида алюминия. Напишите формулы мицелл образовавшихся золей. Какой заряд будут иметь гранулы?
Решение. При введении в раствор катионов алюминия, не границе раздела фаз осадок/раствор происходит адсорбция катионов алюминия на рыхлой и активной поверхности гидроксида алюминия. Таким образом, ядро из молекул гидроксида алюминия, заряжается положительно.
К этому агломерату притягиваются противоположно заряженные сульфат анионы (в растворе имеются только сульфат анионы), которые формируют слой ионов внутренней обкладки. Таким образом, появляется двойной электрический слой с определенным электрическим потенциалом.
При этом, число отрицательных зарядов привнесенные сульфат анионами, в сумме, меньше, чем суммарный положительный заряд катионов алюминия. Поэтому, образованная гранула – коллоидная частица имеет положительный заряд. К положительно заряженной грануле притягиваются противоионы – отрицательные сульфат анионы, которые формируют диффузный слой противоионов. Таким образом, при введении в раствор сульфата алюминия наблюдается частичное растворение осадка с переходом в раствор, где формируется гидрозоль гидроксида алюминия. Это явление называется химическая пептизация.
Когда к раствору с осадком гидроксида алюминия добавили раствор серной кислоты, то произошла химическая реакция нейтрализации, в результате чего осадок гидроксида алюминия частичен растворяется, а в растворе, над осадком появляются катионы алюминия:
Наличие в растворе свободных катионов алюминия способствуют процессу химической пептизации (см. выше). В результате пептизации еще некоторая часть осадка гидроксида алюминия переходит в раствор, где формируются гидрозоли гидроксида алюминия точно такой же структуры (см. выше), что и в первом случае.
При введении в раствор соляной кислоты, наблюдаются те же процессы, что и во втором, только здесь в качестве противоионов вступают анионы хлора.
и далее формируется соответствующий гидрозоль:
Во всех трех случаях заряд коллоидной частицы положителен, так как во всех случаях потенциал определяющим ионом являются катионы алюминия.
3) <[nAl(OH)3 mAl 3+ (m- 3x)Cl — ] 3 x + 3x Cl — >
Варианты задач по теме 4.1. дисперсные системы
1. Являются ли коллоидные растворы гомогенными системами? Какова дисперсность коллоидных растворов?
2. Какие условия необходимо соблюдать при получении гидрозолей?
3. Как можно разрушать коллоидные системы. Назовите их и приведите примеры. Коагуляция, полог коагуляции и методы его определения.
4. Определение заряда коллоидных частиц методом электрофореза.
5. Физико-химическая трактовка явления светорассеивания (эффект Тиндаля) в коллоидных системах.
6. Каков состав ядра коллоидной частицы в растворе: а) сульфида сурьмы; б) гидроксида железа(Ш), иодида свинца (II) и бромида серебра?
7. Какие ионы могут быть заряд образующими в коллоидной частице золя: а) гидроксида железа(Ш); б) сульфида сурьмы?
8. Запишите формулу мицеллы золя: а) гидроксида железа (Ш) при смешении раствора хлорида железа ((Ш)) с менее концентрированным раствором гидроксида натрия.
9. Перечислите, какие методы коагуляции вам известны? В чем заключается явление коагуляции?
10. Почему при пропускании постоянного тока через раствор гидрозоля он коагулирует? Как можно использовать этот метод для определения заряда коллоидных частиц?
11. Что называют эффектом Тиндаля? Как используется этот эффект для идентификации коллоидных растворов?
12. Перечислите известные вам методы получения коллоидных растворов, опишите их суть.
13. Перечислите условия, при которых смешение растворов не приводит к образованию гидрозоля?
14. Почему образование гидрозоля не происходит, если смешать равные эквивалентные количества электролитов?
15. Какие гидрозоли надо смешать друг с другом, чтобы произошла совместная коагуляция этих золей? Приведите практический пример такой коагуляции.
16. Ионы какого заряда обладают коагуляционной активностью?
17. Почему на практике в водоканалах в процессах очистки воды используют сульфат алюминия или сульфат железа (III)?
18. Напишите формулу мицеллы сульфата бария, полученного сливанием равных объемов раствора BaCl2 и менее разбавленного раствора Н2SO4.
19. Какой объем 0,001М AsCl3 надо добавить к 0,02 л 0,003 М H2S, чтобы не произошло образование золи сульфида мышьяка, а выпал в осадок As2S3.
20. Напишите формулу мицеллы золя бромида серебра, полученного при взаимодействии разбавленного раствора нитрата серебра с избытком бромида натрия. Какой заряд гранула? Как изменится этот заряд, если в избытке окажется нитрат серебра?
21. Золь иодида серебра получен добавлением к 20мл раствора KI (СМ=0,01моль/л) 28 мл раствора AgNO3 (CМ=0,005 моль/л). Напишите формулу мицеллы полученного золя и определите направление движения гранулы золя при электрофорезе.
22. Свежеполученный и очищенный осадок Fe(OH)3 разделили на 2 части. К первой добавили небольшое количество FeCl3, а к другой НСl. В том и другом случае образовался золь гидроксида железа (III). Напишите формулы мицелл золя. Какой заряд будут иметь гранулы?
23. Какой объем 0,0002 М Fe(NO3)2 требуется для коагуляции 0,025л золя сульфида мышяка, если порог коагуляции равен 0,067 ммоль/л?
24. Золь кремниевой кислоты H2SiO3 был получен при взаимодействии раствора K2SiO3 и HCl. Напишите формулу мицеллы золя и определите какой из электролитов был в избытке, если противоионы в электрическом поле движутся к катоду?
25. Пороги коагуляции электролитов для некоторого гидрозоля равны: СNaNO=300 ммоль/л; CMgCl=25 ммоль/л; CNa SO =295 ммоль/л; CAlCl =0.5 ммоль/л. Какой заряд несут гранулы золя?
26. Напишите формулы мицелл золей иодида серебра, полученного при взаимодействии разбавленных растворов AgNO3 и KI при условиях: а) KI в избытке; б) KI в недостатке.
27. Для коагуляции 10 мл золя иодида серебра потребовалось 4,5мл раствора нитрата бария, молярной концентрацией 0,05 моль/л. Определите порог коагуляции электролита.
28. Свежеполученный и очищенный осадок As2S3 разделили на 2 части. К первой добавили небольшое количество разбавленного раствора хлорида мышяка, а к другой сульфид натрия. Напишите формулы мицелл образовавшихся золей.
29. Золь кремниевой кислоты H2SiO3 был получен при взаимодействии раствора K2SiO3 и HCl. Напишите формулу мицеллы золя и определите, какой из электролитов был в избытке, если гранулы гидрозоля в электрическом поле движутся к аноду?
30. Для коагуляции 20 мл золя сульфида мышяка (V) потребовалось 2,0мл раствора сульфата алюминия, молярной концентрацией 0,05 моль/л. Определите порог коагуляции электролита.
31. Напишите формулу мицеллы ортофосфата кальция, полученного сливанием равных объемов раствора СaCl2 и менее разбавленного раствора Н3РO4.
32. Золь бромида серебра получен добавлением к 50мл раствора KBr (СМ=0,02моль/л) 40 мл раствора AgNO3 (CМ=0,001 моль/л). Напишите формулу мицеллы полученного золя и определите направление движения гранулы золя при электрофорезе.
33. Золь гидроксида железа (III) получен смешиванием равных объемов 0,002 н NaOH и 0.0003 М Fe2(SO4)3. Какой знак имеют частицы образовавшегося золя? Напишите формулу мицеллы.
34. Как расположатся пороги коагуляции в ряду CrCl3; Ba(NO3)2; K2SO4 для золя ортофосфата серебра, гранулы которого при электрофорезе двигаются к аноду? Дайте мотивированный ответ.
35. Какой объем 0,0025 м KI надо добавить к 0,035л 0,003н Pb(NO3)2, чтобы получить золь иодида свинца и при электрофореза противоионы двигались бы к аноду. Напишите формулу мицеллы золя.
36. Напишите формулы мицелл гидрозолей ортофосфата кальция, полученного при взаимодействии разбавленных растворов ортофосфата натрия и хлорида кальция, при условии: а) при избытке ортофосфата натрия; б) при избытке хлорида кальция.
37. Для коагуляции 20 мл золя иодида свинца потребовалось 1,0 мл раствора хлорида алюминия, молярной концентрации 0,03 моль/л. Определить порог коагуляции этого электролита для золя иодида свинца.
38. Пороги коагуляции некоторого золя электролитами (нитраты натрия, магния и Fe 3+ ) оказались равными (моль/л): 0.25; 0,02 и 0,0005 соответственно. Какие ионы электролитов обладают коагулирующим действием? Как заряжена коллоидная частица?
39. Для коагуляции 50,0 мл золя PbI2 потребовалось 1,0 мл раствора Al2(SO4)3 молярной концентрации 0,025 моль/л. Определить порог коагуляции этого электролита для золя иодида свинца.
40. Составьте формулу мицеллы золя гидроксида алюминия, полученного при глубоком гидролизе сульфата алюминия.
Источник: studopedia.su