Т.е. представляет собой пластину, покрытую солью AgCl и помещенную в раствор КСl. На электроде протекает реакция:
Его электродный потенциал при 25 о С равен:
Измерительные электроды. Окислительно-восстановительные электроды и системы
Окислительно-восстановительными называются такие электроды (или цепи), в которых материал электродов не изменяется, а лишь служит источником или приемником электронов, получаемых или отдаваемых веществами, восстанавливающими или окисляющимися на поверхности электродов. Окислительно-восстановительный электрод состоит из инертного металла, погруженного в раствор, содержащий окисленную и восстановленную форму вещества. В простой окислительно-восстановительной системе электродная реакция состоит в изменении заряда ионов по схеме:
Аок, Авос½Pt при протекании реакции
Электродный потенциал определяется выражением:
Примером такого электрода может служить пластина из платины, опущенная в раствор, содержащий хлористое железо и хлорное железо, т.е. FeCl2 и FeCl3, т.е. FeCl2 и FeCl3. Схема электрода:
4 3 Электрохимический потенциал
Электродная реакция Fe 2+ «Fe 3+ +e (Fe 3+ +e«Fe 2+ )
Электродная реакция пойдет вправо или влево в зависимости от того с каким другим электродом данный электрод составляет гальванический элемент. Электродный потенциал равен:
где Е 0 – нормальный окислительно-восстановительный потенциал при аFe3+=aFe2+=1 г-ион/дм 3 .
Значения нормальных окислительно-восстановительных потенциалов также представляются в виде таблиц, при этом значение их определяется также по отношению к водородному электроду.
(Fe 3+ +e®Fe 2+ )=0,771 B;
(Cu 2+ +e®Cu + )=0,153 B;
(Cr 3+ +e®Cr 2+ )=-0,41 B.
Примером сложной окислительно-восстановительной системы может служить система ионов МnO4 — и Mn 2+ . Схема такого элемента имеет вид: MnO4 — ,Mn 2+ ,H + ½Pt
а потенциал электрода определяется выражением:
Потенциометрическое определение рН и потенциометрическое титрование
Определение каких-либо свойств электролита или электродов путем измерения ЭДС гальванических цепей называют потенциометрическими определениями. Из потенциометрических определений наиболее распространенными являются определение рН и потенциометрическое титрование.
Определение рН растворов потенциометрическим методом может осуществляться тремя методами (по виду применяемого электрода): водородным, хингидродным или с помощью стеклянного электрода.
Для определения рН с помощью водородного электрода составляют цепь, состоящую из водородного и каломельного электрода.
ЭДС такой цепи равно
Подставляя значение Екал и и выражая рН, определяют рН раствора. рН=1/ао(Е–Екал), где ао=RT×23/F.
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
Источник: studopedia.ru
Большая Энциклопедия Нефти и Газа
Это соотношение полезно тем, что по нему можно получить неизмеряемые прямыми методами потенциалы металлических электродов. Как отмечалось ранее, потенциал серебряного электрода трудно измерить более прямыми методами. [50]
Электродные потенциалы металлов. Электроды сравнения
Индикатором служит серебряный электрод. Как видно из рисунка, потенциал серебряного электрода изменяется вначале очень медленно, но вблизи эквивалентной точки х происходит резкий скачок. [52]
В присутствии анионов, образующих с ионами серебра малорастворимое соединение ( AgCl, AgBr и др.), потенциал электрода зависит от активности ( концентрации) аниона. Например, в растворе, содержащем хлорид-ионы, потенциал серебряного электрода зависит от активности хлорид-ионов. [54]
Построение кривой титрования и выполнение определения почти не отличается от анализа хлоридов. Разница заключается в том, что в начале титрования потенциал серебряного электрода отрицательнее потенциала каломельного электрода ( см. табл. 14), поэтому последний необходимо приключить к клемме Х, а индикаторный электрод — к клемме — X. В процессе титрования потенциал серебряного электрода возрастает, а разность потенциалов между обоими электродами уменьшается. Сразу же после точки эквивалентности потенциал серебряного электрода становится больше потенциала каломельного электрода и поэтому электроды переключают. [55]
Источник: www.ngpedia.ru
1.5.1. Электроды первого рода
К электродам первого родаотносят металлические электроды, обратимые относительно катионов, и металлоидные, обратимые относительно анионов. Обратимость электрода относительно тех или других ионов означает зависимость его потенциала от концентрации (активности) потенциалопределяющих ионов.
Примерами электродов первого рода являются системы, представляющие собой металлы, погруженные в растворы своих солей М z+ │М(обратимые к катиону), и металлоидыМе z- │Ме(обратимые к аниону). Их электродные реакции можно записать так:
М 2+ + ze — ⇄ M,
Me + ze — ⇄ Me z- .
Подстановка активностей веществ, участвующих в электродной реакции в уравнение Нернста (14), дает для металлического электрода первого рода уравнение Нернста в виде

(25)
и для металлоидного электрода
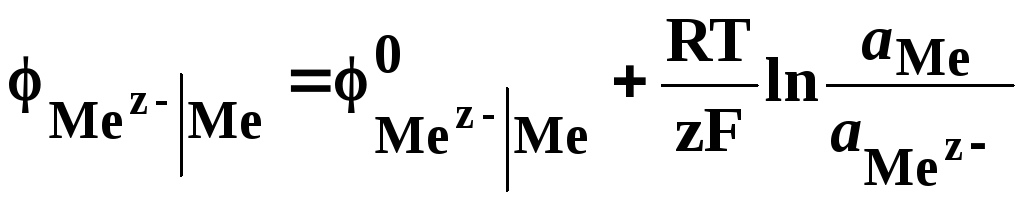
. (26)
Если считать, что активность чистых веществ равна единице, то получим

, (27)

(28)
Из уравнений (27) и (28) следует, что с ростом активности потенциалобразующих ионов потенциал электрода, обратимого по отношению к катиону растет; а к аниону – уменьшается.
Примерами электродов первого рода, обратимых к катиону, являются: цинковый Zn 2+ │Zn, медныйCu 2+ │Cu, кадмиевыйCd 2+ │Cd, серебряныйAg + │Agэлектроды. Примером металлоидных электродов первого рода может служить селеновый электродSe 2- │Se. Его электродная реакция:
Se + 2e — ⇄ Se 2- ,

. (29)
Металлические электроды первого рода часто используют в качестве индикаторных электродов в аналитической химии. Индикаторные электроды позволяют определить активность (концентрацию) ионов металла путем измерения их потенциалов.
1.5.2. Электроды второго рода
Электродами второго роданазываются электроды, обратимые относительно катиона и аниона. В потенциалопределяющей реакции на этом электроде принимают участие как катионы, так и анионы. Такие электроды представляют собой систему, состоящую из металла, покрытого слоем трудно растворимой соли, погруженного в раствор, содержащий одноименные анионы с трудно растворимой солью. Схематически его можно представить так:
A z- │MA│M. (30)
На нем протекает электродная реакция
MA + ze — ⇄ M + A z- . (31)

Уравнение Нернста для электродного потенциала электродов второго рода выводится идентично уравнению (14) и его можно записать . Учитывая, что активность металла М и твердого соединения МА постоянны и равны единице, уравнение Нернста для электродов второго рода может быть представлено в виде

(32)
То есть, потенциал электродов второго рода определяется активностью анионов трудно растворимой соли электродного металла. Активности катионов и анионов трудно растворимой соли находятся во взаимной зависимости

, (33)
где ПРМА– произведение растворимости;

 — активность катионов и анионов, соответственно.
— активность катионов и анионов, соответственно.

Подставляя значение из формулы (33) в уравнение электродного потенциала (32), получим
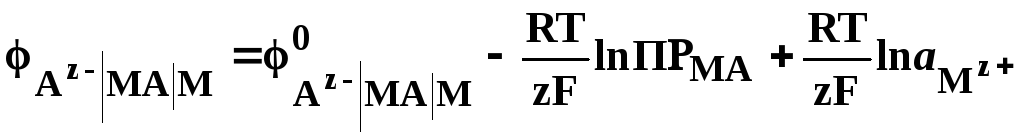
.

Первые два члена этого уравнения постоянные величины при постоянной температуре, обозначим их разность . Тогда получим уравнение Нернста такое же, как для электродов первого рода:

. (34)
Вследствие устойчивости потенциалов, хорошей воспроизводимости измерений электроды второго рода могут быть использованы как электроды сравнения. Электроды сравнения – это электроды, потенциалы которых заранее известны при заданной концентрации растворов хлорида калия. Наиболее употребительны каломельный и хлорсеребряный электроды.
Каломельный электрод– это электрохимическая система, состоящая из ртути, покрытой пастой из смеси каломели и ртути, и находящаяся в контакте с раствором хлорида калия:
Cl — │Hg2Cl2│Hg.(35)
На электроде протекает реакция
Hg2Cl2 + 2e — ⇄ 2Hg + 2Cl — . (36)
Потенциалы каломельного электрода

(37)
Наиболее часто употребляются каломельные электроды с концентрациями растворов хлорида калия 0,1 н; 1,0 н и насыщенный раствор. Потенциалы электродов при этом соответственно равны 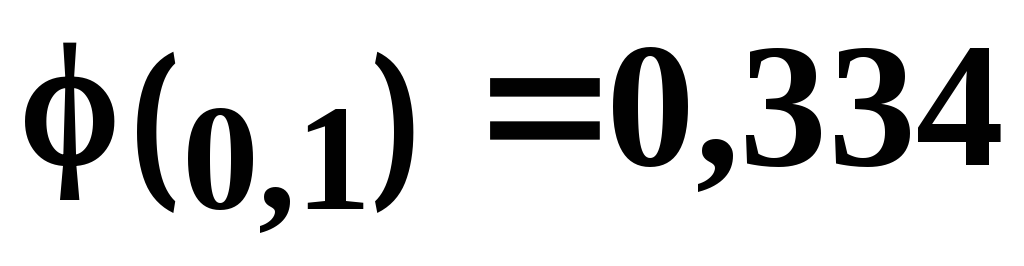
 и
и Электроды с растворами хлорида калия 0,1 н и 1,0 н чаще применяются на практике, так как и потенциалы слабо зависят от температуры. Схема каломельного электрода приведена на рис. 4.
Электроды с растворами хлорида калия 0,1 н и 1,0 н чаще применяются на практике, так как и потенциалы слабо зависят от температуры. Схема каломельного электрода приведена на рис. 4.
Хлорсеребряный электрод– металлическое серебро, покрытое слоем трудно растворимой соли AgCl, и погруженное в раствор хлорида калия:
Cl — │AgCl│Ag(38)
На электроде протекает реакция
AgCl + e — ⇄ Ag + Cl — , (39)
а его потенциалу отвечает уравнение

. (40)
Конструктивно этот электрод идентичен каломельному и в настоящее время широко применяется в электрохимических исследованиях. Потенциал хлорсеребряного электрода (KCl насыщенный раствор) при 25 0 С составляет 0,222 В. Схема серебряного электрода приведена на рис. 4б.
Источник: studfile.net