Потенциометрические методы анализа делятся на потенциометрическое титрование и прямую потенциометрию. Потенциометрическое титрование преследует чисто прикладную цель количественного определения данного вещества в растворе путем его титрования стандартным раствором соответствующего реагента. При титровании в исследуемый раствор опускают индикаторный электрод, возникновение потенциала на котором обусловливается определяемым веществом непосредственно (если оно электроактивно) или косвенно (если оно неэлектроактивно) в результате химического взаимодействия его с каким-либо другим потенциалопределяющим компонентом. В процессе химической реакции (например, титрования) за изменением концентрации определяемого вещества следят по изменению потенциала индикаторного электрода.
Потенциометрическое титрование при прочих равных условиях имеет ряд преимуществ по сравнению с визуальными титриметрическими методами анализа. К применяемым в потенциометрическом титровании химическим реакциям предъявляются те же требования, что и при обычном титриметрическом анализе.
Потенциометрическое титрование практикум
В отличие от обычного титриметрического метода, основанного на применении цветных индикаторов, в потенциометрическом методе титрования индикатором является электрод, на котором протекает индикаторная электрохимическая реакция. Скачок потенциала в точке эквивалентности или вблизи нее дает возможность найти конечную точку титрования по кривым титрования или сам скачок принимается как показатель момента завершения реакции.
Для определения хлорид ионов применяется метод осадительного титрования. Определение ведётся титрованием раствором с ионами серебра. Индикаторный электрод – серебро металлическое.
Химическая реакция выражается уравнением:
Разность равновесных потенциалов между двумя точками титрования, отвечающая скачку потенциала, равна:
ΔЕ = Е2 – Е1 = Е2 0 – Е1 0 + υ lg 10 -3 = υlg 10 -8 – υlg ПPAgСl
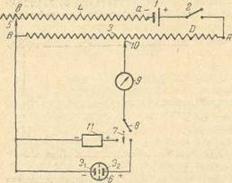
1 – источник постоянного тока с малым выходным напряжением; 2 – включатель тока; 3 – делитель напряжения; 4 – переменное сопротивление; 5, 10 – скользящие контакты; 6 – электролитическая ячейка: 7 – переключатель тока; 5 – прерыватель тока; 9 – индикатор тока; 11 – элемент Вестона; Э1 и Э2 – электроды (индикаторный и сравнения).
Рисунок 2.3 – Простейшая схема установки для измерения э.д.с. гальванических элементов компенсационным методом при потенциометрическом титровании
Измерение потенциала возникающего в цепи измеряется потенциометрами. Почти все приборы для измерения э.д.с. потенциометрической ячейки – потенциометры – имеют следующую схему (рис. 2.3).
Один полюс внешнего источника постоянного тока через переключатель неподвижно присоединен к одному из концов (Л) делителя напряжения с равномерным сечением проволоки и с небольшим сопротивлением (10 – 100 ом). Делитель напряжения обычно снабжен шкалой с равномерными 1100 делениями.
Другой полюс источника тока присоединен к переменному сопротивлению малой величины, с которым второй конец (В) делителя напряжения соединяется с помощью подвижного контакта. Таким образом, напряжение источника падает на постоянном участке А В и на некотором участке переменного сопротивления ав.
Занятие 9. Потенциометрическое определение содержания фосфорной кислоты
Конец В делителя напряжения присоединяют к одному из электродов Э, ячейки, соблюдая при этом полярность соединения, т.е. полюс источника тока и электрод тем же знаком должны быть присоединены к одному и тому же концу делителя. Второй электрод Э2 подключают последовательно через переключатель, прерыватель тока и индикатор тока к подвижному контакту, свободно перемещаемому на делителе напряжения. Дополнительно к концу В делителя напряжения подключают один из полюсов стандартного элемента Вестона (соблюдая тот же порядок полярности соединения, см. выше), другой полюс которого может быть соединен с помощью переключателя с подвижным контактом. Следовательно, при одном положении переключателя замыкается через прерыватель тока цепь, содержащая элемент Вестона, а при другом – цепь, содержащая потенциометрическую ячейку.
Элемент Вестона устанавливается для контроля цены одного деления шкалы делителя напряжения (в милливольтах), так как э. д. с. внешних источников тока известна с недостаточной точностью и со временем самопроизвольно падает (источник тока разряжается).
Определение С1 — в растворе проводят титрованием 0,05 н. стандартным раствором нитрата серебра с серебряным индикаторным электродом и Нас.КЭ сравнения. Э. д. с. потенциометрической ячейки измеряют компенсационным методом. Теоретически скачок наступает несколько раньше точки эквивалентности, но практически точка эквивалентности и конечная точка титрования совпадают.
При аргентометрическом титровании недопустимо применение электролитических ключей, заполненных насыщенным раствором хлорида калия; его следует заменить насыщенным раствором KNO3, не реагирующим с Ag + -ионами.
Вся предварительная настройка потенциометра, приемы работы и записи результатов аналогичны изложенным выше, но перед началом титрования раствор должен быть приблизительно 10%-ным относительно нитрата бария. Так как система гетерогенна и происходит адсорбция осадком титрующего и титруемого ионов, потенциал устанавливается не быстро, особенно вблизи конечной точки титрования. Поэтому следует ждать достижения более или менее постоянного значения Е. обычно пользуются данными которые за 1 мин изменяются не более чем на 3–5 мВ.
Расчет результата определения производится по формуле:
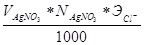
mCl- =
Источник: kazedu.com
Способ потенциометрического определения микрограммовых концентраций ионов серебра в воде
СОЮЗ СОВЕТСНИХСОЦИАЛИСТИЧЕСКИРЕСПУБЛИК А 9 0 01 Б 27/3 САНИЕ ИЗОБРЕТЕНИЯ ЧЕСКОГ 0 ЦЕН- аклюсилн и к елью х кон ения димос- вво- естве ОСУДАРСТВЕННЫЙ КОМИТЕТ СССРО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТКРЫТИЙ К АВТОРСКОМУ СВИДЕТЕЛЬСТВУ(71) Томский ордена Октябрьской Революции и ордена Трудового Красного Знамени политехнический институт им. С.М.Кирова(56) 1. Авторское свидетельство СССР Р 630576, кл.
0 01 Б 27/00, 1977.2. Электрод стеклянный лабораторный ЭСЛ-07. Технический паспорт.
Гомельский ЗИП, 1979 (прототип).( 54 ) ( 57) СПОСОБ ПОТЕНЦИОМЕТРИ ОПРЕДЕЛЕНИЯ МИКРОГРАММОВЫХ КРН ТРАЦИИ ИОНОВ СЕРЕБРА В ВОДЕ, з чающийся в измерении потенциал дикаторногб электрода из алюмо катного стекла в анализируемых либровочных растворах, о т л ч а ю щ и й с я тем, что, с ц расширения диапазона измеряешь центраций ионов серебра, повыш чувствительности и воспроизво ти определения, в оба раствора дят гидроокись кальция в колич 8+1 мг/л.Изобретение относится к способамопределения Физико-химических свойстввеществ в водной среде и может бытьиспользовано для анализа растворовпри производстве полупроводников,в сборных водах, в технологии получения различных иэделий из серебра, его соединений и сплавов,Известен потенциометрическийспособ непрерывного автоматическогоконтроля концентрации различныхионов, в котором использован ионоселективный электрод, содержащийполикристаллическую мембрану на основе халькогенидов и металлическийконтакт. Определяемая концентрациянаходится в интервале 1 моль/л10моль/л Е 13Однако известный способ обладаетневысокой точностью,Наиболее близким к изобретениюпо технической сущности и достигаемому эффекту является способ потенциометрического определения микрограммовых концентраций ионов серебра в воде, заключающийся в измерении потенциала индикаторного электрода из алюмосиликатного стекла ванализируемых и калибровочных растворах 12 1.Недостатком известного способаявляется низкая чувствительностьстеклянного ионоселективного электрода, с его помощью можно определять концентрацию ионов серебра неменее 1080 мкг/л (5,0 ед, рА).Целью изобретения является расширение диапазона измеряемых концен.траций ионов серебра и повышениечувствительности и воспроизводимости определения.1Поставленная цель достигаетсятем, что согласно способу потенциометрического определения микрограммовых концентраций ионов серебрав воде, заключающемуся в измерениипотенциала индикаторного электродаиз алюмосиликатного стекла в анализируемых и калибровочных растворах,в оба раствора вводят гидроокиськальция в количестве 81 мг/л.Определение концентрации ионовсеребра проводилось прямым потенциометрическим способом, в котором использован концентрационный элемент:внутренний полуэлемент стеклянногоэлектрода, внутренний раствор стеклянного электрода, мембрана стеклянного электрода, исследуемый раствор,электролитический ключ с 10-нымСа(МО), электролитический ключ снасыщенным КС 1, электрод сравненияА, 3 ЬС 1.На чертеже изображена предлагаемая установка.Установка содержит стеклянныйэлектрод 1 ЭСЛ-07, электрические ключи 2 двойного солевого моста,емкость З,.заполненную 10-ным раствором Са(МОз)2 , емкость 4, заполненную исследуемым раствором, емкость5, заполненную 10-ным растворомСайОЗ) , емкость б, заполненную на сыщеннйм раствором КС 1, электролитический ключ 7, заполненный насыщеннымраствором КС 1, вторичный прибор 8,мешалку 9, магнит 10.Приготавливалась серия калибровоч ных растворов с заданными значениямиконцентраций ионов серебра, в каждыйиз которых вводилось различное количество фонового электролита.
Послеэтого многократно измерялся потенциал электрода на установке с двоичным солевым мостом. Полученные данныеобрабатывались математически.
Длядоказательства существенности предла.гаемых в изобретении признаков в качестве фонового электролита применялись растворы гидроокисей натрия,калия, бария и кальция.Исходным для приготовления калибровочных растворов является раствор азотнокислого серебра с концентрацией 1000 мкг/л, который приготавливался из 0,001 н. раствораАХО, В свою очередь, 0,001 н раствор А И О приготавливался из навески АНО с последующим титриметри.30 ческим (по методу мора ) определениемконцентрации ионов серебра. Калибровочные растворы и растворы гидроокисей готовились с применением дистиллированной воды, из которой предва рительно был удален СО 2 . УдалениеСО производилось длительным (2-3 ч)кийячением дистиллированной водыс последующим охлаждением воды вемкостях, закрытых стеклянными труб 40 ками, заполненными аскаритом.Насыщенные растворы Са(ОН )2 иВа(ОН) приготавливались растворением2 г/л Са(ОН )2 или Ва(ОН)2 в дистиллированной воде без СО с последующей выдержкой Са(ОН ) с осадком в течение 1 сут., после чего растворотфильтровывался.
После приготовления серии калибровочных растворовс добавкой растворов гидроокисейнатрия, калия, бария и кальция производилась градуировка электродаЭСЛ-07 на предлагаемой установке,Для этого последовательно каждым изкалибровочных растворов заполняласьемкость 4, электрод выдерживалсяв данном растворе 2 мин (показания,вторичного прибора при этом не записывались, раствор выливался ). Затем снова этим же раствором заполнялась емкость 4, после чего записы вались показания электрода через2 мин и 5 мин с момента второго заполнения. По такой же методике производилось измерение потенциала элек.трода в каждом из последующих раство ров, причем измерения осуществлялись1081517 с 10-ным раствором Са(МО) имеетнаибольшую чувствительность и наилучшую воспроизводимость показаний(табл. эксперимент 10).Таким образом, предлагаемый спо соб повышает чувствительность индикаторного электрода и расширяет диапазон измерения серебряного электрода иэ алюмосиликатного стекла вобласть малых значений концентрации 10 ионов серебра до 8,0 ед.рА.Предложенный способ потенциометрического определения микрограммовыхконцентраций серебра в воде представляет большой практический интерес, так как может быть использован в ряде отраслей науки и техники, где требуется определение микроконцентраций серебра.Разработана инструкция прямого потенциометрического определения микроконцентраций серебра с использованием.выпускаемого отечественной промышленностью индикаторного электродаиз алюмосиликатного стекла (типаЭСЛ-07) и подтверждена достоверность предложенного способа на стандартных и производственных растворах различного типа для диапазонадо 8,0 ед.рА. Число Показа- Чувствиизмере- ния при- тельний бора, ность,мВ мВ Концентрациясеребра,мкг/л рА Условия эксперимен.та-81+3 8,0 от большей концентрации к меньшей, По полученным данным строилась градуировочная характеристика электрода в координатах мВ — рА или мВ — мкг/л.Для проведения анализа в мерную колбу на 200 мп добавлялся раствор гидроокиси кальция, после чего объем доводится до метки анализируемой водой. Емкость 4 заполнялась анализируемой пробой и производилось измерение потенциала электрода по методике, которая описана для калибровочных растворов. По графику с градуировочной характеристикой значение потенциала переводилось в концентрацию (мкг/л . Время анализа при настроенной аппаратуре и снятой градуировочной характеристике не более 5 мин. Погрешность единичного определения не более 10.В таблице даны зависимость и воспроизводимость показаний чувствительности А — селективного электрода от условий эксперимента.Индикаторный электрод из алюмосиликатного стекла в водной среде с добавкой гидроокиси кальция в количестве 8 мг/л и применении промежуточного электролитического ключа-120+6 Чувстви- тельность,мВ Лродспжение таблицы Условия эксперимента1081517 Продолжение таблицы Условия экспери- мента Экспе- римент 6 мг/л Са(ОН) 1080 10+2 34 48 5,0 5 мл/л насыщенного Са(ОН) 108 48 34 6,0 10 34 48 7,0/144 8,0 34 6 мг/л Са( ОН ) 1080 5,0 40 108 3,8 мл/л насыщенного Са( ОН )2 6,0 40 30 -60+530 -100+5 40/120 7,0 8,0 5,73 14 41+11 1,6 мг/л Са (ОН ) 20015 14 2610 100 16 1 мл/л насыщенного Са(ОН) 12 50 14 34/65 8,0 14 Составитель О. АлексееваРедактор Л. Гратилло Техред Т.фанта Корректор А. Тяско Заказ 1539/38 . Тираж 823 Подписное ВНИИПИ Государственного комитета СССР по делам изобретений и открытий 113035, Москва, Ж, Раушская наб., д. 4/5
Заявка
ТОМСКИЙ ОРДЕНА ОКТЯБРЬСКОЙ РЕВОЛЮЦИИ И ОРДЕНА ТРУДОВОГО КРАСНОГО ЗНАМЕНИ ПОЛИТЕХНИЧЕСКИЙ ИНСТИТУТ ИМ. С. М. КИРОВА
ДЕРКАСОВА ВАЛЕНТИНА ГЕОРГИЕВНА, ДЮПИН ВЛАДИМИР КУЗЬМИЧ, МИРОНОВА АНАСТАСИЯ АФАНАСЬЕВНА
Источник: patents.su
Потенциометрия
Потенциометрия — это ряд методов анализа и определения физико-химических характеристик электролитов и химических реакций, основанных на измерении электродных потенциалов и электродвижущих сил гальванического элемента.
Ионометрия — потенциометрический метод определения концентрации (активности) ионов, основанный на измерении электрохимического потенциала индикаторного электрода, погруженного в исследуемый раствор, относительно электрода сравнения.
Электродом сравнения называют электрод с известной и постоянной величиной электродного потенциала. Обычно в качестве электродов сравнения используют каломельный или хлоридсеребряный (часто называемый хлорсеребря-ным, что не совсем точно) электроды. Основной частью хлоридсереб-ряного электрода является погруженная в насыщенный раствор КС! серебряная проволока, покрытая слоем AgCl (рис. 6.1.1). Контакт электрода с раствором осуществляется через мостик из асбестовой нити, смоченной раствором КС1. с потенциометром — через серебряную проволоку. В основе электрода лежит окислительно — восстановительная реакция:
Индикаторным электродом (или электродом определения) называют электрод, который обратим относительно активности анализируемого по-тенциаяоопределяющего иона. Так, при изменении рН потенциал индикаторного электрода должен зависеть от активности (концентрации) ионов водорода в растворе. В качестве индикаторных электродов в последние годы используются ионоселективные мембранные электроды. Создание ионоселективных электродов (ИСЭ) способствует интенсивному развитию прямого потенциометрического определения многих ионов в растворе. В настоящее время выпускается около 30 ИСЭ.
Кроме давно применяемого стеклянного ионоселективного электрода для определения рН, используются электроды чувствительные к ионам F», СГ, NCV, Вт, Г, CN; S2~, NO3 NH/, Pb2+, Cu2+, Ni+, К4, а также ИСЭ для определения газов (СО2, МНз, НО, H2S, HCN, NO), мочевины и других азотсодержащих соединений. Важнейшей составной частью ионоселективного электрода является полупроницаемая мембрана. Это тонкая пленка, отделяющая внутреннюю часть электрода (внутренний раствор) от анализируемого раствора и обладающая способностью пропускать ионы только одного знака заряда (катионы или анионы). Во многих случаях эти мембраны проницаемы для ионов только одного сорта в присутствии других ионов того же знака заряда. Можно, например, изготовить электрод для определения ионов Na+ в присутствии ионов других щелочных металлов.
Поместим полупроницаемую мембрану между двумя растворами с разными концентрациями иона А+. Один из этих растворов — анализируемый (или внешний) имеет концентрацию сь другой — стандартный (или внутренний) — с2. На внешней и внутренней поверхностях мембраны будет происходить обмен ионами, т. е. ионы из раствора будут проникать в фазу мембраны (рис. 6.1,2).
Таким образом, электродная реакция на мембранном электроде сводится к обмену ионами А+ между раствором и мембраной:
А+ (раствор) ^ А+ (мембрана) и не связана с переходом электронов. Из-за того что активности ионов в растворе и в фазе мембраны различны, на обеих поверхностях мембраны возникнут граничные потенциалы EI и Е2. Если во внешний и внутренний растворы поместить электроды сравнения, то можно измерить разность потенциалов А, равную мембранному потенциалу
Электродвижущую силу (ЭДС) собранного гальванического элемента можно измерить, применяя любые потенциометрические устройства, сконструированные на основе токоусилительных систем. Для этой цели служат иономеры и рН-метры.
Прежде чем применить ИСЭ для аналитической цели, необходимо провести его электрохимическое изучение которое предусматривает установление основных характеристик, таких как интервал выполнения электродной функции, селективность и время отклика.
Методом построения градуировочного графика определяют область прямой концентрационной зависимости потенциала электрода (линейный участок электродной функции). При низких концентрациях (для очень хороших электродов при концентрации порядка 10″7 М) наблюдается отклонение от линейной зависимости (на рис. 6.1.4. — при концентрации меньше МО»5 моль/дм3), т. е. электрод утрачивает электродную функцию. Точка перегиба на графике характеризует предел обнаружения с помощью данного электрода (в приведенном примере — 1-Ю»5 моль/дм3). Полученную для стандартных растворов графическую зависимость в дальнейшем используют в качестве рабочего графика при определении активности или концентрации иона в анализируемых пробах.
Время отклика ИСЭ характеризует время достижения постоянного потенциала электрода. Время отклика для разных электродов может колебаться от нескольких секунд до нескольких минут. Это зависит от природы мембраны, а также от методики измерения потенциала, т. е. от того, переносят электрод из более разбавленного раствора в более концентрированный или наоборот. Для большинства электродов время отклика составляет 1 минуту.
В зависимости от материала, использованного для изготовления мембран, различают электроды с твердыми, стеклянными или жидкими мембранами. Стеклянные мембраны изготавливают из специальных стекол, подбирая их состав так, чтобы мембрана проявляла повышенную селективность к определяемому иону. Первым электродом со стеклянной мембраной был электрод, селективный относительно ионов водорода, который вытеснил все другие электроды, применявшиеся для измерения рН среды.
Стеклянный электрод (рис. 6.1.5) состоит из стеклянной трубки с припаянным тонкостенным стеклянным шариком (рН — чувствительная мембрана) на конце. В трубке находится раствор с постоянным значением рН (0,1 М НС1) и внутренний хлорид-серебряный электрод.
Теория стеклянного электрода была разработана Б. П. Никольским. При длительном вымачивании стеклянного электрода на обеих поверхностях мембраны образуется тонкий слой гидратированного геля. Все пустоты занимаются ионами Н*, вытеснившими находившиеся там ионы Na (которые входят в состав стекла). Перед работой стеклянный электрод некоторое время вымачивают в 0,1 М НС1.
Подготовленный таким образом электрод, в котором протоны поверхности стекла находятся в равновесии с протонами раствора, может быть использован для определения рН.
При погружении стеклянного электрода в раствор, рН которого отличается от рН внутреннего раствора, на стеклянной мембране возникает мембранный потенциал Ем, который можно измерить, поместив в исследуемый раствор внешний хлоридсеребрянный электрод.
Стандартный потенциал стеклянного электрода Е° обычно не определяют. При использовании заводских рН — метров эта операция заменяется настройкой приборов по стандартным буферным растворам, т. е. шкала рН — метра проградуирована непосредственно в единицах рН
Основными достоинствами стеклянного электрода являются простота работы, применимость в широкой области рН (от 0 до 12), быстрое установление равновесия и возможность определения рН в окислительно-восстановительных системах. Срок жизни электрода измеряется годами..
Потенциометрическое определение рН находит широкое применение в техно-химическом контроле пищевых продуктов, так как в основе технологии производства многих пищевых продуктов лежат биохимические и микробиологические процессы, существенно зависящие от рН среды. Определяют рН в соках, кофе, мясе, рыбе и других продуктах.
Систематические исследования зависимости электродных свойств стекла от его состава показали, что определенным его изменением (введение оксидов бора, алюминия) можно получить стекло, электроды из которого селективны по отношению к ионам натрия, калия, аммония, серебра. Из них более широкое применение вследствие высокой селективности нашел натрийселективный электрод. С помощью этого электрода можно определять, например, NaCl в пищевых продуктах.
Помимо стеклянных электродов используют ИСЭ с твердой мембраной. Такую мембрану создают прессованием в виде диска или таблетки монокристаллических (например, LaF3) или поликристаллических труднорастворимых в воде солей (например, Ag2S или AgBr). В этих мембранах обычно один, из двух Составляющих соль ионов, способен перемещаться в кристаллической решетке по ее дефектам. Поэтому электроды с твердой мембраной используются в качестве датчиков для определения тех ионов, которые входят в состав мембраны, а также тех ионов, которые способны взаимодействовать с активными центрами материала мембраны.
Первый твердофазный высокоселективный мембранный электрод был сконструирован с использованием монокристалла LaF3 для определения активности ионов фтора (рис. 6.1.6). Он нашел применение для определения фторид-иона в питьевой, морской и сточных водах, зубных пастах, в витаминах, моче, слюне, в костях, зубах и т. д. Он может быть использован для определения фторид-иона в пищевых продуктах, таких как морепродукты, поваренная соль и другие.
Электроды, чувствительные к ионам Ag+, S2″, Си2т, РЬ2+, Г, Вг», получены на основе Ag2S (поскольку перечисленные ионы или замещают ион серебра, или связываются с ним на поверхности кристалла).
Монокристаллический AgCl лежит в основе электрода, селективного по отношению к ионам хлора. Этот электрод используется для определения хлорид-ионов в воде, почве, биологических жидкостях, пищевых продуктах. Достоинством этих электродов является длительный срок работы. Однако число ионных кристаллических соединений, обладающих ионной селективной проводимостью, ограничено.
Твердые мембранные электроды могут быть не только гомогенными, но и гетерогенными. Гетерогенные мембраны содержат какой-либо связующий материал (матрицу) для придания электроду необходимой механической прочности. В качестве инертной матрицы используют парафин, силиконовый каучук, эпоксидные смолы, поливинилхлорид и другие материалы. Диспергированные в них соли, например.
СаСЮ4, BaSO4, Agl, Ag2S обеспечивают возможность определения ионов, входящих в состав названных солей. Потенциал таких электродов недостаточно устойчив и селективность невелика.
В электродах с жидкой мембраной раствор сравнения отделен от анализируемого тонким слоем органической жидкости, представляющей собой раствор жидких ионитов или ионных ассоциатов в органических растворителях’, не смешивающихся с водой, но селективно реагирующих с определяемым ионом. Электродоактивный слой получается пропиткой этой жидкостью пористой гидрофобной мембраны из пластика (рис. 6.1.7).
Внутренний хлоридсеребряный электрод I погружен в раствор МС12, где М — определяемый катион. Пористая мембрана 3 одной стороной соприкасается с раствором сравнения хлоридсеребрянного электрода, а другой с анализируемым раствором. Ионочувствительная жидкость в резервуаре 2, пропитывающая мембрану, состоит из жидкого органического ио-нита, имеющего кислотные, основные или хелатообразующие функциональные группы, растворенного в подходящем растворителе, который с водой не смешивается.
На основании этого ряда можно установить возможность определения одного го анионов в присутствии других. Так, например, определению нитрат-ионов мешают все анионы, стоящие в ряду влево от него, и не мешают те, которые расположены вправо от него.
Ассортимент жидкостных ИСЭ постоянно увеличивается. Известны электроды селективные к катионам (Cu2+, Mg2+, Mn2+, NHO, к анионам (СОз2″, SO42″ и др.), а также к ионогенным органическим соединениям. Среди них наиболее важными для решения экологических проблем являются электроды, селективные к поверхностно-активным веществам (определение загрязнения моющими средствами), и к ацетилхолину (определение загрязнения фосфорорганическими ядохимикатами).
Недостатком ИСЭ с жидкими мембранами является их механическая непрочность. Эти недостатки частично устранены в пленочных (так называемых отвержденных) электродах, в которых электродоактивное вещество и растворитель-пластификатор внедрены в полимерную матрицу, Срок службы таких ИСЭ увеличивается до года.
Сконструированы газочувствительные мембранные электроды для определения СО2, NH3, NO, H2S и других газов. В основе -действия газовых электродов лежит реакция с участием воды, в результате которой изменяется характер среды, например:
СО2 + Н2О = Н+ + НС03″ NH3+,H2O = OH’ + NH4+
Индикаторными ИСЭ на выделяющиеся при этих реакциях ионы (Н+, ОН») служат стеклянные рН — электроды. Позднее появились ферментные, бактериальные и иммуноэлектроды, сочетающие чувствительность и селективность биохимической реакции со скоростью и простотой потенцио-метрического методы.
Дальнейший прогресс в развитии ионометрии связан, во-первых, с разработкой новых ИСЭ, с созданием аналитических методик определения ионов низко- и высокомолекулярных органических соединений, которые раньше методами ионометрии не обнаруживались (например, сахара, белки и др.). Другое направление — улучшение конструкции электродов, например, создание твердотельных электродов с твердым внутренним контактом между мембраной и металлическим токоотводом. Эти электроды не имеют внутреннего жидкостного заполнения. Примером такой конструкции служит твердотельный бромселективный электрод с мембраной из смеси AgBr и Ag2S (рис. 6.1.8).
Благодаря большому разнообразию ИСЭ потенциометрическое определение ионов находит применение во многих областях: технике, медицине, экологической службе, сельском хозяйстве, пищевой промышленности. Так, ионометрически определяют ионы кальция в биологических жидкостях, воде, пищевых продуктах (детское питание, полуфабрикаты сахарного производства); ионы йода — в морской капусте и в других водорослях,’ нитрит-ионы — во всех видах пищевой продукции, в удобрениях и растениях; хлорид-ионы — в пищевых продуктах (хлебе, сырах, маргарине), лекарствах, воде; бромиды — в бромсодержащих пестицидах и почве.
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
Источник: studopedia.ru