Гальваническим элементом (ГЭ) называется прибор (устройство), в котором энергия химической реакции превращается в электрическую. Катодом гальванического элемента всегда является электрод, имеющий бо́льшее значение потенциала, а анодом – электрод, имеющий меньшее значение потенциала. Разность потенциалов катода и анода называется электродвижущей силой (ЭДС) гальванического элемента и вычисляется по формуле:
При этом ЭДС всегда будет величиной положительной.
В гальванических элементах перенос электронов от восстановителя к окислителю происходит по внешнему пути, а не непосредственно между реагентами.
На рисунке показан гальванический элемент (ГЭ), в котором используется окислительно-восстановительная реакция между металлическим цинком и ионами меди Cu +2 , описываемая уравнением:
Zn + Cu +2 → Zn +2 + Cu. (3)
Способность отдавать ионы в раствор у цинка больше, чем у меди, поэтому концентрация избыточных электронов на цинковом электроде больше. Если соединить электроды внешним проводом, то электроны с цинка будут переходить на медь. При этом будут происходить процессы:
Гальванический карандаш Нанесение слоя золота и серебра
Анод (–): 1| Zn↓ – 2ē → Zn +2 – окисление;
Катод (+): 1| Cu +2 + 2ē → Cu↓ – восстановление;
Zn↓ + Cu +2 → Zn +2 + Cu↓.
Любой гальванический элемент состоит из двух полуэлементов, в одном из которых происходит процесс окисления, а в другом – процесс восстановления (полуэлемент – электрод, погружённый в раствор электролита). Процесс окисления всегда идёт на аноде, а процесс восстановления – на катоде.
Накапливание ионов Zn +2 в первом сосуде и SO4 2− – во втором приведёт к остановке реакций. Во избежание этого оба раствора соединяют с помощью U-образной трубки («солевого мостика»), заполненной раствором электролита (как правило, KCl + агар-агар). Это делает возможной диффузию ионов Zn +2 и SO4 2− (можно использовать и мембрану).
Рассмотренный элемент Даниэля – Яко́би можно изобразить при помощи схемы:
(−) Zn | ZnSO4 || CuSO4 | Cu (+).
Потенциал электрода, погружённого в раствор своей соли, может быть рассчитан по уравнению Нернста:

, (4)

– стандартный электродный потенциал;
R – универсальная газовая постоянная (R = 8,314 Дж/(моль∙K));
T – температура (в °K);
n – число отдаваемых или присоединяемых электронов;
F – число Фарадея (F = 96500 Кл/моль);
[Me n + ] – молярная концентрация ионов металла в растворе.
Для комнатной температуры (25°C) уравнение Нернста можно записать в виде:

(5)
Уравнение Нернста для водородного электрода с учётом международного соглашения имеет вид:

Окислительно-восстановительные реакции и электрохимические сисетмы
, (6)

где – давление газообразного водорода.
Если давление водорода равно 1 атм, то, с учётом численных значений R, T и F и перехода от натурального логарифма к десятичному, уравнение (6) принимает вид:

(7)
Из формулы (7) следует, что потенциал водородного электрода равен нулю, если концентрация ионов водорода в растворе, залитом в электрод, равна 1 моль/л.
Задача №1

Al | Al2(SO4)3, C(Al2(SO4)3) = 0,05 моль/л ||; –?
Решение:
1) Так как Al2(SO4)3 – сильный электролит, то:
Найдём концентрацию ионов алюминия в растворе его соли:
2) Запишем уравнение потенциалопределяющей реакции (т.е. реакции, протекающей на границе металл – раствор):
Рассчитаем потенциал алюминиевого электрода по уравнению Нернста (см. формулу (5)):

= −1,66 +
+ 0,0197∙(−1) = −1,6797 В.
Задача №2
Рассчитайте ЭДС, определите анод и катод и напишите уравнение реакции, протекающей в гальваническом элементе:
Решение:
1) Сначала рассчитаем потенциал магниевого электрода.
Так как MgCl2 – сильный электролит, то:
Найдём концентрацию ионов магния в растворе его соли:
[Mg 2+ ] = C(MgCl2) = 0,001 моль/л.
Запишем уравнение потенциалопределяющей реакции для магниевого электрода: Mg 2+ + 2ē ↔ Mg.
Рассчитаем потенциал магниевого электрода по уравнению Нернста:

=
= −2,37 + 0,0295∙(−3) = −2,4585 В.
2) Рассчитаем потенциал марганцевого электрода.
Так как MnCl2 – сильный электролит, то:
Найдём концентрацию ионов марганца в растворе его соли:
[Mn 2+ ] = C(MnCl2) = 0,1 моль/л.
Запишем уравнение потенциалопределяющей реакции для марганцевого электрода: Mn 2+ + 2ē ↔ Mn.
Рассчитаем потенциал марганцевого электрода по уравнению Нернста:

= −1,17 + 0,0295∙(−1) = −1,1995 В.
3) Тот электрод, потенциал которого больше, является катодом, тот электрод, потенциал которого меньше, – анодом. В данном случае катодом будет марганцевый электрод (у него потенциал больше), а анодом – магниевый электрод.
А (−): 1|Mg↓ − 2ē → Mg 2+
К (+): 1|Mn 2+ + 2ē → Mn↓
Mg↓ + Mn 2+ → Mg 2+ + Mn↓
Mg↓ + MnCl2 → MgCl2 + Mn↓ – уравнение реакции, протекающей в данном гальваническом элементе.
4) Рассчитаем ЭДС данного гальванического элемента:
Воспользуйтесь поиском по сайту:

studopedia.org — Студопедия.Орг — 2014-2023 год. Студопедия не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования (0.011 с) .
Источник: studopedia.org
Окислительно-восстановительные реакции

2)

3)

4)
К окислительно-восстановительным не относится реакция, схема которой имеет вид …

1)

2)

3)

4)
Сумма коэффициентов в уравнении окислительно-восстановительной реакции KMnO4 + Na2SO3 + H2SO4 → MnSO4 + Na2SO4 + K2SO4 + H2O равна …
2) 21
Коэффициент перед формулой окислителя в уравнении окислительно-восстановительной реакции NaClO3 + HCl →NaCl + Cl2 + H2O равен …
1) 2 2) 3 3) 14) 6
1) 32) 1 3) 5 4) 6
1) 102 2) 294 3) 98 4) 34
Значение ЭДС гальванического элемента  ,
,  состоящего из ртутного и кадмиевого электродов при стандартных условиях, равно ______ В
состоящего из ртутного и кадмиевого электродов при стандартных условиях, равно ______ В
1) 1,25 2) – 1,25 3) 0,45 4) – 0,45
Значение ЭДС гальванического элемента, состоящего из медного и магниевого электродов, погруженных в 0,1М растворы их нитратов, равно ___ В ( 
 ).
).
2) 2,70
При работе гальванического элемента, состоящего из цинкового и никелевого электродов, погруженных в 0,1М растворы их сульфатов, на катоде протекает реакция, уравнение которой имеет вид …
1) Zn 2+ + 2e = Zn 0
2) Ni 2+ + 2e = Ni 0
3) Ni 0 — 2e = Ni 2+
4) Zn 0 — 2e = Zn 2+
Значение ЭДС гальванического элемента, состоящего из медного и кадмиевого электродов, погруженных в 0,1М растворы их нитратов, можно увеличить, если …
1) увеличить концентрацию нитрат-ионов
2) уменьшить концентрацию нитрата меди (II)
3) уменьшить концентрацию нитрата кадмия
4) увеличить концентрацию нитрата кадмия
При добавлении щелочи в раствор, содержащий ионы железа (II), значение ЭДС гальванического элемента Fe 0 | Fe 2+ | Ni 2+ |Ni 0 …
1) увеличится
3) станет равным нулю
Объем хлора, который образуется на инертном аноде при пропускании тока силой 10,8 А в течение 4 часов через раствор хлорида натрия, составляет ____ л (н. у.) (Выход по току 100%; F = 96500 Кл/моль).
1) 18 2) 36 3) 45 4) 54
Масса серебра, выделившегося на катоде при пропускании тока силой 19,3 А в течение 50 минут через раствор нитрата серебра с выходом по току 100 %, составляет ____ г (F = 96500 Кл/моль).
Ответ: 64,8 г
Ответ: 15 суток
При электролизе водного раствора нитрата серебра с инертными электродами на катоде происходит выделение вещества, формула которого имеет вид …
При электролизе 200 г расплава гидроксида натрия (выход по току составляет 100%) на инертном аноде образуется ____ л кислорода (н.у.).
1) 56 2) 28 3) 7 4) 112
Ответ: 10 суток
Ответ: 45 суток
Ответ: 40 суток
При работе гальванического элемента, состоящего из цинкового и никелевого электродов, погруженных в 0,1М растворы их сульфатов, на катоде протекает реакция, уравнение которой имеет вид …
1) Ni 2+ + 2e = Ni 0
2) Ni 0 — 2e = Ni 2+
3) Zn 2+ + 2e = Zn 0
4) Zn 0 — 2e = Zn 2+
При работе гальванического элемента, состоящего из железного и никелевого электродов, погруженных в 0,5М растворы их сульфатов, на аноде протекает реакция, уравнение которой имеет вид …
1) Ni 2+ + 2e = Ni 0
2) Ni 0 — 2e = Ni 2+
3) Fe 2+ + 2e = Fe 0
4) Fe 0 — 2e = Fe 2+

Масса серебра, выделившегося на катоде при пропускании тока силой 19,3 А в течение 50 минут через раствор нитрата серебра с выходом по току 100 %, составляет ____ г
1) 64,8

Сила тока, которую необходимо поддерживать для получения 16,2 г серебра путем электролиза раствора нитрата серебра за 30 минут, составляет ____ А (выход по току 100%, ).
1) 4 2) 8 3) 16 4)12
В результате полного электролиза водного раствора нитрата серебра с инертными электродами образуется раствор, значение рН которого …

4)
При электролизе водного раствора хлорида калия на инертном аноде протекает процесс, уравнение которого имеет вид …
1) 2Cl — — 2e = Cl2
Сумма коэффициентов в общем уравнении электролиза раствора хлорида меди (II) с инертными электродами равна …
Сумма коэффициентов в общем уравнении электролиза водного раствора йодида калия с инертными электродами равна …
1) 8
При нарушении никелевого покрытия на железном изделии в кислой среде на аноде будет протекать реакция, уравнение которой имеет вид …

1)
2) Ni 2+ + 2e = Ni 0
3) Fe 0 — 2e = Fe 2+
4) Ni 0 — 2e = Ni 2+
При нарушении оловянного покрытия на железном изделии в кислой среде на аноде будет протекать реакция, уравнение которой имеет вид …
1) Sn 0 — 2e = Sn 2+

2)
3) Fe 2+ + 2e = Fe 0
4) Fe 0 — 2e = Fe 2+
При нарушении серебряного покрытия на никелевом изделии в кислой среде на катоде будет протекать реакция, уравнение которой имеет вид …

1)
2) Ni 2+ + 2e = Ni 0
3) Ni 0 — 2e = Ni 2+
Время, необходимое для получения 9,6 г меди путем электролиза раствора сульфата меди (II) при силе тока 25 А, составляет ____ минуты (выход по току составляет 100%, F = 96500 Кл/моль).
2) 19,3
Формула вещества, которое способно проявлять и окислительные, и восстановительные свойства, имеет вид …
Формула вещества, которое способно проявлять свойства как окислителя, так и восстановителя, имеет вид …
Металлом, который нельзя получить электролизом водного раствора его соединения, является…
1) Ba

В окислительно-восстановительной реакции сера …
1) является только окислителем
2) является и окислителем, и восстановителем
3) является только восстановителем
4) не проявляет окислительно-восстановительных свойств
Одинаковые продукты образуются на инертных электродах при электролизе расплава и водного раствора соединения, формула которого …
1) CuBr2 2) CuSO4 3) AgF 4)AgBr
Формула вещества, которое способно проявлять только восстановительные свойства, имеет вид …
1) NaI
Формула соли, раствор которой после электролиза с инертными электродами обладает рН < 7, имеет вид …
При электролизе раствора, содержащего равные количества ионов Ni 2+ , Cu 2+ , Zn 2+ , последовательность выделения металлов на инертном катоде имеет вид …
1) Cu, Ni, Zn
Источник: allrefrs.ru
Гальванический элемент
Гальванический элемент – это химический источник тока, в котором энергия, выделяющаяся при протекании на электродах окислительно-восстановительной реакции, непосредственно преобразуется в электрическую энергию.
Принцип работы гальванического элемента можно рассмотреть на примере элемента Даниэля – Якоби (рис 9.2).
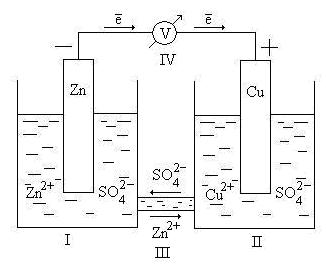
Рис. 9.2. Схема гальванического элемента Даниэля – Якоби
Здесь I – стакан, содержащий раствор ZnSO4 в воде с погруженной в него цинковой пластинкой; II – стакан, содержащий раствор CuSO4 в воде с погруженной в него медной пластинкой; III – солевой мостик (электролитический ключ), который обеспечивает перемещение катионов и анионов между растворами; IV – вольтметр (нужен для измерения ЭДС, но в состав гальванического элемента не входит).
Стандартный электродный потенциал цинкового электрода . Стандартный электродный потенциал медного электрода . Так как , то атомы цинка будут окисляться:
| Zn – 2? = Zn 2+ . | (а) |
Электрод, на котором идет реакция окисления или который посылает катионы в электролит, называется анодом. У рассматриваемого гальванического элемента в роли анода выступает цинковый электрод. Так как стандартный электродный потенциал цинка ниже, чем у меди, цинковому электроду приписывается условный заряд «–», а медному – «+».
Электроны, освободившиеся в результате окисления, по внешней цепи переходят на медь (возникает электрический ток).
На медном электроде происходит процесс восстановления катионов электролита Cu 2+ :
| Cu 2+ +2? = Cu. | (б) |
Электрод, на котором идет реакция восстановления или которыйпринимает катионы из электролита, называется катодом.
Через электролитический ключ происходит движение ионов в растворе: анионов SO4 2– к аноду, катионов Zn 2+ к катоду. Движение ионов в растворе замыкает электрическую цепь гальванического элемента.
Складывая уравнения процессов, протекающих на электродах, получаем суммарное уравнение окислительно-восстановительной реакции, протекающей в гальваническом элементе:
| Zn + Cu 2+ = Zn 2+ + Cu | (в) |
или, с учетом анионов раствора:
| Zn + CuSO4= ZnSO4+ Cu. | (г) |
В общем случае, суммарное уравнение окислительно-восстановительной реакции, протекающей в произвольном гальваническом элементе, можно представить в виде:
| MeА + MeК n+ Á MeА n+ + MeК, | (д) |
где индексы А и К относятся к металлам анода и катода соответственно.
Символическая запись (схема) гальванического элемента имеет вид:
Часто вместо растворов обозначают только катионы, содержащиеся в растворе:
Схема гальванического элемента Даниэля – Якоби имеет вид:
Максимальная разность потенциалов электродов, которая может быть получена при работе гальванического элемента, называется электродвижущей силой (ЭДС) элемента Е. Она вычисляется по формуле;
| Е = φк – φа, | (9.4) |
где φк и φа – электродные потенциалы катода и анода соответственно.
Величина ЭДС элемента Даниэля – Якоби при стандартных условиях равна:
Электродвижущая сила Е характеризует способность гальванического элемента совершать электрическую работу во внешней цепи.
Электрическая работа определяется максимальной полезной работой, совершаемой химической реакцией, которая равна изменению изобарно-изотермического потенциала? G процесса. Связь между величиной? G и ЭДС описывается уравнением:
| ? G = – nFE, | (9.5) |
где n – число электронов в элементарном окислительно-восстановительном акте, F – число Фарадея.
Величина изменения изобарно-изотермического потенциала токообразующей реакции при стандартных условиях? G 0 связана с константой равновесия этой реакции К равн соотношением
Гальванические элементы являются первичными (однократно используемыми) химическими источниками тока (ХИТ). Вторичными (многократно используемыми) ХИТ являются аккумуляторы. Процессы, протекающие при разряде и заряде аккумуляторов, взаимнообратны.
Гальванические элементы, у которых электроды выполнены из одного и того же металла и опущены в растворы своих солей разной концентрации, называются концентрационными. Функцию анода в таких элементах выполняет металл, опущенный в раствор соли с меньшей концентрацией, например:
Пример 1. Составьте схему гальванического элемента, в основе которого лежит реакция: Mg + ZnSO4 = MgSO4 + Zn. Что является катодом и анодом в этом элементе? Напишите уравнения процессов, протекающих на этих электродах. Рассчитайте ЭДС элемента при стандартных условиях. Вычислите константу равновесия для токообразующей реакции.
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
Источник: studopedia.ru