При электролизе 1 л водного раствора, содержащего соляную кислоту и хлорид натрия, на катоде выделилось 11,2 л, а на аноде – 6,72 л (н. у.) газообразных веществ. В результате образовался раствор с рН равным 13. Значение рН в исходном растворе составляло ____. (Изменением объема раствора при электролизе пренебречь; α = 1; ответ привести с точностью до целого значения).
Другие вопросы по предмету Химия
Вопрос № 62603
В состав молекулы фактора роста растений кинетина
Вопрос № 62794
Активированный древесный уголь относится к дисперсным системам с _____ дисперсионной средой и ______ дисперсной фазой.
гелеобразной
газообразной
Вопрос № 62863
Образование макромолекул полимеров путем последовательного присоединения молекул мономера происходит в результате реакции …
поликонденсации
этерификации
изомеризации
полимеризации
Вопрос № 62883
Масса медного купороса, необходимая для приготовления 800 граммов раствора с массовой долей растворенного вещества 10 %, равна …
КАК ДОБЫТЬ МЕДЬ, БЕЗ ЭЛЕКТРОЛИЗА? ИЗ ОТРАБОТАННЫХ РАСТВОРОВ!
Источник: testna5.ru
Написать уравнение электролиза раствора содержащего смесь нитрата меди(ll) и нитрата серебра с инертными электродами
В смеси подвергаются электролизу по очередиСначала серебро, потом медь (см. ряд напряжения металлов, серебро стоит правее меди) AgNO3 = Ag(+) + NO3(-)К(-): Ag(+) + e = Ag(0)А(+): 2H2O -4e = O2 + 4H(+)4AgNO3 +2 H2O =4 Ag + O2 + 4HNO3Cu(NO3)2 = Сu(2+) + 2NO3(-)К(-): Cu(2+) + 2e = Cu(0)А(+): 2H2O -4e = O2 + 4H(+)2Cu(NO3) 2 + 2H2O = 2Cu + O2 + 4HNO3
Добавить свой ответ Ответить на вопрос
Еще вопросы
Make the sentences negative and interrogative:
1) I have begun the work.
2) I have taken the book from the library.
3) I have done the work which our teacher gave us.
4)They have attended the meeting.
5) I have invited them to our place.
6)We have taken part in the experiment.
7)We have written the letter to our parents.
8)He has learn French.
9)She has been to London this year.
10)She has gone for a walk.
11) I have taken him around the Moscow.
Источник: znanija.site
Последовательность выделения металлов при электролизе раствора их солей
Задача 692.
В какой последовательности будут выделяться металлы при электролизе раствора, содержащего в одинаковой концентрации сульфаты никеля, серебра, меди?
Решение:
Стандартные электродные потенциалы систем:
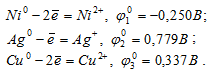
Следовательно,  0 2 >
0 2 >  0 3 >
0 3 >  0 1. Поэтому сначала будет выделяться серебро, затем, медь и только после этого никель.
0 1. Поэтому сначала будет выделяться серебро, затем, медь и только после этого никель.
ЗОЛОТО ИЗ РАСТВОРИТЕЛЯ ПРИПОЯ! ПРИПОЙ КОТОРЫЙ СКРЫВАЕТ ЗОЛОТО!
Ответ: Ag, Cu, Ni.
Задача 693.
Раствор содержит ионы Fe 2+ , Ag + , Bi 3+ , Pb 2+ в одинаковой концентрации. В какой последовательности эти ионы будут выделяться при электролизе, если напряжение достаточно для выделения любого металла?
Решение:
Стандартные электродные потенциалы систем
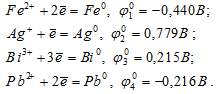
Следовательно,  0 2 >
0 2 >  0 3 >
0 3 >  0 4 >
0 4 >  0 1. Поэтому сначала будут выделяться ионы серебра, затем, висмута, свинца и только после этого железа.
0 1. Поэтому сначала будут выделяться ионы серебра, затем, висмута, свинца и только после этого железа.
Ответ: Ag + , Bi 3+ , Pb 2+ , Fe 2+ .
Задача 694.
Составить схему процессов, происходящих на медных электродах при электролизе водного раствора КNO3.
Решение:
Так как значение электродного потенциала системы K + — 2 ⇔ K 0 (-2,924 В) значительно ниже, чем потенциал водородного электрода в нейтральной среде 2H2O + 2 ⇔ H2↑ + 2ОH — (-0,41 В), а значение электродного потенциала меди намного выше значений потенциалов калия и воды, то на катоде будет наблюдаться восстановление ионов меди:
Ионы меди будут приходить к катоду от анода, а ионы калия будут накапливаться в катодном пространстве.
На аноде будет происходить электрохимическое окисление меди, так как электродный потенциал системы
Cu 0 — 2 ⇔ Cu 2+ (+0,337 В) значительно ниже электродного потенциала системы
2H2O — 4 ⇔ O2↑ + 4Н+ (+1,228 В):
Медь – материал анода будет растворяться, и накапливаться вместе с приходящими к аноду нитрат-ионами.
Таким образом, при электролизе раствора нитрата калия на медных электродах происходит растворение медного анода и осаждение чистой меди на медном катоде. Ионы калия и нитрат-ионы в процессе электролиза не участвуют, а являются средой для проведения электролиза и остаются в растворе. Следовательно, энергия электрического тока при этом электролизе расходуется на перенос меди с анода на катод. Данный процесс можно использовать для рафинирования меди очистка её от примесей. Медные пластины соединяют с источником постоянного тока таким образом, чтобы очищения медь была катодом, а неочищенная медь – анодом.
Задача 695.
Имеется раствор, содержащий КСI и Сu(NO3)2. Предложить наиболее простой способ получения практически чистого KNO3.
Решение:
Для получения практически чистого KNO3 из смеси КСI и Сu(NO3)2 можно предложить электрохимический метод, основанный на проведении электролиза данной смеси. Стандартный электродный потенциал системы: Cu 2+ + 2 ⇔Cu 0 (+0,34 В) значительно положительнее потенциала водородного электрода в нейтральной среде (-0,41 В) и системы: K + + 1 ⇔ K 0 (-2,924 В). Поэтому на катоде будет происходить электрохимическое восстановление ионов меди:
Ионы калия будут накапливаться в катодном пространстве.
На аноде будет происходить электрохимическое окисление ионов хлора Cl — , не смотря на то, что стандартный электродный потенциал системы: Cl — — 2 ⇔ Cl* (1,359 В) менее положителен, чем системы: 2H2O — 4 ⇔O2↑ + 4Н + (1,228В):
2Cl — — 2 ⇔ 2Cl*; Cl + Cl* =Cl2.
Нитрат-ионы будут накапливаться в анодном пространстве. Сложив уравнения катодного и анодного процессов, получим суммарное уравнение электролиза:
Cu 2+ + 2Cl — ⇔ Cu 0 + Cl2↑
катод анод
Cu(NO3)2 + 2KCl ⇔ Cu + 2K + + Cl2↑ + 2NO3 —
у катода у анода
Таким образом, при электролизе смеси КСI и Сu(NO3)2 на катоде выделяется металлическая медь, а на аноде – газообразный хлор. Оставшиеся ионы калия и нитрат-ионы можно выделить в виде чистой кристаллической соли KNO3 методом выпаривания из раствора после проведения электролиза смеси солей.
- Вы здесь:
- Главная

- Задачи

- Химия-Глинка

- Схемы электролиза водного раствора солей | Задачи 690 — 691
Источник: buzani.ru