Цель работы: научиться готовить рабочий раствор нитрата серебра и определять его нормальную в растворе.
Оборудование: Реактивы. Нитрат серебра АgN03(к). Хромат калия К2Сг04, 5%-й раствор. Посуда. Колбы мерные (100, 500 мл).
Пипетка (20 мл). Пипетка дифференциальная (5 мл). Бюретка (25 мл). Колба коническая (250 – 300 мл). Стаканчик весовой (бюкс).
Воронка стеклянная.
Перед выполнением лабораторной работы необходимо проработать материал:
Сущность методов осаждения. Аргентометрия (метод Мора), условия применения метода и его значение в проведении химико-технологического контроля.
Сущность метода комплексонообразования и его значение в осуществлении химико-технологического контроля.
Раствор нитрата серебра готовят по навеске препарата АgN03. Стандартизация раствора АgNO3 основана на титровании аликвоты стандартного раствора хлорида натрия раствором нитрата серебра. В качестве индикатора применяется хромат калия.
Выполнение работы. Рассчитывают массу навески АgNO3, необходимую для приготовления 500 мл 0,01М раствора нитрата серебра.
Навеску препарата АgN03 взвешивают на технических весах и количественно переносят в мерную колбу вместимостью 500 мл, растворяют и доводят до метки дистиллированной водой. Так как концентрация раствора АgN03 изменяется при хранении, ее периодически проверяют по «х.ч.» NаС1 методом отдельных навесок или методом пипетирования.
Готовят 0,01М раствор хлорида натрия (первичный стандарт) путем растворения навески хлорида натрия в мерной колбе вместимостью 100 мл. Аликвоту полученного раствора NaCl пипеткой на 20 мл переносят в колбу для титрования, прибавляют 1 мл 5% – го раствора К2Сг04 и титруют рабочим раствором АgN03, при энергичном перемешивании раствора с осадком.
Титрование заканчивают, когда чисто желтый цвет жидкости со взмученным в ней осадком приобретает грязноватый красно-бурый оттенок.
Содержимое колбы после окончания титрования сливают в специально предназначенный для этого сосуд.
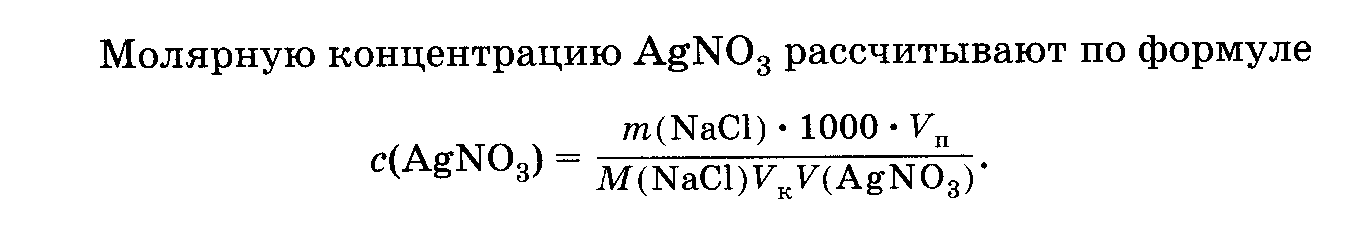
Результаты опыта занесите в таблицу:
Вывод (уравнения реакций)
Лабораторная работа №22.
«Определение содержания хлорида натрия в растворе»
Цель работы: научиться определять концентрацию хлорида натрия в растворе.
Оборудование: Приборы и реактивы. Мерная колба вместимостью 50 мл. Бюретка вместимостью 10 мл. Пипетка вместимостью 5 мл. Растворы: нитрата серебра (0,1 в., титрованный); хлорида натрия (0,5 н., титрованный); хромата калия (насыщенный).
Перед выполнением лабораторной работы необходимо проработать материал:
Сущность методов осаждения. Аргентометрия (метод Мора), условия применения метода и его значение в проведении химико-технологического контроля.
Сущность метода комплексонообразования и его значение в осуществлении химико-технологического контроля.
Концентрацию растворов некоторых солей можно определить, используя реакции обмена, протекающие с образованием осадков малорастворимых веществ в процессе титрования. Например, для количественного определения хлоридов (или бромидов) металлов можно применить реакцию образования осадка галогенида серебра.
Раствор галогенида титруют раствором нитрата серебра, концентрация которого известна. Для определения конца реакции к раствору галогенида добавляют в качестве индикатора каплю насыщенного раствора хромата калия К2Сг04. Хромат калия с нитратом серебра дает малорастворимую соль Аg2Сг04 темно-красного цвета.
Но растворимость хромата серебра значительно больше, чем хлорида серебра. Поэтому хромат серебра начинает выпадать в осадок только после практически полного осаждения ионов хлора. Внешне это проявляется в начинающемся побурении ранее белого осадка, что и служит признаком конца реакции между хлоридом натрия и нитратом серебра.
Выполнение работы. В мерную колбочку вместимостью 50 мл поместите некоторое количество раствора хлорида натрия. Довести объем раствора хлорида натрия до метки, прибавляя к нему из промывалки дистиллированную воду. Воду прибавлять отдельными порциями, каждый раз перемешивая раствор круговыми движениями колбы.
Последние капли воды добавлять пипеткой до тех пор, пока нижний уровень мениска жидкости не совпадет с меткой на шейке колбы. После этого плотно закрыть колбу пробкой и хорошо перемешать раствор, перевертывая колбу.
Бюретку вместимостью 10 мл промыть небольшим объемом титрованного 0,1 н. раствора нитрата серебра. Укрепить бюретку в штативе и через воронку налить в нее тот же раствор нитрата серебра несколько выше нулевого деления. (Кончик бюретки также должен быть заполнен.) Выпуская избыток раствора через нижний конец бюретки, довести уровень жидкости в бюретке до нуля.
В коническую колбочку емкостью 50 мл сухой пипеткой внести 5 мл приготовленного раствора хлорида натрия и налить из промывалки приблизительно такой же объем воды. Туда же добавить одну каплю насыщенного раствора индикатора – хромата калия. Провести ориентировочное титрование.
Для этого в колбочку с раствором хлорида натрия добавлять из бюретки небольшими порциями (по 0,5 мл) раствор нитрата серебра. Раствор при этом нужно все время перемешивать круговыми движениями колбочки. Необходимо уловить момент, когда чисто-желтый цвет жидкости с осадком перейдет в буроватый. В этот момент нужно прекратить титрование и определить объем израсходованного раствора нитрата серебра.
Повторить титрование еще три раза, но более точно, добавляя последние порции раствора нитрата серебра по каплям. Перед каждым титрованием колбочку для раствора хлорида натрия необходимо тщательно вымыть и сполоснуть дистиллированной водой, а уровень раствора нитрата серебра довести до нуля.
Выразите массу нитрата серебра из формулы в предыдущей 21 лабораторной работе.
Результаты опыта занесите в таблицу:
Источник: studfile.net
Лабораторные работы
Работа 18.9.1. Приготовление стандартизированного раствора нитрата серебра
Первичными стандартами для стандартизации раствора нитрата серебра служат хлориды натрия или калия. Готовят стандартный раствор хлорида натрия и приблизительно 0,02 н. раствор нитрата серебра, стандартизируют второй раствор по первому.
Приготовление стандартного раствора хлорида натрия. Раствор хлорида натрия (или хлорида калия) готовят из химически чистой соли (или из фиксаналов). Молярная масса эквивалентов хлорида натрия равна его молярной массе (58,45 г/моль). Теоретически для приготовления 0,1 л 0,02 н. раствора требуется 58,45 • 0,02 • 0,1 = 0,1169 г NaCl.
Возьмите на аналитических весах навеску приблизительно ОД2 г хлорида натрия, перенесите ее в мерную колбу вместимостью 100 мл, растворите, добавьте воды до метки и хорошо перемешайте. Вычислите титр и молярную концентрацию эквивалентов хлорида натрия.
Допустим, что навеска хлорида натрия равна 0,1226 г. Тогда

молярная концентрация эквивалентов

Приготовление 100 мл приблизительно 0,02 н. раствора нитрата серебра. Нитрат серебра является дефицитным реактивом и обычно растворы его имеют концентрацию не выше 0,05 н. Для данной работы вполне пригоден 0,02 н. раствор. При аргентометрическом титровании молярная масса эквивалентов AgN03 равна его молярной массе 169,9 г/моль. Поэтому для приготовления 0,02 н. раствора необходимо 169,9 * 0,02 • 0,1 = 0,3398 г AgN03. Однако брать точно такую навеску не имеет смысла, так как выпускаемый нитрат серебра всегда содержит примеси.
Взвешивают на технохимических весах приблизительно 0,34— 0,35 г нитрата серебра, переносят навеску в мерную колбу вместимостью 100 мл, растворяют ее в небольшом количестве воды и добавляют воды до метки. Можно хранить раствор в колбе, обернув ее черной бумагой, но лучше перелить его в склянку темного стекла. На свету нитрат серебра разлагается с выделением свободного серебра.
Стандартизация раствора нитрата серебра по хлориду натрия. Тщательно вымытую бюретку ополаскивают раствором нитрата серебра и готовят ее к титрованию. Мерную пипетку (10 мл) промывают раствором хлорида натрия и переносят 10,00 мл раствора в коническую колбу, приливают 2 капли насыщенного раствора хромата калия и осторожно, по каплям, титруют раствором нитрата серебра при перемешивании до перехода желтой окраски смеси в красноватую от одной избыточной капли нитрата серебра. Повторив титрование 2—3 раза, находят среднее из сходящихся отсчетов и вычисляют молярную концентрацию раствора нитрата серебра.
На титрование 10,00 мл 0,02097 н. раствора хлорида натрия пошло в среднем 10,26 мл раствора нитрата серебра. Тогда

Это означает, что 1 мл раствора нитрата серебра соответствует 0,0007244 г оттитрованного хлорид-иона.
Источник: studme.org
Приготовление раствора серебра нитрата (0,1 моль/л)
Приготовление. 17 г серебра нитрата растворяют в воде в мерной колбе вместимостью 1 л и доводят объем раствора водой до метки.
Установка титра. Около 0,15 г (точная навеска) натрия хлорида, дважды перекристаллизованного из воды и слабо прокаленного в тигле при температуре от 250 до 300 °С, растворяют в 50 мл воды, и титруют приготовленным раствором серебра нитрата до появления красноватого осадка (индикатор — калия хромат). Молярность раствора вычисляют по первому способу.
Хранить в сосудах темного стекла с притертыми пробками в защищенном от света месте.
Концентрацию раствора вычисляют одним из указанных ниже способов.
Первый способ — по навеске химически чистого вещества. Молярность (М, моль/л) вычисляют по следующей формуле:
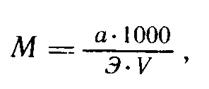
где а — навеска химически чистого вещества в граммах;
Э — молярная масса условных частиц химически чистого вещества в граммах на моль;
V — объем раствора, пошедшего на титрование навески, в миллилитрах;
1000 — количество миллилитров в 1 л раствора.
Второй способ — по титрованному раствору известной концентрации.
Молярность (Му мюль/л) вычисляют по следующей формуле:
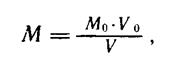
где
Мо — молярность раствора вещества по которому устанавливается титр, моль/л;
Vo — объем раствора, по которому устанавливается титр, в миллилитрах;
V — объем раствора, молярность которого устанавливают, в миллилитрах.
Для приготовленных титрованных растворов вычисляют поправочный коэффициент к молярности (К), представляющий собой отношение реально полученной концентрации титрованного раствора к теоретически заданной. Коэффициент К должен находиться в пределах от 0,98 до 1,02. При отклонении величины К от указанных пределов растворы необходимо соответственно укрепить или разбавить.
Методики количественного определения порошков калия хлорида натрия бромида, калия бромида, калия йодида.
Калия хлорид
Около 1 г препарата (точная навеска) растворяют в воде в мерной колбе емкостью 50 мл и доводят объем раствора водой до метки. 5 мл полученного раствора разбавляют водой до 40 мл и титруют 0,1 н. раствором нитрата серебра до оранжево-желтого окрашивания (индикатор — хромат калия).
1 мл 0,1 н. раствора нитрата серебра соответствует 0,007456 г КС1, которого в препарате должно быть не менее 99,5%,
Натрия бромид
Около 0,2 г препарата (точная навеска), предварительно высушенного при 110° в течение 4 часов, растворяют в 20 мл воды и титруют 0,1 н. раствором нитрата серебра до оранжево-желтого окрашивания (индикатор — хромат калия).
1 мл 0,1 н. раствора нитрата серебра соответствует 0,01029 г NaBr, которого в высушенном препарате должно быть не менее 99,0% и не более 100,6 %
Калия бромид
Около 0,2 г препарата (точная навеска), предварительно высушенного при 110° в течение 4 часов, растворяют в 20 мл воды и титруют 0,1 н. раствором нитрата серебра до оранжево-желтого окрашивания (индикатор — хромат калия).
1 мл 0,1 н. раствора нитрата серебра соответствует 0,01190 г КВr, которого в высушенном препарате должно быть не менее 99,0%) и не более 100,6%.
Калия йодид
Около 0,3 г препарата (точная навеска), предварительно высушенного при 110° в течение 4 часов, растворяют в 30 мл воды, прибавляют 1,5 мл разведенной уксусной кислоты, 5 капель 0,1% раствора эозината натрия и титруют 0,1 н. раствором нитрата серебра до перехода окраски осадка от желтой до розовой.
1 мл 0,1 н. раствора нитрата серебра соответствует 0,01660 г KI, которого в высушенном препарате должно быть не менее 99,5%.
Методики определения доброкачественности порошков калия хлорида натрия бромида, калия бромида, калия йодида.
Калия хлорид
Прозрачность и цветность раствора. 16 г препарата растворяют в 160 мл свежепрокипяченной и охлажденной воды. Полученный раствор-должен быть прозрачным и бесцветным.
Кислотность или щелочность. К 50 мл того же раствора прибавляют 5 капель раствора бромтимолового синего и 0,1 мл 0,02 н. раствора едкого-натра; должно появиться голубое окрашивание. К другим 50 мл того же раствора прибавляют 5 капель раствора того же индикатора и 0,1 мл 0,02 н. раствора соляной кислоты; должно появиться желтое окрашивание.
Соли аммония. 2,5 мл того же раствора, разведенные водой до 5 мл, не должны давать реакцию на соли аммония.
Кальций. 10 мл того же раствора не должны содержать кальция более чем 2 мл эталонного раствора, разведенные водой до 10 мл (не более 0,006% в препарате).
Магний. 5 мл того же раствора не должны давать мути от прибавления 0,5 мл раствора аммиака и раствора фосфата натрия.
Барий. 10 мл того же раствора не должны давать помутнения с разведенной серной кислотой при наблюдении в течение 2 часов.
Железо. 10 мл того же раствора не должны содержать железа более чем 1 мл эталонного раствора, разведенный водой до 10 мл (не более 0,0003% в препарате).
Тяжелые металлы. 10 мл того же раствора должны выдерживать испытание на тяжелые металлы (не более 0,0005% в препарате).
Сульфаты. Раствор 2 г препарата в 10 мл воды должен выдерживать испытание на сульфаты (не более 0,005% в препарате).
Натрий. 5% раствор препарата не должен окрашивать бесцветное пламя в желтый цвет.