Задача 559.
Растворимость СаСО3 при 35 °С равна 6,9 . 10 -5 моль/л. Вычислить произведение растворимости этой соли.
Решение:
Уравнение диссоциации СаСО3 имеет вид:
При растворении каждого моля СаСО3 в раствор переходит 1 моль ионов Са2+ и 1 моль ионов СО3 2- . Следовательно, в насыщенном растворе СаСО3 содержится по 6,9 . 10-5 моль/л ионов Са 2+ и СО3 2- (Са 2+ = СО3 2-) .
ПР(СаСО3) = [Са 2+ ] . [СО3 2- ] = 6,9 . 10 -5 . 6,9 . 10 -5 = 4,76 . 10 -9 .
Ответ: 4,76 . 10 -9 .
Задача 560.
Вычислить произведение растворимости RbВг2 при 25 °С, если растворимость соли при этой температуре равна 1,32 . 10 -2 молы/л.
Решение:
Уравнение диссоциации RbВг2 имеет вид:
При растворении каждого моля RbВг2 в раствор переходит 1 моль ионов Rb 2+ и 2 моль ионов Br — . Следовательно, в насыщенном растворе RbВг2 содержится по 1,32 . 10 -2 моль/л ионов Rb 2+ и (2 . 1,32 . 10 -2 ) моль/л ионов Br — . Отсюда находим произведение растворимости RbВг2:
Растворы и осадки (видео 1)| Произведение Растворимости | Химия
ПР(RbBr2) = [Rb 2+ ] . [Br — ] 2 = 1,32 . 10 -2 . (2 . 1,32 .
10 -2 ) 2 = 9,2 . 10 -6 .
Ответ: 9,2 . 10 -6 .
Задача 561.
В 500 мл воды при 18 °С растворяется 0,0166 г Ag2CrO4. Чему равно произведение растворимости этой соли?
Решение:
M(Ag2CrO4) = 332 г/моль.
Находим массу Ag2CrO4 в 1 л раствора из пропорции:
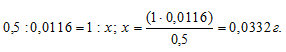
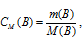
Рассчитаем молярную концентрацию раствора по формуле: , получим:
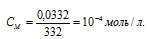
При растворении каждого моля Ag2CrO4 в раствор переходит 2 моля ионов Ag + и 1 моль ионов CrO4 2- . Следовательно, в насыщенном растворе Ag2CrO4 концентрации ионов составляют: [Ag + ] = (2 . 1 . 10 -4 ) моль/л; [CrO4 2- ] = 1 . 10 -4 моль/л.
ПР(Ag2CrO4) = [Ag + ]2 . [CrO4 2- ] = (2 . 1 . 10 -4 ) 2 . 1 . 10 — 4 = 4 . 10 -12 .
Ответ: 4 . 10 -12 .
Задачи 562.
Для растворения 1,16 г PbI2 потребовалось 2 л воды. Найти произведение растворимости соли.
Решение:
M(PbI2) = 461,008 г/моль.
Находим массу PbI2 в 1 л раствора из пропорции:
2 : 1,16 = 1 : x; x = (1 . 1,16)/2 = 0,58 г.
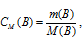
Рассчитаем молярную концентрацию насыщенного раствора по формуле , получим:
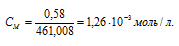
При растворении каждого моля PbI2 в раствор переходит 2 моля ионов I — и 1 моль ионов Pb 2+ . Следовательно, в насыщенном растворе PbI2 концентрации ионов составляют: [I — ] = (2 . 1,26 . 10 -3 ) моль/л; [Pb 2+ ] = 1,26 . 10 -3 моль/л.
ПР(PbI2) = [Pb 2+ ] . [I — ] 2 = 1,26 . 10 -3 . (2 . 1,26 . 10 — 3 )2 = 8 . 10 -9 .
Ответ: 8 . 10 -9 .
Произведение растворимости (ПР или Ksp)
- Вы здесь:
- Главная

- Задачи

- Химия-Глинка

- Ненасыщенность растворов | Задачи 574 — 576
Источник: buzani.ru
Произведение растворимости
Пример1. Рассчитайте растворимость фосфата бария, если ПР(Ba3(PO4)2) = 6,3·10 -39 .
Если s- растворимость фосфата бария, то: [Ba 2+ ]= 3s , [PO4 3- ] = 2s.
ПР = (3s) 3 (2s) 2 = 108s 5 = 6,3 ·10 -39 .

Отсюда s = √ 6,3 ·10 -39 / 108 = 9 10 -9 моль/л.
1. Дайте определение понятиям: «произведение растворимости», «растворимость» .
2. Вычислите произведение растворимости хромата серебра, если в 500 мл воды при 25°С растворяются 0,011 г Аg2 СгО4.
3. Произведение растворимости АgС1 равно 1,810 -10 Вычислите растворимость соли (моль/л и г/л) в воде и 0,01М КС1. Коэффициенты активностей ионов принять равными 1.
4. Смешали 10 мл 0,01М раствора СаС12и 40 мл 0.01М раствора оксалата аммония (NH4)2C2O4 . Выпадет ли осадок оксалата кальция, если ПР(CaC2O4) =2 10 -9 ?
5. В раствор, содержащий 0,01 моль/л BaCl2, и 0,01 моль/л SrCl2 , медленно добавляют раствор сульфата натрия. Какой осадок выпадет первым,
если ПР(BaSO4) =1,1 10 -10 ; ПР(SrSO4)=3,2 • 10 -7 ?
Строение атома. Химическая связь.
1. Напишите электронные формулы для атомов натрия,железа;для ионов Cr 3+ ,C1 — .Какие атомы или ионы изоэлектронны иону Cl — ?
2. Как изменяется с ростом порядкового номера значение первого потенциала ионизации у элементов второго периода?
3. Пользуясь правилом Гунда, распределите электроны по орбиталям, отвечающим высшему энергетическому состоянию атомов фосфора и алюминия.
4. На каком основании Cr и S,C1 и Мп расположены в одной группе
периодической системы Д.И.Менделеева? Почему их помещают в разных подгруппах?
5. Определите среднюю энергию связи 0-Н в молекуле воды, если энергия связей
0-0 и Н-Н соответственно равны (в кДж/моль):-498,7 и -435,9 ,а энтальпия сгорания водорода равна -241,8кДж/моль.
6. Пользуясь таблицей относительных электроотрицательностей, определите,какая из связей является наиболее полярной:Са-Н, I-C1.C-S.
7. В каком из приведенных соединений:LiF, BeF ,BF ,CF связь Э-F будет больше всего приближаться к ковалентной?
8. Как изменяется прочность связи в ряду:НF-НСl-НВг-Н1?
9. Каким типом гибридизации АО азота описывается образование молекулы NH3,иона NH4 + ?Какова пространственная структура этих частиц?
10. Опишите с помощью метода МО электронное строение О2 .Какими магнитными свойствами обладает молекула О2 :диамагнитна или парамагнитна?
11. При переходе от NaF к Nal температура плавления кристаллов уменьшается. Объясните наблюдаемый ход изменения температур плавления.
12. BaCl2 в водных растворах -сильный электролит,a HgCl2-слабый электролит. Объясните это различие в свойствах солей.
13. Сероводород при обычной температуре — газ, а вода- жидкость. Чем можно объяснить это различие в свойствах?
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ.
Протекание окислительно-восстановительных реакций связано со сдвигом или полным переходом электронов от одних веществ к другим – от восстановителя к окислителю.
Типичными окислителями являются
1. Определите степень окисления хрома в следующих соединениях:
2. Укажите, какие из приведенных процессов представляют собой окисление и какие-восстановление: S——> SO4 2- ,Br2 ——> 2Br — , V 2+ ——> V03 — ,CL — ——> CLO3 — .
Fe + S = FeS ; H2 + CL2 = 2 HCL.?
4. В каких из следующих реакций азот является окислителем, в каких – восстановителем: N2+O2= … ; N2 + Li =… ; N2+Mg = … ?
5. Составьте уравнения полуреакций:
6. Закончите уравнения .реакций:
.7. Напишите следующие окислительно-восстановительные реакции:
8. По приведенным ниже полуреакциям составьте уравнения окислительно-восстановительных реакций в молекулярном виде:
a)lOFe 2+ ——> lOFe 3+ + 10e
2МпО4 — + 16Н + + 10е ——> 2Mn 2+ + 8Н2О
b)3Mg° —-> ЗMg 2+ +6e
SO4 2- + 8Н + + 6е —> S 0 + 4Н2О
9. В 1 л раствора содержится 10г HCL04 .Вычислите нормальную концентрацию
HCLO4 , исходя из реакции:
10. Какой обьём 0.1Н К2Сг207 потребуется для окисления 20мл 0,2М Na2S в кислой среде?
Источник: studfile.net
Произведение растворимости хромата серебра если в 500мл раствора содержится 0 011г ag2cro4 равно
Привет Лёва Середнячок

задача вычислите произведение растворимости хромата серебра если в 100 мл насыщенного раствора его содержится 0,002156
Ответ проверен экспертом
4 (11 оценок)

Hrizaurg 9 лет назад
Светило науки — 629 ответов — 0 раз оказано помощи
Хромат серебра — сильный малорастворимый электролит. То немногое, что смогло раствориться в растворе, полностью распалось на ионы.
Уравнение диссоциации: Ag2CrO4⇔2Ag⁺+CrO4²⁻
Произведение растворимости: Ks°[Ag2CrO4]=[Ag⁺]²*[CrO4²⁻]
(то есть произведение растворимости равно произведению концентраций ионов серебра и хромат-ионов в насыщенном водном растворе хромата серебра).
[Ag⁺]=2S, [CrO4²⁻]=S
Учтем, что при диссоциации хромат серебра дает 2 катиона серебра и один анион хромат-иона, получим
Ks°[Ag2CrO4]=(2S)²*S=4S³
Определим молярную растворимость по формуле S=m(Ag2CrO4)/M(Ag2CrO4)*V=
0.002156г/331.730г/моль*0.1л=0.0000649моль/л
Подставим в формулу Ks°=4S³=4*(0.0000649)³=1.093*10^-12
Ks°[Ag2CrO4]=1.093*10^-12
Источник: vashurok.com