RELASKO Только самое лучшее !
Ваша корзина
0 товаров — 0
Ваша корзина пуста
Генерал-лейтенант
Группа: Проверенные
Сообщений: 529
Статус: Offline
1 Запишите уравнения реакций соединения, протекающих согласно схемам:
2 Запишите уравнения реакций, схемы которых:
4 Для проведения каких реакций, соединения или разложения, необходима постоянная подача теплоты для их протекания, а для каких — только первоначальная подача теплоты?
5 Проделайте дома такой опыт. Попробуйте поджечь в ложечке кусочек сахара. У вас ничего не получится: сахар будет плавиться, дымить, обугливаться, но не загорится. Если же на кусочек сахара поместить немного сигаретного пепла (не вздумайте курить сами — п
6 Приведите примеры действия ферментов, с которыми вы знакомились на уроках анатомии человека.
7 Сухой хлор хранят в железных баллонах. Влажный хлор разрушает железо. Какую роль играет вода в последнем процессе?
8 Дайте характеристику реакций, проведенных в параграфе, по плану: а) характер и число реагентов и продуктов; б) направление; в) наличие катализатора; г) выделение или поглощение теплоты.
ЛАЙКНАК.ГУБЧАТЫЙ ХЛОРИД СЕРЕБРА, КАК БЫСТРО СОБРАТЬ В КУЧУ.
Генерал-лейтенант
Группа: Проверенные
Сообщений: 529
Статус: Offline
1 Какие реакции называют реакциями замещения? Сравните их с реакциями соединения и разложения.
2 Запишите уравнения следующих реакций замещения:а) оксид железа (III) + алюминий →t→б) оксид железа (III) + водород →t→в) хлорид меди (II) (р-р) + алюминий →г) оксид свинца (IV) + углерод →t→ д) бромид железа (III) (р-р
3 Рассчитайте объем водорода (н.у.), который образуется при взаимодействии 1,5 моль алюминия с соляной кислотой. Какое количество вещества хлороводорода потребуется для этой реакции?
4 Определите объем водорода (н.у.), который потребуется для замещения всей меди из 640 мг образца оксида меди (II), содержащего 25% примесей.
5 Найдите количество вещества серебра, которое выделится на медной пластинке, помещенной в 169 г 2,5%-го раствора нитрата серебра, если исходить из предположения, что вся соль вступит в реакцию.
Генерал-лейтенант
Группа: Проверенные
Сообщений: 529
Статус: Offline
1 Какие реакции называют реакциями обмена? Чем они отличаются от реакций соединения, разложения и замещения?
2 Можно ли утверждать, что взаимодействие раствора карбоната какого-либо металла и кислоты является только реакцией обмена? Почему?
3 Запишите уравнения реакций обмена между растворами:а) хлорида кальция и фосфата калия;б) серной кислоты и гидроксида железа (III).
4 Какие из реакций обмена, схемы которых: будут протекать до конца? Для ответа воспользуйтесь таблицей растворимости гидроксидов и солей в воде.
5 Определите количество вещества гидроксида натрия, которое потребуется для полной нейтрализации 980 г 30% -го раствора фосфорной кислоты.
6 Вычислите массу осадка, выпавшего при взаимодействии 980 г 20% -го раствора сульфата меди (II) с необходимым количеством гидроксида калия. Каково количество вещества образовавшегося осадка?
СЕРЕБРИН – насыщение воды ионами серебра у Вас дома
Генерал-лейтенант
Группа: Проверенные
Сообщений: 529
Статус: Offline
1 Закончите уравнения реакций, схемы которых:а) Н2O + SO2 -→б) К2O + Н2O→в) Ba + Н2O→г) K + H2O→д) CaH2 + H2O→е) Al3C4 + Н2O→ Укажите типы реакций по признаку «число и состав исходных веществ и продуктов реакции». Назовите пр
2 Какой объем ацетилена (н.у.) образуется в результате гидролиза 320 мг карбида кальция, содержащего 2% примесей?
3 Запишите уравнения реакций, с помощью которых можно осуществить следующие превращения: Укажите типы реакций по признаку числа и состава исходных веществ и продуктов реакции.
4 Вычислите объем (н.у.) водорода, который образуется при взаимодействии 9,2 г натрия, содержащего 2,5% примесей, с водой. Вычислите количество вещества щелочи, которое получится при этом.
5 Найдите массу глюкозы и объем кислорода (н.у.), образующихся в процессе фотосинтеза, если в реакцию вступило 448 м3 углекислого газа (н.у.). Вычислите количество вещества воды, которое для этого потребовалось.
Генерал-лейтенант
Группа: Проверенные
Сообщений: 529
Статус: Offline
Практическая работа № 1 Приемы обращения с лабораторным оборудованием
Практическая работа № 2. Наблюдение за горящей свечой
Практическая работа № 3. Анализ почвы и воды
Практическая работа № 4. Признаки химических реакций
Практическая работа № 5. Приготовление раствора сахара и расчет его массовой доли в растворе
Генерал-лейтенант
Группа: Проверенные
Сообщений: 529
Статус: Offline
1 Почему в горячем чае кусочек сахара растворяется быстрее, чем в холодном?
2 Приведите примеры хорошо растворимых, малорастворимых и практически нерастворимых в воде веществ различных классов, пользуясь таблицей растворимости.
3 Почему аквариумы нельзя заполнять быстро охлажденной прокипяченной водой (она должна постоять несколько дней)?
4 Почему ранки, промытые водой, в которую были помещены серебряные изделия, заживают быстрее?
5 Пользуясь рисунком 123, определите массовую долю хлорида калия, содержащегося в насыщенном растворе при 20 °С.
6 Может ли разбавленный раствор быть одновременно и насыщенным?
7 К 500 г насыщенного при 20 °С раствора сульфата магния (см. рис. 123) прилили достаточный для проведения реакции объем раствора хлорида бария. Найдите массу выпавшего осадка.
Генерал-лейтенант
Группа: Проверенные
Сообщений: 529
Статус: Offline
1 Объясните, почему раствор гидроксида калия проводит электрический ток, а раствор глюкозы С6Н12O6 — нет.
2 Почему при разбавлении раствора электролита степень его диссоциации увеличивается?
3 Докажите, что деление химических связей на ковалентную полярную и ионную условно.
4 Как отличается по своей природе электропроводность металлов и электролитов?
5 Как объяснить электрическую проводимость водных растворов электролитов?
Генерал-лейтенант
Группа: Проверенные
Сообщений: 529
Статус: Offline
1 Сравните по строению и свойствам:а) Ca0 и Ca2+; б) Cu2+(гидр) и Cu2+(негидр); в) H02 и Н+.
2 Используя таблицу растворимости, приведите примеры пяти веществ, которые в растворах образуют сульфат-ионы SO42-. Запишите уравнения электролитической диссоциации этих веществ.
3 Какую информацию несет в себе следующее уравнение: Дайте названия вещества и ионов.
4 Запишите уравнения диссоциации следующих электролитов: сульфата железа (III), карбоната калия, фосфата аммония, нитрата меди (П), гидроксида бария, соляной кислоты, гидроксида калия, хлорида железа (II). Дайте названия ионов.
5 Какие из перечисленных ниже веществ будут диссоциировать: гидроксид железа (II), гидроксид калия, кремниевая кислота, азотная кислота, оксид серы (IV), оксид кремния (IV), сульфид натрия, сульфид железа (II), серная кислота? Почему? Запишите возможные у
6 В записи уравнений ступенчатой диссоциации серной кислоты для первой ступени используют знак равенства, а для второй — знак обратимости. Почему?
Генерал-лейтенант
Группа: Проверенные
Сообщений: 529
Статус: Offline
1 Запишите молекулярные и ионные уравнения реакций, о которых говорилось в первой части параграфа, — между сульфатом калия и нитратом бария, между серной кислотой и хлоридом бария. В чем суть обеих реакций?
2 Запишите молекулярные и ионные уравнения реакций, о которых говорилось во второй части параграфа, — между гидроксидом меди (II) и соляной кислотой, между гидроксидом меди (II) и азотной кислотой. В чем суть обеих реакций?
3 Запишите молекулярное и ионное уравнения реакций между карбонатом калия и фосфорной кислотой. Что объединяет эту реакцию и те реакции, о которых говорилось в конце параграфа?
4 Предложите свои примеры ионных реакций, протекающих с образованием осадков, пользуясь таблицей растворимости. Уравнения реакций запишите в молекулярной и ионной формах.
5 Приведите по два молекулярных уравнения реакций для следующих ионных
Генерал-лейтенант
Группа: Проверенные
Сообщений: 529
Статус: Offline
1 Выберите формулу сильной кислоты: a) H2S; б) HNO3;в) H2SiO3. Запишите уравнение диссоциации кислоты.
2 Дайте характеристику азотистой кислоты, используя различные признаки классификации кислот.
3 Определите степени окисления элементов в следующих кислотах: хлорной HClO4, хромовой Н2CrO4, двухромовой Н2Cr2O7, азотистой HNO2, пирофосфорной Н4Р2O7.
4 Закончите молекулярные уравнения возможных реакций и запишите соответствующие им ионные уравнения: Если реакция не может быть осуществлена, объясните почему.
5 Рассчитайте объем водорода (н.у.), который выделится при растворении в соляной кислоте 120 г магния, содержащего 2,5% примесей.
6 Запишите формулы оксидов, соответствующих следующим кислотам: HNO2, HNO3, H3PO4, H2SO3, H2SO4, H2SiO3.
Генерал-лейтенант
Группа: Проверенные
Сообщений: 529
Статус: Offline
1 Выберите сильное основание: a) NH3⋅H2O; б) Cu(OH)2;в) КОН.
2 Дайте характеристику гидроксида бария, используя различные признаки классификации оснований.
3 Закончите молекулярные уравнения возможных реакций, запишите соответствующие им ионные уравнения: Если реакция не будет протекать, укажите причину этого.
4 Вычислите объем аммиака (н.у.), который выделится при взаимодействии 890 г нитрата аммония, содержащего 20% примесей, с раствором гидроксида натрия. Сколько граммов 20% -го раствора щелочи потребуется для реакции?
5 Запишите формулы оксидов, которые будут соответствовать следующим гидроксидам: Cu(OH)2, CuOH, Fe(OH)3, Fe(OH)2, NaOH.
Генерал-лейтенант
Группа: Проверенные
Сообщений: 529
Статус: Offline
1 Из перечня формул выпишите отдельно формулы основных и кислотных оксидов и запишите соответствующие им формулы оснований и кислот: SiO2, CrO3, MgO, Mn2O7, Cu2O, SO2, FeO, N2O3, К2O, NiO, Na2O, NO, BaO. Назовите все вещества.
2 Дайте характеристику химических свойств оксида серы (IV). Запишите уравнения характерных реакций.
3 Допишите уравнения возможных химических реакций: Если реакция не протекает, укажите причину.
4 В 420 мл воды растворили 40 г оксида серы (VI). Вычислите массовую долю серной кислоты в полученном растворе.
5 Вычислите объем углекислого газа (н.у.), который образуется при обжиге 500 г известняка, содержащего 20% примесей. Вычислите количество вещества оксида кальция, образующегося при этом.
Генерал-лейтенант
Группа: Проверенные
Сообщений: 529
Статус: Offline
1 Из перечня формул выпишите отдельно формулы средних, кислых и основных солей, дайте их названия и запишите уравнения их диссоциации: Ca(HSO4)2, (CaOH)2SO4, Ca(NO3)2, NaH2PO4, Na3PO4, MgOHNO3.
2 Закончите молекулярные уравнения возможных реакций, протекающих в растворах, и запишите соответствующие им ионные уравнения: Если реакция не может быть осуществлена, объясните почему.
3 К 980 г 5% -го раствора серной кислоты прилили избыток раствора нитрата бария. Найдите массу выпавшего осадка.
4 Запишите уравнения реакций всех возможных способов получения сульфата железа (II).
5 Определите степени окисления элементов в солях, формулы которых: Na2SO4, K2SO3, Fe(NO3)3, Fe(NO2)2, Mg(HCO3)2, Ca3(PO4)2, NaHSO4, CuOHNO3.
Генерал-лейтенант
Группа: Проверенные
Сообщений: 529
Статус: Offline
1 Запишите уравнения реакций, с помощью которых можно осуществить превращения, лежащие в основе приведенных генетических рядов металлов и неметаллов. Дайте названия веществ, уравнения реакций с участием электролитов напишите также и в ионной форме.
2 Запишите уравнения реакций, с помощью которых можно осуществить следующие превращения: Уравнения реакций с участием электролитов запишите также и в ионной форме.
3 Какие из перечисленных ниже веществ взаимодействуют с соляной кислотой: магний, оксид меди (II), гидроксид меди (II), медь, нитрат магния, гидроксид железа (III), оксид кремния (IV), нитрат серебра, сульфид железа (II)? Запишите уравнения возможных реак
4 Какие из перечисленных ниже веществ взаимодействуют с гидроксидом натрия: оксид углерода (IV), гидроксид кальция, оксид меди (II), нитрат меди (II), хлорид аммония, кремниевая кислота, сульфат калия? Запишите уравнения возможных реакций в молекулярной и
5 Дайте определения всех классов веществ, приведенных в схеме на с. 226. На какие группы делится каждый класс веществ?
Источник: relasko.ru
Промытые водой в которую были помещены серебряные изделия заживают быстрее
1.http://www.hemi.nsu.ru/ucheb176.htm
2. https://ru.wikipedia.org/wiki/Растворимость
3. https://blog.tutoronline.ru/rastvorenie−rastvorimost−vewestv−v−vode
4. https://www.yaklass.ru/p/himija/89−klass/rastvory−58606/rastvorenie−rastvorimost−88647
5. http://schooled.ru/chemistry/admission/49.html
6. https://nauka.club/khimiya/kristallogidraty.html
2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Гидраты и кристаллогидраты, кристаллизационная вода
Гидраты – продукты присоединения воды (гидратации) к молекулам, атомам, ионам. Они могут быть твердые, жидкие и реже газообразные. Твердые гидраты, имеют свое название – кристаллогидраты.
Кристаллогидраты – твердые вещества, продукты присоединения воды (гидратация) к атомам, молекулам или ионам.
Кристаллизационная вода – вода, входящая в состав кристаллогидратов.
Кристаллогидраты создаются, когда катионы вещества кристаллической решетки образуют связи с водными молекулами. Соединения более прочные, чем связи анионов и катионов в кристаллах безводной соли. Примечательным свойством кристаллогидратов является то, что при низких температурах содержащаяся в них жидкость связывается с катионами и ионами солей. Основания, кислоты, а также значительное количество солей из водных растворов в осадок выпадают кристаллогидратами, завершая кристаллизационный процесс.
История.
История этих химических элементов начинается с 1826 года, когда были открыты гидраты спирта.Дальнейшее продолжение их изучения связано с Д. И. Менделеевым. В процессе исследования реакции соединения воды и спирта он определил, что при этом образуются новые соединения, которые сопровождают химические и физические процессы. В 1880 году понятие гидраты было введено в химии для характеристики определённых соединений веществ, растворенных в жидкости. Однако систематическое и подробное изучение кристаллогидратов, возможность рассчитать их массовую долю, выявление и установление составляющих началось только в 1889 году.
Растворение в воде.
Растворение кристаллогидратов в воде — сложный химико−физический процесс. При этом решетка кристаллическая у соединения может рушиться, а образуемые вследствие этого элементы (частички) распространяются по всему раствору. Такое преобразование способно выдать значительную тепловую энергию.
Объём в соединениях воды может быть различным: от молей дробного числа на моль вещества до значительного молярного объема. В зависимости от состояния температуры среды одно и то же вещество может иметь в себе различное количество молекул воды. Отдельные кристаллогидраты при попадании на воздух могут терять кристаллизационную воду самостоятельно (самопроизвольно), что называется выветриванием. В большинстве случаев, чтобы удалить жидкость (воду) искусственно, привести ее к обезвоживанию, используют нагревание и прокаливание.
Области применения.
Кристаллогидраты нашли применение в различных отраслях народного хозяйства. Так, гипс используется в медицинской сфере (в стоматологии, хирургии, ортопедии).
В медицине широко применяются сульфат натрия, сульфат магния, сульфат цинка, цитрат натрия, хлорид кальция, нитрат кальция, хлористое железо. Медный купорос известен как красящее вещество для тканей. Его растворами защищают древесину, протравливают семена. Метан в природных условиях в виде кристаллогидрата залегает в недрах Земли в огромных количествах, являясь перспективным моторным топливом.
?. Вопросы и задания
1. Почему в горячем чае кусочек сахара растворяется быстрее, чем в холодном?
Растворимость веществ в воде зависит от температуры. Как правило, растворимость твёрдых веществ в воде увеличивается с повышением температуры. Чем выше температура, тем выше скорость движения молекул воды и сахара, т. е. молекулы воды чаще взаимодействуют с молекулами сахара, поэтому интенсивнее происходит растворение.
2. Приведите примеры хорошо растворимых, малорастворимых и практически нерастворимых в воде веществ различных классов, пользуясь таблицей растворимости.
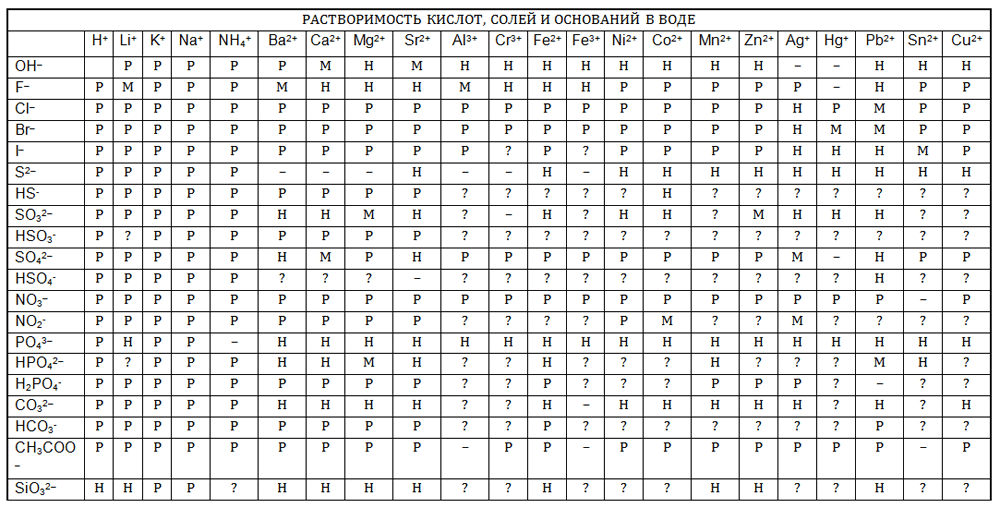
Хорошо растворимые: $AgNO_$ – нитрат серебра (I), $BaCl_$ – хлорид бария, $CaBr_$ – бромид кальция, $MgI_$ – иодид магния, $ZnSO_$ – сульфат цинка, $Pb(NO_)_$ – нитрат свинца (II).
Малорастворимые: $Ag_SO_$ – сульфит серебра (I), $BaF_$ – фторид бария, $CaSO_$ – сульфат кальция, $Mg(OH)_$ – гидроксид магния, $ZnSO_$ – сульфит цинка.
Практически нерастворимые: AgCl – хлорид серебра (I), $BaSO_$ – сульфат бария, $CaCO_$ – карбонат кальция, $Mg_(PO_)_$ – фосфат магния, ZnS – сульфид цинка, $PbI_$ – иодид свинца (II).
3. Почему аквариумы нельзя заполнять быстро охлаждённой прокипячённой водой (она должна постоять несколько дней)?
Аквариумы нельзя заполнять быстро охлаждённой прокипячённой водой, так как при увеличении температуры растворимость газов уменьшается (кислорода в том числе), соответственно рыбам нечем будет дышать. Поэтому прежде чем заполнять прокипячённой водой аквариум, необходимо дать ей постоять, чтобы атмосферный кислород успел снова раствориться в ней.
4. Почему ранки, промытые водой, в которую были помещены серебряные изделия, заживают быстрее?
Серебро растворяется в воде с образованием ионов серебра, которые обладают бактерицидным действием, поэтому ранки промытые такой водой заживают быстрее.
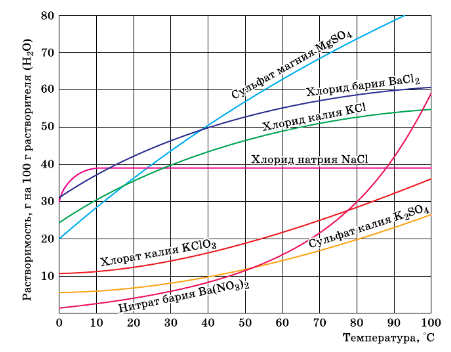
5. Пользуясь рисунком 124, определите массовую долю хлорида калия, содержащегося в насыщенном растворе при 20°C.
Рис. 124. Растворимость веществ в зависимости от температуры.
Дано:
m ($H_O$) = 100 г;
__________________
ω (KCl) − ?
Решение:
Согласно рисунку при температуре 20°C в 100 г воды содержится 35 г KCl
m (р−ра) = m (вода) + m (KCl) = 100 + 35 = 135 г;
$ ω (вещ-во) =frac$;
$ω (KCl) =frac = frac = 0,26$ или 26%.
Ответ. 26 %.
6. Может ли разбавленный раствор быть одновременно и насыщенным?
Разбавленным называют раствор с низкой концентрацией вещества. Когда вещество малорастворимо, раствор может быть разбавленным и насыщенным одновременно.

7. К 500 г насыщенного при 20 °C раствора сульфата магния (см. рис. 124) прилили достаточный для проведения реакции объём раствора хлорида бария. Найдите массу выпавшего осадка.
Рис. 124. Растворимость веществ в зависимости от температуры.
Дано:
$m_ (H_O)$ = 100 г;
$m_ (р-ра)$ = 500 г;
t = 20 °C;
_____________________
$ω (BaSO_)$ − ?
Решение:
$MgSO_ + BaCl_ = MgCl_ + BaSO_↓$;
Согласно рисунку при температуре 20°C в 100 г воды содержится 37 г $MgSO_$.
$m_(р-ра) = m_ (H_O) + m_(MgSO_) = 100 + 37 = 137$ г;
$ ω (вещ-во) =frac$;
$ω (MgSO_) =frac = frac = 0,27$ или 27%;
m (вещ−во) = m (р−ра) * ω;
$m_(MgSO_) = m_ (р-ра) * ω = 500 * 0,27 = 135$ г;
$n = frac$;
M ($MgSO_$) = 1 * Ar (Mg) + 1 * Ar (S) + 4 * Ar (O) = 1 * 24 + 1 * 32 + 4 * 16 = 120 г/моль;
$n (MgSO_) = frac = frac = 1,125$ моль;
Запишем уравнение реакции и составим пропорции:
$underset<overset<1,125 моль>> + BaCl_ = MgCl_ + underset<overset>$;
$x = n (BaSO_) = frac = 1,125$ моль;
m = n * M;
M ($BaSO_$)= 1 * Ar (Ba) + 1 * Ar (S) + 4 * Ar (O) = 1 * 137 + 1 * 32 + 4 * 16 = 233 г/моль;
$m (BaSO_) = n (BaSO_) * M (BaSO_) = 1,125 * 233 = 262$ г.
Ответ. 262 г.
- Вы здесь:
- 8 класс
- Химия
- ГДЗ ответы к учебнику химия 8 класс, Габриелян
- ГДЗ ответы к рабочей тетради по химии 8 класс, Габриелян, Сладков, Остроумов
- ГДЗ ответы к рабочей тетради химия 8 класс, Габриелян, Сладков
- ГДЗ ответы к учебнику химия 8 класс, Рудзитис, Фельдман
- ГДЗ ответы к учебнику химия 8 класс, Габриелян, Остроумов, Сладков
Источник: gdzotvet.ru
Параграф 35 Вопрос 4 ГДЗ Габриелян 8 класс по химии — ответы

4 Почему ранки, промытые водой, в которую были помещены серебряные изделия, заживают быстрее?
Ионы серебра Ag+ — естественный антибиотик, они приводят к гибели многих болезнетворных бактерий. Вода, в которую были помещены серебряные изделия, обогатилась ионами Ag+, поэтому она приобрела антисептические свойства. Благодаря этому, ранки, обработанные таким раствором, заживают быстрее.
На этой странице вы сможете найти и списать готовое домешнее задание (ГДЗ) для школьников по предмету Химия, которые посещают 8 класс из книги или рабочей тетради под названием/издательством «Учебник», которая была написана автором/авторами: Габриелян. ГДЗ представлено для списывания совершенно бесплатно и в открытом доступе.
Источник: gdz-spishy.ru