Разработка практического занятия предназначена длч студентов 2 курса специальности Фармация. Содержит вопросы для проверки исходного уровня знаний студентов, задания для индивидуального выполнения с алгоритмом действия, задания для закрепления материала.
Скачать:
Предварительный просмотр:
Министерство здравоохранения Амурской области
Государственное автономное учреждение Амурской области
профессиональная образовательная организация
Амурский медицинский колледж
практического занятия для студента
Тема : «Особые случаи изготовления растворов»
МДК 02.01. « Технология изготовления лекарственных форм»
ПМ 02. « Изготовление лекарственных форм и проведение обязательных видов внутриаптечного контроля»
Специальность: 060301 « Фармация»
Составлена: Суховой Л.П
изготовления лекарственных форм
Рассмотрено на заседании ЦМК Утверждено
Протокол № _______ центр АМК
от «___»_____________20___г. «___»__________________20___г.
Химическая металлизация (хромирование). Секретный рецепт. Бесплатно
Практическое занятие № 10
Тема: Особые случаи изготовления растворов.
Продолжительность занятия: 270 мин.
Цель занятия: Научиться готовить растворы лекарственных веществ с различными свойствами, оценивать качество приготовленных лекарственных форм и оформлять их к отпуску.
Задачи: Студент должен:
— Правила выписывания рецептов на жидкие лекарственные формы.
— Проверку доз веществ списка А и Б в растворах.
— Теоретические основы процесса растворения сухих лекарственных веществ и приёмы, позволяющие преодолеть затруднения при изготовлении растворов.
— Требования НТД по приготовлению, оценке качества и отпуску жидких лекарственных форм.
— Оценивать правильность выписывания рецептов на жидкие лекарственные формы.
— Проверять дозы веществ списка А и Б.
— Рассчитывать количество лекарственных веществ и растворителя.
— Выбирать и обосновывать оптимальную технологию, учитывая свойства входящих ингредиентов.
— Подбирать соответствующие средства упаковки и укупорки.
— Осуществлять основные технологические операции (отвесить, отмерить, процедить, нагреть, растворить).
— Оценивать качество приготовленных форм.
— Укупоривать и оформлять лекарственные формы к отпуску.
— Заполнять паспорт письменного контроля.
В результате обучения студент должен овладеть общими компетенциями :
— ОК.1. Понимать сущность и социальную значимость своей будущей профессии
— ОК.2. Организовывать собственную деятельность
— ОК 3. Решать проблемы, принимать решения в нестандартных ситуациях
— ОК 4. Осуществлять поиск, анализ информации, необходимой для постановки и решения профессиональных задач, личностного развития
— ОК.5. Использовать информационно-коммуникационные технологии в профессиональной деятельности
— ОК.6.Уметь работать в коллективе
Студент должен овладеть профессиональными компетенциями :
— ПК 2.1. Изготавливать лекарственные формы по рецептам
Нанесение СЕРЕБРА на СМАРТФОН. Химический метод нанесения серебра.
— ПК 2.2. Изготавливать внутриаптечную заготовку, фасовать лекарственные средства
— ПК.2.3. Владеть обязательными видами внутриаптечного контроля лекарственных средств
— ПК.2.4. Соблюдать правила санитарно-гигиенического режима, охраны труда, техники безопасности и противопожарной безопасности
— ПК.2.5. Оформлять документы первичного учета
Тип занятия: практическое занятие с элементами проблемного обучения.
Место проведения: кабинет технологии изготовления лекарственных форм.
1. Аванесьянц Э.М. Технология лекарственных форм. Феникс 2002г. 448с.
2. Грецкий В.М., Хоменок В.С. Руководство к практическим занятиям по технологии лекарственных форм. М. Медицина 2000г. 304 с.
3. ГФ Х. М. Медицина 1968г.
4. Муравьёв И.А Технология лекарств. М. Медицина 1980г.
5. Погорелов В.И. Фармацевтическая технология. Феникс 2002г. 543с.
6. Приказ МЗ РФ №376 от 13.11.96 г. «Об утверждении единых правил оформления лекарств, приготавливаемых в аптеках».
7. Приказ МЗ РФ №305 от 16.10.97г. «О нормах отклонений, допустимых при изготовлении лекарственных средств и фасовке промышленной продукции».
8. Приказ МЗ РФ №308 от 21.10.97г. «Об утверждении инструкции по изготовлению в аптеках жидких лекарственных форм».
1. Методическая разработка практического занятия для студентов и преподавателя.
2. Дидактический материал.
3. Средства деятельности: лекарственные средства, вода очищенная, цилиндры, воронки, марлевые салфетки, флаконы, пробки, крышки, бумажные прокладки, этикетки, весы, разновес.
1. Растворы, теория растворимости.
2. Дозирование по массе, объёму.
3. Средства упаковки и оформления жидких лекарственных форм.
4. Оценка качества жидких лекарственных форм.
1. Латинский язык (чтение и перевод рецептов).
2. Химия (свойства лекарственных веществ, работа с мерной посудой).
3. Знания гигиены.
4. Фармакология (правила выписывания ЖЛФ).
5. Организация и экономика фармации ( хранение лекарственных средств).
1. Организационный момент – 5 мин.
2. Контроль исходного уровня знаний – 40 мин.
3. Самостоятельная работа – 180 мин.
4. Закрепление пройденного материала – 25 мин.
5. Подведение итогов знания – 15 мин.
6. Задание на дом – 5 мин.
1. Организационный момент
Преподаватель проверяет у студентов: дневник, соответствующую форму одежды, готовность рабочего места к занятию.
В экстемпоральной рецептуре жидких лекарственных форм имеются прописи с лекарственными веществами, растворы которых не могут быть приготовлены по общим правилам. Растворение этих веществ требует применения индивидуальных приемов в виду особенностей их физико-химических свойств.
Знание фармацевтом особенностей растворения лекарственных веществ, точные расчёты при изготовлении растворов необходимы для обеспечения больных качественными лекарственными формами. Поэтому сегодня на занятии Вы должны, используя свои теоретические знания, научиться готовить растворы лекарственных веществ с различными свойствами.
2. Контроль исходного уровня знаний.
1. Фронтальный опрос (приложение № 1).
2. Решение ситуационных задач (приложение № 2) у доски.
3. Самостоятельная работа.
1. Студенты внимательно изучают теоретическую основу и алгоритм действия, выявляют неясные вопросы и получают ответы у преподавателя до выполнения задания.
2. Под руководством преподавателя:
а) Получают индивидуальное задание (приложение № 3)
б) Переводят рецепты на латинский язык.
в) Знакомятся со свойствами лекарственных веществ, входящих в состав прописи
г) Проводят необходимые расчёты по данной прописи.
д) Выбирают оптимальную технологию для данной прописи.
3. Самостоятельно (пользуясь алгоритмом действия):
а) Готовят водный раствор лекарственного вещества по указанию преподавателя
б) Оценивают качество приготовленных растворов.
в) Заполняют паспорт письменного контроля.
4. Закрепление пройденного материала.
1. Студенты группами (по 2-3 человека) решают ситуационные задачи по указанию преподавателя (приложение № 4)
2. Тестовый контроль ( приложение № 5)
5. Подведение итогов занятия.
Преподаватель оценивает полные и неполные ответы, активность на всех этапах занятия, самостоятельную работу. Оценка выставляется комплексная.
6. Задание на дом.
Тема: «Разбавление стандартных препаратов».
Вопросы для самоподготовки:
— Что регламентирует приказ МЗ РФ № 308?
— Что значит процентное выражение концентрации лекарственного вещества?
— Что собой представляют стандартные препараты, какими свойствами они обладают?
— Какова классификация стандартных препаратов?
— В чем особенность изготовления раствора кислоты хлористоводородной?
— В чем особенность изготовления растворов аммиака и кислоты уксусной?
— В чем особенность изготовления растворов стандартных препаратов, имеющих два названия?
— Какова особенность разбавления пергидроля?
— Какой показатель используют при разбавлении нестандартного раствора формалина или пергидроля?
— В какой концентрации отпускают стандартные препараты, если она не указана в рецепте?
Литература для подготовки:
1.Аванесьянц Э.М. Технология лекарственных форм. Феникс 2002г. 448с.
2.Грецкий В.М., Хоменок В.С. Руководство к практическим занятиям по технологии лекарственных форм. М. Медицина 2000г. 304 с.
3. Муравьёв И.А Технология лекарств. М. Медицина 1980г.
4. Погорелов В.И. Фармацевтическая технология. Феникс 2002г. 543с.
5. Лекционный материал
Раствор — жидкая лекарственная форма, полученная путем растворения одного или нескольких веществ.
Водные растворы готовят массо-объемным способом, т.е. вещество отвешивают в граммах на весах, воду отмеривают до получения заданного объема раствора в миллилитрах.
Растворение — основная стадия изготовления растворов. Абсолютно не растворимых веществ не существует, однако растворимость различных веществ очень сильно колеблется. Некоторые вещества, обладая довольно высокой растворимостью, растворяются медленно (меди сульфат, амидопирин, кислота борная). Для ускорения растворения подобных веществ применяют такие приемы, как нагревание, предварительное измельчение растворяемого вещества и перемешивание.
Крупнокристаллические вещества (натрия сульфат, магния и меди сульфаты) предварительно измельчают в ступке без растворителя или с частью выписанного в рецепте растворителя.
Растворы окислителей (серебра нитрата, калия перманганата) готовят на свежеприготовленной воде очищенной, предварительно профильтрованной через стеклянный фильтр №1 или через ватный тампон, промытый горячей очищенной водой.
Растворы фурацилина готовят при нагревании на 0,9% растворе натрия хлорида (для усиления фармакологического действия фурацилина).
Растворы сулемы (ртути дихлорида) готовят путем растворения при нагревании, с добавлением
равного количества натрия хлорида. Растворы подкрашивают фуксином или эозином, о чем следует сделать пометку на этикетке.
При изготовлении растворов йода учитывают его хорошую растворимость в концентрированных растворах иодидов. Причем иодиды берут в 2 раза больше, чем йода.
Наиболее часто применяются растворы Люголя для внутреннего (5%) и наружного (1%) применения.
Растворы осарсола готовят с добавлением натрия гидрокарбоната (для улучшения растворимости осарсола).
Растворы кальция глюконата готовят при нагревании, с добавлением активированного угля, взятого в количестве 3-5 % от массы кальция глюконата. Раствор готовят, учитывая прирост объема раствора при растворении лекарственного вещества.
Источник: nsportal.ru
Тема 3.1.4. Особые случаи приготовления растворов.
Для ускорения растворения веществ умеренно, мало или медленно растворимых применяют следующие приемы:
— нагревание (труднорастворимые вещества)
— предварительно измельчают в ступке (крупнокристаллические вещества)
— комплексообразование (раствор Люголя)
— применение солюбилизаторов в соответствии с НТД,(в качестве солюбилизаторов – поверхностно – активных веществ ПАВ)
— особые приемы (раствор йода в спирте: вещество подвешивают в марлевом мешочке так, чтобы оно касалось только верхнего слоя растворителя, при этом насыщенный раствор опускается вниз, а вверх поднимается чистый растворитель. Скорость растворения возрастает.
Особые случаи приготовления растворов.
1. Труднорастворимые вещества в холодной воде, хорошо в горячей: дибазол, борная кислота, натрия тетраборат, кофеин, кислота никотиновая, глютаминовая кислота, кодеин, рибофлавин, глюконат кальция, этакридиналактат и др. Для их растворения используют горячую воду.
2. Крупнокристаллические вещества: магния сульфат, меди сульфат, натрия сульфат, алюмокалиевые квасцы. Их предварительно измельчают в ступке с небольшим количеством воды, затем добавляют еще воду, фильтруют через тампон, часть воды оставляют для споласкивания ступки и пестика.
3. С гигроскопичными веществами:
а) Если вещество теряет сыпучее состояние, например кальция хлорид, то готовят концентрированный раствор (50%)
б) Если не теряет сыпучее состояние, то его берут больше с учетом влажности (например, для глюкозы процент влажности указывается в сопроводительных документах при получении и переносится на этикетку штангласа)
Расчет ведут по формуле:
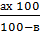
Х = где х – масса водной глюкозы
а – масса безводной глюкозы
Возьми: Раствора глюкозы 10% — 200,0 22,22
Дай. Обозначь: воды до 200 мл
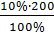
mб/вглюк = = 20,0
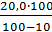
mв.глюк= = 22,22
Норма отклонения 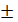 2% ДО =
2% ДО = 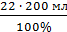 = 4 мл
= 4 мл

прирост V = 22,22 0,69 = 15,33 мл
значит воды до 200 мл или

Vводы = 200 – 22,22 0,69 = 184,67 мл
КУО глюкозы с влажностью 10% — 0,69
Растворы с окислителями.
Окислители — нитрат серебра, перманганат калия, йод. Легко разрушаются в присутствии органических веществ (могут содержаться в воде, при фильтровании). Поэтому готовят на свежеперегнанной очищенной воде. Фильтруют при необходимости через стеклянные фильтры.
Растворы нитрата серебра
Это вещество с нормируемыми дозами. Отвешивают на специальных весочках или на весах с пергаментной бумагой как окислитель.
Технология изготовления: во флакон отмеривают необходимое количество воды. При растворении опускают один кристаллик нитрата серебра. Если нет мутной дорожки, то растворяют все количество. При необходимости раствор до1% можно профильтровать через маленький ватный тампон, тщательно промыть горячей очищенной водой (более крепкие растворы фильтруют через стеклянные фильтры).
Оформляют дополнительной этикеткой «Обращаться с осторожностью». Опечатывают. Флакон темного стекла.
Возьми: Раствора нитрата серебра из 0,06 – 120 мл 0,06
Дай. Обозначь: По столовой ложке 3 раза в день
120: 15 = 8 приемов
р.д.=0,06: 8 = 0,0075 0,03 с.д 0,0225 0,1
норма отклонения 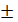 3% ДО =
3% ДО = 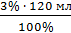 = 3,6 мл
= 3,6 мл

прирост V = 0,06 0,18 = 0,01мл, значит Vводы = 120 мл
Растворы калия перманганата
Медленно растворяется в холодной воде 1:18. Хорошо в горячей воде1:3,5. Отвешивают на весах с пергаментной бумагой.
Технология изготовления: растворы до 1% готовят сразу во флаконе для отпуска. При необходимости до 5% растворы можно профильтровать через маленький ватный тампон, тщательно промытый горячей очищенной водой. Растворы 1% и более 1% готовят в ступке на горячей воде.
Растирают перманганат калия с небольшим количеством горячей воды в ступке, затем добавляют еще воду и не фильтруя переносят во флакон для отпуска. Часть воды оставляют для споласкивания ступки. Отпускают во флаконе темного стекла.
Растворы йода
Кристаллический йод очень мало растворим в воде 1:5000. Используют способность йода образовывать легкорастворимые комплексные соединения с калия или натрия йодидами. Применяют растворы йода водные и на глицерине.
Растворы Люголя могут быть выписаны внутрь. Если не указана концентрация, то готовят 5% растворы йода внутрь.
Наружно. Если не указана концентрация, то растворы Люголя наружно готовят 1% раствор йода.
Технология изготовления: водные растворы йода готовят в мерной посуде или во флаконе для отпуска массо-объемным методом. Воды берут столько, сколько выписано калия йодида, растворяют калия йодид и в его насыщенном растворе растворяют йод (отвешивают на пергаментной бумаге).Затем объем раствора доводят до требуемого. Или воду можно рассчитать с учетом КУО йода и калия йодида:
Возьми: Раствора Люголя 20,0
Дай. Обозначь: По 5 капель внутрь 3раза в день на молоке
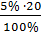
mйода = = 1,0

mку = 1,0 2 = 2,0
норма отклонений от Vоб. 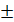 8% ДО =
8% ДО = 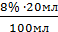 = 1,6мл
= 1,6мл
прирост V= 1,0 0,23 + 2,0 0,25 = 0,73мл,
значит Vводы=20мл готовят во флаконе.
Глицериновые растворы Люголя готовят по массе.
Технология изготовления: в предварительно старированном флаконе растворяют калия йодид (воды берут столько, сколько выписано йода и калия йодида). В насыщенном растворе растворяют йод, затем отвешивают глицерин до нужной массы. Если в рецепте не указан растворитель, то готовят водный раствор Люголя.
Возьми: Раствора Люголя на глицерине 20,0 У2 0,2 3
Дай. Обозначь: Для смазывания горла. КУ 0,4 2
воды0,6мл (12кап) 1
Готовят во флаконе.
3. Растворы фурацилина.
Фурацилин растворяется в соотношении 1:4200. Готовят в концентрации
1: 5000 на кипящем изотоническом растворе хлорида натрия (0,9%)
Возьми: Раствора фурацилина 1:5000 – 300,0 0,06
Выдай. Обозначь: Для полоскания Натрия хлорида – 2,7
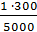
mфур = = 0,06
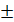
норма отклонений в Vоб 1%
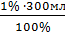
ДО = = 3мл

прирост V составит = 2,7 0,33 = 0,89мл, значит Vводы=300мл
Мерным цилиндром отмеривают 300мл воды очищенной. Помещают в термостойкую колбу. Фурацилин отвешивают как красящее (на простой прокладке), помещают в колбу с водой, отвешивают и помещают в колбу натрия хлорид и ставят на плитку нагревают до растворения. После охлаждения переливают в мерный цилиндр, проверяют объем, при необходимости доводят объем водой очищенной до 300мл. Затем фильтруют во флакон.
4. Растворы рибофлавина, этакридиналактата.
Рибофлавин и этакридинлактат (риванол) мало растворимы в воде.
Для изготовления растворов рибофлавина используют нагревание т.е. готовят в колбе термостойкого стекла. Применяют в концентрации 0,01%; 0,02%
Этакридиналактат легко растворим в кипящей воде. Поэтому его растворяют во всем количестве кипящей воды.
Возьми: Раствора риванола 1:1000 – 200,0 0,2
Для фурацилина, рибофлавина, риванола нет КУО, т. к. применяют растворы малой концентрации.
5. Растворы глюконата кальция.
Готовят при нагревании. Применяют 5%, 10% концентрации. В такой концентрации получаются пересыщенные растворы. Для очистки добавляют активированный уголь в количестве 3% — 5% от массы глюконата кальция. Раствор кипятят с углем минут 10-15, затем фильтруют в горячем виде через фильтр бумажный и доводят объем до нужного.
В растворы меньшей концентрации уголь не добавляют, а фильтруют через тампон.
6. Растворы тиосульфата натрия.
Часто встречается в рецептах как раствор №1 по Демьяновичу (раствор №2-раствор хлороводородной кислоты) для лечения чесотки.
Возьми: Раствора тиосульфата натрия 60% — 100,0
По авторской прописи раствор готовился по массе, т.е. 60,0 тиосульфата натрия и 40,0 воды; общая масса раствора 100,0. Объем полученного раствора составляет

40мл + 60,0 0,51 = 70,6мл.
70,6 мл – 60,0 тиосульфата натрия
100мл – х х=85,0тиосульфата натрия.
Технология изготовления: В мерной посуде в части горячей воды очищенной растворяют 85,0 натрия тиосульфата и объем раствора доводят до 100мл.

Или используют КУО: Vводы=100-(85,0 0,51) = 57мл.
В 57мл воды в подставке растворяют 85,0 натрия тиосульфата и фильтруют во флакон для отпуска.
7. Растворы гидрокарбоната натрия.
Готовят на воде очищенной, температура до 20 о С, т.к. при высокой температуре натрия гидрокарбонат переходит внатрия карбонат. При растворении избегают сильного взбалтывания.
8. Растворы йодопирона.
Йодопирон- йодофор, представляющий собой смесь комплекса ПВП (поливинилпирролидона) – йода с калия йодидом. Это желто-коричневый аморфный порошок со слабым специфическим запахом, содержащий 6-8% активного йода. 1% раствор изготавливают в аптечных условиях. 150,0 порошка йодопирона (готовая фасовка) растворяют в 800мл очищенной воды.
Во флакон емкостью 1л к навеске порошка (150,0) вначале прибавляют 200мл воды, встряхивают, перемешивают стеклянной палочкой. Оставляют на 0,5часа. Затем добавляют оставшуюся воду, встряхивают, через 10-15 минут. Раствор готов к применению. Хранят не более 2месяцев.
Источник: infopedia.su
Приготовление раствора серебра нитрата (0,1 моль/л)
Приготовление. 17 г серебра нитрата растворяют в воде в мерной колбе вместимостью 1 л и доводят объем раствора водой до метки.
Установка титра. Около 0,15 г (точная навеска) натрия хлорида, дважды перекристаллизованного из воды и слабо прокаленного в тигле при температуре от 250 до 300 °С, растворяют в 50 мл воды, и титруют приготовленным раствором серебра нитрата до появления красноватого осадка (индикатор — калия хромат). Молярность раствора вычисляют по первому способу.
Хранить в сосудах темного стекла с притертыми пробками в защищенном от света месте.
Концентрацию раствора вычисляют одним из указанных ниже способов.
Первый способ — по навеске химически чистого вещества. Молярность (М, моль/л) вычисляют по следующей формуле:
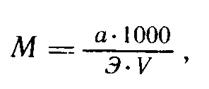
где а — навеска химически чистого вещества в граммах;
Э — молярная масса условных частиц химически чистого вещества в граммах на моль;
V — объем раствора, пошедшего на титрование навески, в миллилитрах;
1000 — количество миллилитров в 1 л раствора.
Второй способ — по титрованному раствору известной концентрации.
Молярность (Му мюль/л) вычисляют по следующей формуле:
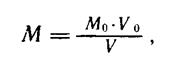
где
Мо — молярность раствора вещества по которому устанавливается титр, моль/л;
Vo — объем раствора, по которому устанавливается титр, в миллилитрах;
V — объем раствора, молярность которого устанавливают, в миллилитрах.
Для приготовленных титрованных растворов вычисляют поправочный коэффициент к молярности (К), представляющий собой отношение реально полученной концентрации титрованного раствора к теоретически заданной. Коэффициент К должен находиться в пределах от 0,98 до 1,02. При отклонении величины К от указанных пределов растворы необходимо соответственно укрепить или разбавить.
Методики количественного определения порошков калия хлорида натрия бромида, калия бромида, калия йодида.
Калия хлорид
Около 1 г препарата (точная навеска) растворяют в воде в мерной колбе емкостью 50 мл и доводят объем раствора водой до метки. 5 мл полученного раствора разбавляют водой до 40 мл и титруют 0,1 н. раствором нитрата серебра до оранжево-желтого окрашивания (индикатор — хромат калия).
1 мл 0,1 н. раствора нитрата серебра соответствует 0,007456 г КС1, которого в препарате должно быть не менее 99,5%,
Натрия бромид
Около 0,2 г препарата (точная навеска), предварительно высушенного при 110° в течение 4 часов, растворяют в 20 мл воды и титруют 0,1 н. раствором нитрата серебра до оранжево-желтого окрашивания (индикатор — хромат калия).
1 мл 0,1 н. раствора нитрата серебра соответствует 0,01029 г NaBr, которого в высушенном препарате должно быть не менее 99,0% и не более 100,6 %
Калия бромид
Около 0,2 г препарата (точная навеска), предварительно высушенного при 110° в течение 4 часов, растворяют в 20 мл воды и титруют 0,1 н. раствором нитрата серебра до оранжево-желтого окрашивания (индикатор — хромат калия).
1 мл 0,1 н. раствора нитрата серебра соответствует 0,01190 г КВr, которого в высушенном препарате должно быть не менее 99,0%) и не более 100,6%.
Калия йодид
Около 0,3 г препарата (точная навеска), предварительно высушенного при 110° в течение 4 часов, растворяют в 30 мл воды, прибавляют 1,5 мл разведенной уксусной кислоты, 5 капель 0,1% раствора эозината натрия и титруют 0,1 н. раствором нитрата серебра до перехода окраски осадка от желтой до розовой.
1 мл 0,1 н. раствора нитрата серебра соответствует 0,01660 г KI, которого в высушенном препарате должно быть не менее 99,5%.
Методики определения доброкачественности порошков калия хлорида натрия бромида, калия бромида, калия йодида.
Калия хлорид
Прозрачность и цветность раствора. 16 г препарата растворяют в 160 мл свежепрокипяченной и охлажденной воды. Полученный раствор-должен быть прозрачным и бесцветным.
Кислотность или щелочность. К 50 мл того же раствора прибавляют 5 капель раствора бромтимолового синего и 0,1 мл 0,02 н. раствора едкого-натра; должно появиться голубое окрашивание. К другим 50 мл того же раствора прибавляют 5 капель раствора того же индикатора и 0,1 мл 0,02 н. раствора соляной кислоты; должно появиться желтое окрашивание.
Соли аммония. 2,5 мл того же раствора, разведенные водой до 5 мл, не должны давать реакцию на соли аммония.
Кальций. 10 мл того же раствора не должны содержать кальция более чем 2 мл эталонного раствора, разведенные водой до 10 мл (не более 0,006% в препарате).
Магний. 5 мл того же раствора не должны давать мути от прибавления 0,5 мл раствора аммиака и раствора фосфата натрия.
Барий. 10 мл того же раствора не должны давать помутнения с разведенной серной кислотой при наблюдении в течение 2 часов.
Железо. 10 мл того же раствора не должны содержать железа более чем 1 мл эталонного раствора, разведенный водой до 10 мл (не более 0,0003% в препарате).
Тяжелые металлы. 10 мл того же раствора должны выдерживать испытание на тяжелые металлы (не более 0,0005% в препарате).
Сульфаты. Раствор 2 г препарата в 10 мл воды должен выдерживать испытание на сульфаты (не более 0,005% в препарате).
Натрий. 5% раствор препарата не должен окрашивать бесцветное пламя в желтый цвет.