Сульфат магния MgSO4 — соль щелочного металла магния и серной кислоты. Белый, разлагается выше температуры плавления. Хорошо растворяется в воде (слабый гидролиз по катиону).
Относительная молекулярная масса Mr = 120,37; относительная плотность для тв. и ж. состояния d = 2,66; tпл = 1137º C;
Способ получения
1. В результате взаимодействия карбоната магния и концентрированного раствора сульфата аммония при кипении образуется сульфат магния, аммиак, углекислый газ и воды:
Качественная реакция
Качественная реакция на сульфат магния — взаимодействие его с хлоридом бария, в результате реакции происходит образование белого осадка , который не растворим в азотной кислоте:
1. При взаимодействии с хлоридом бария , сульфат магния образует сульфат бария и хлорид магния:
Химические свойства
1. Сульфат магния вступает в реакцию со многими сложными веществами :
1.1. Сульфат магния взаимодействует с основаниями :
1.1.1. Сульфат магния реагирует с разбавленным раствором гидроксидом натрия с образованием гидроксида магния и сульфата натрия:
Получение сульфата марганца из диоксида (из батареек)
1.2. Сульфат магния может реагировать с кислотами :
1.2.1. При взаимодействии с концентрированной и холодной серной кислотой твердый сульфат магния образует гидросульфат магния:
1.3. Сульфат магния реагирует с солями :
1.3.1. Сульфат магния взаимодействует с концентрированным гидратом аммиака . При этом образуются гидроксид магния и сульфат аммония:
1.3.2. Сульфат магния вступает в реакцию с перхлоратами кальция, стронция и бария образуя сульфат этого металла и перхлорат магния:
1.3.3. Сульфат магния вступает во взаимодействие с гидрокарбонатом калия и образует карбонат магния, сульфат калия, воду и углекислый газ:
1.3.4. В результате реакции между насыщенным сульфатом магния и насыщенным хроматом кальция образуется хромат магния и сульфат кальция:
2. Сульфат магния разлагается при температуре выше 1200º С, образуя оксид магния, оксид серы и кислород:
Источник: chemege.ru
Опредление подлинности

- К 1 мл исследуемого раствора прибавляют 2 капли разведенной серной кислоты и по каплям раствор калия перманганата. Раствор калия перманганата обесцвечивается.
5H2O2 + 2KMnO4 + 3H2SO4 → 5O2 +K2SO4 + 2MnSO4 + 8 H2O
- 1 мл препарата подкисляют 4 каплями разведенной серной кислоты, прибавляют 2 мл эфира и 4 капли раствора бихромата калия и взбалтывают, эфирный слой окрашивается в синий цвет.
K2Cr2O7 + H2SO4 → H2Cr2O7 + K2SO4
Количественное определение

Перманганатометрический метод – основан на восстановительных свойствах перекиси водорода. К 0,1 мл ЛФ прибавляют 5 мл разведенной серной кислоты и титруют 0,1 моль/л раствором калия перманганата до слабо розового окрашивания. 5H2O2 + 2KMnO4 + 3H2SO4 → 5O2 +K2SO4 + 2MnSO4 + 8 H2O (по ГФ X допустимо отклонение 2,7-3,3%). Заключение: Данная лекарственная форма приготовлена удовлетворительно.
- Микстура Кватера
Rp: Tinct. Menthae 8,0 Tinct. Valerianae 20,0 Magnesii sulfatis 1,6 Coffeini-natrii benzoates 0,8 Natrii bromidi 6,0 Aq. purificatae 400 ml Описание: Мутная жидкость с запахом мяты и валерианы. Общий объем 428 мл.
Осадки для ЕГЭ по химии
Опредление подлинности

Магния сульфат.
- К 0,5 мл ЛФ прибавляют по 5-6 капель раствора аммония хлорида, натрия фосфата и 3-4 капли раствора аммиака. Образуется белый кристаллический осадок, растворимый в разведенной кислоте уксусной.
MgSO4 + Na2HPO4 + NH4OH → MgNH4PO4↓ + Na2SO4 + H2O
- К 0,5 мл ЛФ прибавляют 5-6 капель раствора бария хлорида. Образуется белый осадок, нерастворимый в разведенных минеральных кислотах.
MgSO4 + BaCl2 → BaSO4↓ + MgCl2Кофеин-бензоат натрия. К 0,5 мл ЛФ прибавляют 2 капли железа (III) хлорида. Образуется розовато-желтый осадок. Натрия бромид. К 0,5 мл ЛФ прибавляют 5-6 капель разведенной кислоты азотной и 2-3 капли раствора серебра нитрата. Образуется светло-желтый творожистый осадок. NaBr + AgNO3 → AgBr↓светло-желт. + NaNO3
Количественное определение
Магния сульфат (трилонометрически). Метод основан на образовании устойчивого комплекса Трилона Б с ионами Mg 2+ . К 0,5 мл ЛФ прибавляют 1 мл аммиачного буферного раствора, 1 каплю раствора кислотного хром черного специального и титруют 0,05 моль/л раствором Трилона Б до синего окрашивания. 
 В точке эквивалентности:
В точке эквивалентности: 
 Расчет отклонения:Dабс=1,585 – 1,6 = -0,015;
Расчет отклонения:Dабс=1,585 – 1,6 = -0,015;  (по П №305 допустимо 5%). Кофеин-бензоат натрия. К 1 мл ЛФ прибавляют 3 мл эфира и титруют 0,1 моль/л раствором соляной кислоты (индикатор – метиловый оранжевый).
(по П №305 допустимо 5%). Кофеин-бензоат натрия. К 1 мл ЛФ прибавляют 3 мл эфира и титруют 0,1 моль/л раствором соляной кислоты (индикатор – метиловый оранжевый). 
 Расчет отклонения:Dабс=0,794 – 0,8 = 0,006;
Расчет отклонения:Dабс=0,794 – 0,8 = 0,006;  (по П №305 допустимо 7%). Натрия бромид (аргентометрически методом Мора). Метод основан на способности натрия бромида реагировать с серебра нитратом с образованием серебра хлорида. К 0,5 мл ЛФ прибавляют 1 каплю хромата калия и титруют 0,1 моль/л р-ром серебра нитрата до оранжево-желтого цвета. 1мл 0,1 моль/л серебра нитрата соответствует 0,005844 г натрия хлорида. NaBr + AgNO3 → AgBr↓бел. + NaNO3 В т.к.т. 2 AgNO3 + K2CrO4 → Ag2CrO4↓Кирп. красн + 2KNO3
(по П №305 допустимо 7%). Натрия бромид (аргентометрически методом Мора). Метод основан на способности натрия бромида реагировать с серебра нитратом с образованием серебра хлорида. К 0,5 мл ЛФ прибавляют 1 каплю хромата калия и титруют 0,1 моль/л р-ром серебра нитрата до оранжево-желтого цвета. 1мл 0,1 моль/л серебра нитрата соответствует 0,005844 г натрия хлорида. NaBr + AgNO3 → AgBr↓бел. + NaNO3 В т.к.т. 2 AgNO3 + K2CrO4 → Ag2CrO4↓Кирп. красн + 2KNO3 Расчет отклонения:Dабс=6,16 – 6 = 0,16;
Расчет отклонения:Dабс=6,16 – 6 = 0,16;  (по П №305 допустимо 3%). Заключение: Данная лекарственная форма приготовлена удовлетворительно.
(по П №305 допустимо 3%). Заключение: Данная лекарственная форма приготовлена удовлетворительно.
- Rp: Furacilini 1,0
Natrii chloride 45,0 Aq. purificatae ad 5000 ml Описание: Прозрачный раствор желтого цвета, солено-горького вкуса. Общий объем 5 л.
Источник: studfile.net
Белый или почти белый кристаллический порошок или бесцветные призматические кристаллы.
Подлинность
Препарат дает характерные реакции на магний и сульфаты:
Mg 2+ : 1) К 0,5 мл лекарственной формы прибавляют по 0,3 мл раствора аммония хлорида, натрия фосфата и 0,2 мл раствора аммиака. образуется белый кристаллический осадок, растворимый в разведенных минеральных кислотах и уксусной кислоте.
2) 8–оксихинолин в аммиачной среде при рН 9,5–12,7 образует с ионами магния зеленовато-желтый кристаллический осадок внутрикомплексной соли оксихинолята магния Mg(C9H6NO)2·2H2O (нефармакоп):
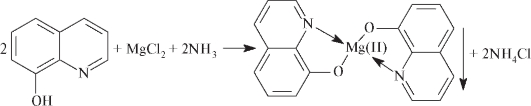
SO 4 2- : К 2 мл раствора сульфата (5 – 50 мг сульфат-иона) прибавляют 0,5 мл бария хлорида раствора 5 %; образуется белый осадок, нерастворимый в разведенных минеральных кислотах.
Количественное определение:
1. Комплексонометрический метод. Вариант прямого титрования. Метод основан на свойстве ионов магния количественно вступать в реакцию с комплексоном (трилоном Б) с образованием прочных, растворимых в воде, бесцветных внутрикомплексных соединений.
Титрант: раствор трилона Б – динатриевая соль этилендиаминотетрауксусной кислоты (сокращенно – Na2H2ТrБ).
Индикаторы: металлоиндикаторы – органические красители, имеющие различную окраску в свободном виде и виде комплекса с металлом, который менее прочный, чем комплекс трилона Б с металлом. Изменение окраски металлоиндикаторов зависит от pH среды.
Определение солей магния проводят в среде аммиачного буфера при рН 9,5-10,0. Индикатор – кислотный хром черный специальный (эриохром черный Т). Переход окраски от красно-фиолетовой к синей.
Магния оксид предварительно растворяют в кислоте хлороводородной разведенной.
Mg 2+ + H2Ind ® MgInd + 2H +
Окраска раствора за счет
комплекса металла с индикатором
В точке эквивалентности:
Окраска раствора за счет
2. Ацидиметрический метод нейтрализации (вариант обратного титрования). Используется для количественного определения магния оксида. Метод основан на свойстве магния оксида количественно взаимодействовать с кислотой хлороводородной с образованием соли:
HCI + NaOH → NaCI + H2O
fэкв (магния оксида) = Ѕ
Применение
Магния оксид – антацидное средство с легким послабляющим эффектом.
Магния сульфат – спазмолитическое, противосудорожное, успокаивающее, желчегонное и слабительное средство.
Фармакопейный анализ раствора гексаметилентетрамина
Описание
Бесцветный, прозрачный р-р, без запаха, жгучего и сладкого, а затем горького вкуса.
Подлинность
По новой статье: ИК спектр
1) Определяют по запаху.
2) По запаху аммиака и посинению красной лакмусовой бумажки.
1. Обнаружение HCHO — реакция серебрянного зеркала, реакция с ауриновым красителем (розовое окрашивание) и с хромотроповой кислотой (фиолетовое окрашивание).
2. Реакция на третичный азот. С осадительными веществами:
с фосфорно-вольфрамовой кислотой -> бел, амфотерный осадок,
с фосфорно-молибденовой кислотой -> желтый осадок,
с пикриновой кислотой -> желтый осадок.
3. С раствором йода дает полийодид, осадок бурого цвета.
можно использовать эту реакцию для к.о.
4. С бромом образует бледно-желтый осадок, растворимый в избытке реактива.
5. с AgNO3 в нейтральной среде:
Количественное определение: Обратная ацидиметрия.
избыток H2SO4 титруем NaOH с индикатором метиленовым Красным.
Нельзя использовать серную кислоту, т.к. хлорид аммония возгоняется, нельзя использовать ФФ, чтобы не оттитровать (NH4)2SO4.
Не ГФ. Прямая ацидиметрия.
Протон присоединяется по одной электронной паре. Индикатор — смесь МО и МС. Титруют от зеленой окраски до фиолетовой. f=1
2) Йодометрия (используется редко, т.к. необходим специальный титрованный раствор йода).
В результате реакции с йодом образуются перйодиды, которые выпадают в осадок, которые отфильтровывают. Избыток йода титруют тиосульфатом. Если не отфильтровать осадка, он будет разрушаться тиосульфатом.
Контрольный опыт. f=1/4
3) Обратная йодхлорметрия.
комплекс желтого цвета, устойчивый в нейтральной среде.
избыток ICl + KI -> I2 + KCl
Определяют: гравиметрически, или титруя избыток нитрата серебра по методу Фаянса.
Требование. Лекарственную форму считают выдержавшей испытание, если не более 2 индивидуальных масс отклоняются от средней массы на величину, превышающую допустимое отклонение, указанное в таблице. При этом ни одна индивидуальная масса не должна отклоняться от средней массы на величину, в 2 раза превышающую значение, указанное в таблице. (ОФС.1.4.2.0009.15 Однородность массы дозированных лекарственных форм)
Для определения средней массы таблеток и однородности по массе используют стеклянный или полимерный бюкс известной массы. Среднюю массу таблеток устанавливают взвешиванием вместе 20 таблеток с точностью до 0,001г и рассчитывают по формуле:
, где — суммарная масса 20 таблеток, г.
Для определения отклонения отдельных таблеток от средней массы взвешивают порознь каждую из 20 таблеток с точностью до 0,001 г.
Oтклонения отдельной таблетки от средней массы рассчитывают в %
где: — отклонение отдельной испытуемой таблетки от средней массы, %; — масса таблетки, г; — средняя масса таблеток.
Полученное значение средней массы таблетки оценивают в соответствии с нормативами, приведенными в фармакопейной статье на соответствующую лекарственную форму в разделе «Средняя масса таблетки». Отклонения отдельных таблеток от средней массы (за исключением таблеток, по крытых оболочкой методом наращивания) оценивают, исходя из следующих допустимых пределов:
— для таблеток массой 0,1 г и менее ±10%,
— для таблеток массой более 0,1 г и менее 0,3 г ±7,5%;
— для таблеток массой 0,3 г и более + 5%.
Для таблеток, покрытых оболочкой методом наращивания, масса отдельных таблеток не должна отличаться от средней массы более чем на ± 15%.
Отклонение отдельных таблеток считается соответствующим требованиям нормативной документации, если все значения отклонения от средней массы укладываются в допустимые пределы или только для двух таблеток превышают соответствующие допустимые пределы, но не более чем в 2 раза.
Подлинность.
Кофеин-бензоат натрия
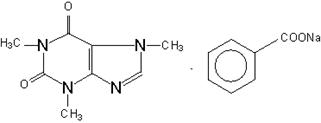
Получение. Взаимодействие водных растворов бензоата натрия и кофеина, полученный раствор выпаривают до образования сухого порошка.
1. реакции на кофеин после выделения щелочью и хлороформом.
2. реакция на бензоат ион с трихлоридом железа образуется осадок телесного цвета.
3. препарат дает реакции, характерные для иона натрия.
ГФ X:
Точную навеску препарата растворяют в воде, прибавляют разбавленную серную кислоту и 0,1 М раствор йода, после отстаивания в течение 15 минут раствор фильтруют и в фильтрате избыток йода оттитровывают 0,1 М раствором тиосульфата натрия, в конце титрования прибавляют раствор крахмала.
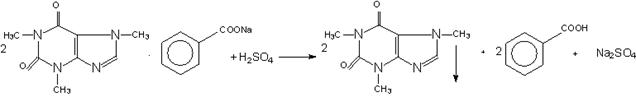
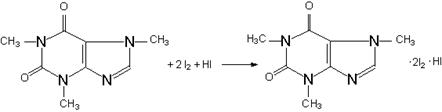
УЧ=1/4; формула обратного титрования
2. В другой навеске определяют количество бензоата натрия методом нейтрализации. Титрование ведут в присутствии эфира, который извлекает выделяющуюся бензойную кислоту.
Точную навеску препарата растворяют в воде, прибавляют эфир, смешанный индикатор (метиловый оранжевый и метиленовый синий) и титруют 0,5 М раствором соляной кислоты до появления сиреневой окраски водного слоя
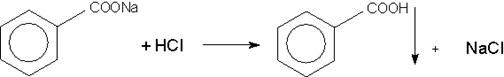
Бензоата натрия должно быть 58 — 62%.
Хранение. в хорошо укупоренной таре.
Применение. Стимулятор ЦНС, кардиотоническое средство.
Формы выпуска. Растворы для инъекций 10, 20%-ный, таблетки 0,1; 0,2.
Вопрос был пустой ес чо
Описание
Белый или почти белый кристаллический порошок или бесцветные кристаллы без запаха или со слабым запахом.
Подлинность
ИК-спектр. Инфракрасный спектр субстанции, снятый в диске с калия бромидом, в области частот от 4000 до 400 см-1, по положению полос поглощения должен соответствовать рисунку спектра стандартного образца ацетилсалициловой кислоты (Приложение).
УФ-спектр. Ультрафиолетовый спектр поглощения 0,007 % раствора субстанции в хлороформе в области от 260 до 350 нм дожен иметь максимум поглощения при 278 нм.
УФ-спектр. Ультрафиолетовый спектр поглощения 0,001 % раствора субстанции в 0,1 М растворе серной кислоты в области от 220 до 350 нм должен иметь максимумы поглощения при 228 нм и 276 нм и минимум поглощения при 257 нм.
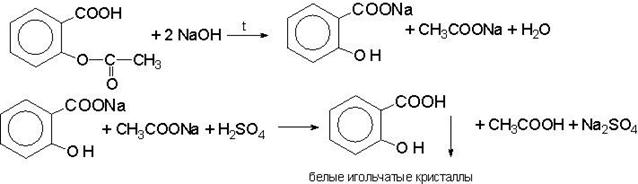
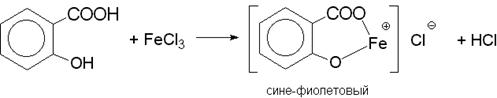
Качественная реакция. 0,5 г субстанции кипятят в течение 3 мин с 5 мл раствора натрия гидроксида, охлаждают, нейтрализуют серной кислотой разведенной 16 %; образуется белый кристаллический осадок. К осадку прибавляют 0,1 мл раствора железа(III) хлорида; должно появиться фиолетовое окрашивание.
Качественная реакция. К 0,2 г субстанции прибавляют 0,5 мл серной кислоты концентрированной, перемешивают, прибавляют 0,1 мл воды; должен появиться запах уксусной кислоты. Прибавляют 0,1 мл формалина; должно появиться розовое окрашивание.
Количественное определение.
1) Метод алкалиметрии.
Точную навеску препарата растворяют в нейтрализованном по фенолфталеину (5—6 капель) спирте и охлаждают до 8 — 9°. Раствор титруют с тем же индикатором 0,1М раствором едкого натра до розового окрашивания.
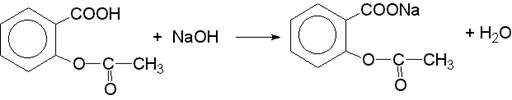
Формула прямого титрования.
2) Метод ацидиметрии после гидролиза.
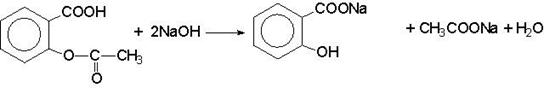
NaOH + HCl = NaCl + H2O
Формула обратного титрования.
100Методы качественного и кол. определения перекиси водорода.
Описание
Бесцветная прозрачная жидкость.
Подлинность
1. Качественная реакция. К 1 мл субстанции прибавляют 0,2 мл серной кислоты разведенной 16 % и 0,25 мл 0,02 М раствора калия перманганата; раствор должен постепенно обесцветиться с выделением газа.
2. Качественная реакция. К 0,1 мл субстанции прибавляют 0,2 мл серной кислоты разведенной 16 %, 2 мл эфира, 0,2 мл 5 % раствора калия дихромата и взбалтывают; эфирный слой должен окраситься в синий цвет.
Фармакопейный анализ магния сульфата – MgSO4
Описание
Белый или почти белый кристаллический порошок или бесцветные призматические кристаллы.
Подлинность
Препарат дает характерные реакции на магний и сульфаты:
Mg 2+ : 1) К 0,5 мл лекарственной формы прибавляют по 0,3 мл раствора аммония хлорида, натрия фосфата и 0,2 мл раствора аммиака. образуется белый кристаллический осадок, растворимый в разведенных минеральных кислотах и уксусной кислоте.
2) 8–оксихинолин в аммиачной среде при рН 9,5–12,7 образует с ионами магния зеленовато-желтый кристаллический осадок внутрикомплексной соли оксихинолята магния Mg(C9H6NO)2·2H2O (нефармакоп):

SO 4 2- : К 2 мл раствора сульфата (5 – 50 мг сульфат-иона) прибавляют 0,5 мл бария хлорида раствора 5 %; образуется белый осадок, нерастворимый в разведенных минеральных кислотах.
Количественное определение:
1. Комплексонометрический метод. Вариант прямого титрования. Метод основан на свойстве ионов магния количественно вступать в реакцию с комплексоном (трилоном Б) с образованием прочных, растворимых в воде, бесцветных внутрикомплексных соединений.
Титрант: раствор трилона Б – динатриевая соль этилендиаминотетрауксусной кислоты (сокращенно – Na2H2ТrБ).
Индикаторы: металлоиндикаторы – органические красители, имеющие различную окраску в свободном виде и виде комплекса с металлом, который менее прочный, чем комплекс трилона Б с металлом. Изменение окраски металлоиндикаторов зависит от pH среды.
Определение солей магния проводят в среде аммиачного буфера при рН 9,5-10,0. Индикатор – кислотный хром черный специальный (эриохром черный Т). Переход окраски от красно-фиолетовой к синей.
Магния оксид предварительно растворяют в кислоте хлороводородной разведенной.
Mg 2+ + H2Ind ® MgInd + 2H +
Окраска раствора за счет
комплекса металла с индикатором
В точке эквивалентности:
Окраска раствора за счет
2. Ацидиметрический метод нейтрализации (вариант обратного титрования). Используется для количественного определения магния оксида. Метод основан на свойстве магния оксида количественно взаимодействовать с кислотой хлороводородной с образованием соли:
HCI + NaOH → NaCI + H2O
fэкв (магния оксида) = Ѕ
Применение
Магния оксид – антацидное средство с легким послабляющим эффектом.
Магния сульфат – спазмолитическое, противосудорожное, успокаивающее, желчегонное и слабительное средство.
Источник: cyberpedia.su