При химических реакциях обязательно происходит изменение веществ, при котором рвутся старые и образуются новые связи между атомами.
Химические реакции следует отличать от ядерных реакций. В результате химической реакции общее число атомов каждого химического элемента и его изотопный состав не меняются. Иное дело ядерные реакции — процессы превращения атомных ядер в результате их взаимодействия с другими ядрами или элементарными частицами, например, превращение алюминия в магний:
Классификация химических реакций многопланова, т.е. в ее основу могут быть положены различные признаки. Но под любой из таких признаков могут быть отнесены реакции как между неорганическими, так и между органическими веществами.
Рассмотрим классификацию химических реакций по различным признакам.
В неорганической химии к таким реакциям можно отнести процессы получения аллотропных модификаций одного химического элемента, например:
В органической химии к этому типу реакций могут быть отнесены реакции изомеризации, которые идут без изменения не только качественного, но и количественного состава молекул веществ, например:
Экзо- и эндотермические реакции. Тепловой эффект химических реакций. 8 класс.
1. Изомеризация алканов.
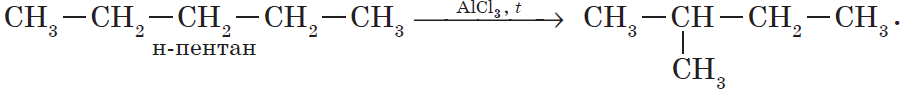
Реакция изомеризации алканов имеет большое практическое значение, т.к. углеводороды изостроения обладают меньшей способностью к детонации.
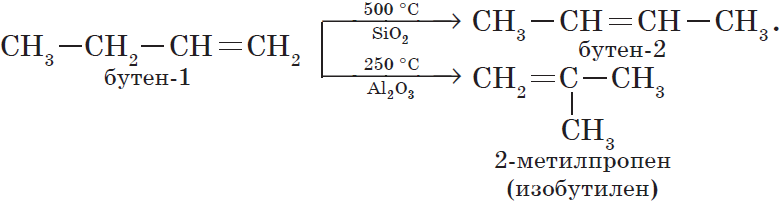
2. Изомеризация алкенов.
3. Изомеризация алкинов (реакция А. Е. Фаворского).
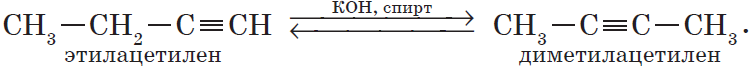
4. Изомеризация галогеналканов (А. Е. Фаворский).
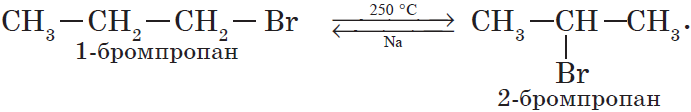
5. Изомеризация цианата аммония при нагревании.
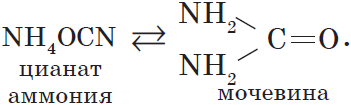
Впервые мочевина была синтезирована Ф. Велером в 1882 г. изомеризацией цианата аммония при нагревании.
Можно выделить четыре типа таких реакций: соединения, разложения, замещения и обмена.
В неорганической химии все многообразие реакций соединения можно рассмотреть на примере реакций получения серной кислоты из серы:
1) получение оксида серы (IV):
$S+O_2=SO_2$ — из двух простых веществ образуется одно сложное;
2) получение оксида серы (VI):
$2SO_2+O_2↖2SO_3$ — из простого и сложного веществ образуется одно сложное;
3) получение серной кислоты:
$SO_3+H_2O=H_2SO_4$ — из двух сложных веществ образуется одно сложное.
Примером реакции соединения, при которой одно сложное вещество образуется из более чем двух исходных, может служить заключительная стадия получения азотной кислоты:
В органической химии реакции соединения принято называть реакциями присоединения. Все многообразие таких реакций можно рассмотреть на примере блока реакций, характеризующих свойства непредельных веществ, например этилена:
1) реакция гидрирования — присоединение водорода:
2) реакция гидратации — присоединение воды:
Типы химических реакций. 1 часть. 8 класс.
3) реакция полимеризации:
В неорганической химии все многообразие таких реакций можно рассмотреть на примере блока реакций получения кислорода лабораторными способами:
1) разложение оксида ртути (II):
$2HgO↖2Hg+O_2↑$ — из одного сложного вещества образуются два простых;
2) разложение нитрата калия:
$2KNO_3↖2KNO_2+O_2↑$ — из одного сложного вещества образуются одно простое и одно сложное;
3) разложение перманганата калия:
$2KMnO_4↖K_2MnO_4+MnO_2+O_2↑$ — из одного сложного вещества образуются два сложных и одно простое, т.е. три новых вещества.
В органической химии реакции разложения можно рассмотреть на примере блока реакций получения этилена в лаборатории и промышленности:
1) реакция дегидратации (отщепления воды) этанола:
2) реакция дегидрирования (отщепления водорода) этана:
3) реакция крекинга (расщепления) пропана:
В неорганической химии примером таких процессов может служить блок реакций, характеризующих свойства, например, металлов:
1) взаимодействие щелочных и щелочноземельных металлов с водой:
2) взаимодействие металлов с кислотами в растворе:
3) взаимодействие металлов с солями в растворе:
Предметом изучения органической химии являются не простые вещества, а только соединения. Поэтому как пример реакции замещения приведем наиболее характерное свойство предельных соединений, в частности метана, — способность его атомов водорода замещаться на атомы галогена:
Другой пример — бромирование ароматического соединения (бензола, толуола, анилина):
Обратим внимание на особенность реакций замещения у органических веществ: в результате таких реакций образуются не простое и сложное вещества, как в неорганической химии, а два сложных вещества.
В органической химии к реакциям замещения относят и некоторые реакции между двумя сложными веществами, например, нитрование бензола:
Она формально является реакцией обмена. То, что это реакция замещения, становится понятным только при рассмотрении ее механизма.
Эти реакции характеризуют свойства электролитов и в растворах протекают по правилу Бертолле, т.е. только в том случае, если в результате образуется осадок, газ или малодиссоциирующее вещество (например, $Н_2О$).
В неорганической химии это может быть блок реакций, характеризующих, например, свойства щелочей:
1) реакция нейтрализации, идущая с образованием соли и воды:
или в ионном виде:
2) реакция между щелочью и солью, идущая с образованием газа:
или в ионном виде:
3) реакция между щелочью и солью, идущая с образованием осадка:
или в ионном виде:
В органической химии можно рассмотреть блок реакций, характеризующих, например, свойства уксусной кислоты:
1) реакция, идущая с образованием слабого электролита — $H_2O$:
2) реакция, идущая с образованием газа:
3) реакция, идущая с образованием осадка:
Классификация химических реакций по изменению степеней окисления химических элементов, образующих вещества
К ним относится множество реакций, в том числе все реакции замещения, а также те реакции соединения и разложения, в которых участвует хотя бы одно простое вещество, например:
Как вы помните, сложные окислительно-восстановительные реакции составляются с помощью метода электронного баланса:
В органической химии ярким примером окислительно-восстановительных реакций могут служить свойства альдегидов:
1. Альдегиды восстанавливаются в соответствующие спирты:
2. Альдегиды окисляются в соответствующие кислоты:
К ним, например, относятся все реакции ионного обмена, а также:
- многие реакции соединения:
- многие реакции разложения:
- реакции этерификации:
Классификация химических реакций по тепловому эффекту
По тепловому эффекту реакции делят на экзотермические и эндотермические.
Экзотермические реакции.
Эти реакции протекают с выделением энергии.
К ним относятся почти все реакции соединения. Редкое исключение составляют эндотермические реакции синтеза оксида азота (II) из азота и кислорода и реакция газообразного водорода с твердым иодом:
Экзотермические реакции, которые протекают с выделением света, относят к реакциям горения, например:
Гидрирование этилена — пример экзотермической реакции:
Она идет при комнатной температуре.
Эндотермические реакции
Эти реакции протекают с поглощением энергии.
Очевидно, что к ним относятся почти все реакции разложения, например:
а) обжиг известняка:
б) крекинг бутана:
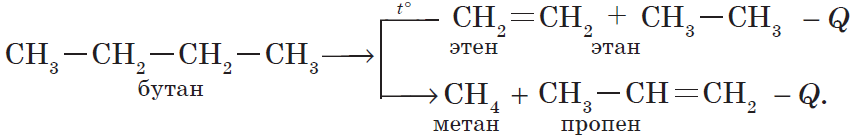
Количество выделенной или поглощенной в результате реакции энергии называют тепловым эффектом реакции, а уравнение химической реакции с указанием этого эффекта называют термохимическим уравнением, например:
Классификация химических реакций по агрегатному состоянию реагирующих веществ (фазовому составу)
Гетерогенные реакции.
Это реакции, в которых реагирующие вещества и продукты реакции находятся в разных агрегатных состояниях (в разных фазах):
Гомогенные реакции.
Это реакции, в которых реагирующие вещества и продукты реакции находятся в одном агрегатном состоянии (в одной фазе):
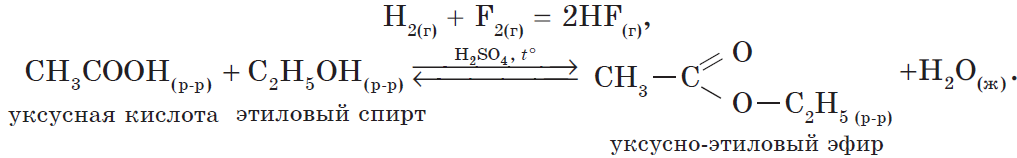
Классификация химических реакций по участию катализатора
Некаталитические реакции.
Некаталитические реакции идут без участия катализатора:
Каталитические реакции.
Каталитические реакции идут с участием катализатора:
Так как все биологические реакции, протекающие в клетках живых организмов, идут с участием особых биологических катализаторов белковой природы — ферментов, все они относятся к каталитическим или, точнее, ферментативным.
Следует отметить, что более $70%$ химических производств используют катализаторы.
Классификация химических реакций по направлению
Необратимые реакции.
Необратимые реакции протекают в данных условиях только в од ном направлении.
К ним можно отнести все реакции обмена, сопровождающиеся образованием осадка, газа или малодиссоциирующего вещества (воды), и все реакции горения.
Обратимые реакции.
Обратимые реакции в данных условиях протекают одновременно в двух противоположных направлениях.
Таких реакций подавляющее большинство.
В органической химии признак обратимости отражают названия-антонимы процессов:
- гедрирование — дегидрирование;
- гидратация — дегидратация;
- полимеризация — деполимеризация.
Обратимы все реакции этерификации (противоположный процесс, как вы знаете, носит название гидролиза) и гидролиза белков, сложных эфиров, углеводов, полинуклеотидов. Обратимость лежит в основе важнейшего процесса в живом организме — обмена веществ.
Источник: examer.ru
Тема. Энергетика химических реакций
1. Термохимические уравнения. Привести примеры. Расчет теплового эффекта химических реакций.
2. Закон Гесса, следствия из закона Гесса.
3. Энтропия, ее физический смысл. Расчет стандартного изменения энтропии в химической реакции.
4. Энергия Гиббса, ее физический смысл. Расчет стандартного изменения энергии Гиббса в химической реакции. Энтальпийный, энтропийный факторы и направление химической реакции. Оцените с термодинамических позиций состояние химического равновесия. Взаимосвязь энергии Гиббса и константы химического равновесия реакции.
5. Вычислите стандартное изменение энтальпии, энтропии и энергии Гиббса в следующих химических реакциях:
6. Укажите уравнение реакции, DH 0 которой является энтальпией образования вещества:
7. Вычислите энергию Гиббса в химической реакции
8. Оцените, в какую сторону смещено химическое равновесие реакции 2NO(г) = N2(г) + O2(г) при температуре 1000 0 С. Вычислите температуру, при которой наступает химическое равновесие.
Примеры выполнения заданий
Пример 1. Вычислите тепловой эффект химической реакции термического разложения нитрата серебра (I). Экзотермической или эндотермической является данная реакция?
Решение
1. Уравнение химической реакции, в котором указываем агрегатное состояние веществ:
2. Значения стандартных энтальпий образования веществ (таблица 3 в Приложении): DfH o (298 K) (запишите над уравнением химической реакции):
DfH o (298 K), кДж/ моль –124 0 33 0
3. В соответствии с первым следствием из закона Гесса тепловой эффект химической реакции:
DH o (298 K) = 2 DfH o (298 K) (Ag) + 2 DfH o (298 K) (NO2) +
= 2 · 0 + 2 · 33 + 2 · 0 — 2(-124) = 314 кДж/ моль.
4. Термохимическое уравнение термического разложения нитрата серебра (I):
| 2AgNO3(к) = 2Ag(к) + 2NO2(г)+ O2(г); | DH o (298 K) = 314 кДж/ моль. |
Ответ. Стандартная энтальпия реакции равна 314 кДж/ моль. Реакция эндотермическая, так как DH o (298 K) > 0.
Пример 2. Вычислите значение стандартной энтальпии реакции образования оксида железа (III) из простых веществ по следующим термохимическим уравнениям:
1. Термохимические уравнения соответствующих реакций:
| 2Fe(к) + O2(г) =2FeO(к); | DH o 1 (298 K) = — 532 кДж; (1) |
| 4FeO(к) + O2(г) =2Fe2O3(к); | DH o 2 (298 K) = — 584 кДж; (2) |
| 4Fe(к) + 3O2(г) = 2Fe2O3(к); | DH o 3 (298 K) =? (3) |
2. Схема этих процессов с указанием тепловых эффектов отдельных стадий:
DH o 1 (298 K) FeO DH o 2 (298 K)
3. По закону Гесса DH o 3 (298 K) =2 DH o 1 (298 K) + DH o 2 (298 K) =
= 2(-532) + (-584) = — 1648 кДж. (Учтено, что в реакции по уравнению (1) участвует железо в количестве 2 моль, а в реакции по уравнению (2) — 4 моль, поэтому тепловой эффект DH o 1 (298 K) удваивается.)
Ответ. Стандартная энтальпия реакции образования оксида железа (III) из простых веществ равна — 1648 кДж.
Пример 3. Вычислите изменение стандартной энтропии химической реакции: 2PbO2(к) = 2PbO(к) + O2(г).
1. Значения стандартных энтропий веществ (таблица 3 Приложения) Запишите под уравнением химической реакции:
S o (298 K), Дж/(моль·К) 72 66 205
2. Изменение стандартной энтропии химической реакции DS o (298 K):
DS o (298 K) = 2 DS o (298 K) (PbO) + DS o (298 K) (O2) –
— 2 DS o (298 K) (PbO2) =2 · 66 + 205 – 2 · 72 = 193 Дж/(моль · К).
Ответ. Изменение стандартной энтропии реакции равно
Пример 4. Вычислите значение стандартной энергии Гиббса реакции 4FeO(к) + O2(г) = 2Fe2O3(к) при температуре 298 К.
1. Значения стандартных энергий Гиббса образования веществ DfG o (298 K) (таблица 3 Приложения):
DfG o (298 K), кДж/ моль -245 0 -742
2. Стандартная энергия Гиббса химической реакции
DG o (298 K) = 2 DfG o (298 K) (Fe2O3) – 4 DfG o (298 K) (FeO) –
— DfG o (298 K) (O2) = 2 (-742) – 4 (-245) – 0 = -504 кДж
Ответ. Стандартная энергия Гиббса химической реакции при температуре 298 К равна – 504 кДж / моль.
Источник: infopedia.su
Классификация реакций
Существует несколько классификаций реакций, протекающих в неорганической и органической химии.
По характеру процесса
- Соединения
Так называют химические реакции, где из нескольких простых или сложных веществ получается одно сложное вещество. Примеры:
В результате реакции разложения сложное вещество распадается на несколько сложных или простых веществ. Примеры:
В ходе реакций замещения атом или группа атомов в молекуле замещаются на другой атом или группу атомов. Примеры:
К реакциям обмена относятся те, которые протекают без изменения степеней окисления и выражаются в обмене компонентов между веществами. Часто обмен происходит анионами/катионами:
AgF + NaCl = AgCl↓ + NaF
Реакция нейтрализации — реакция обмена между основанием и кислотой, в ходе которой получаются соль и вода:

Окислительно-восстановительные реакции (ОВР)
-
Межмолекулярные — атомы окислителя и восстановителя входят в состав разных молекул. Примеры:

Замечу, что окислителем и восстановителем могут являться только исходные вещества (а не продукты!) Окислитель всегда понижает свою СО, принимая электроны в процессе восстановления. Восстановитель всегда повышает свою СО, отдавая электроны в процессе окисления.
От обилия информации можно запутаться. Я рекомендую сформулировать четко: «Окислитель — понижает СО, восстановитель — повышает СО». Запомнив эту информацию таким образом, вы не будете путаться.

ОВР уравнивают методом электронного баланса, с которым мы подробно познакомимся в разделе «Решения задач».
Обратимые и необратимые реакции
Обратимые реакции — такие химические реакции, которые протекают одновременно в двух противоположных направлениях: прямом и обратном. При записи реакции в таких случаях вместо знака «=» ставят знак обратимости «⇆».
Классическим примером обратимой реакции является синтез аммиака и реакция этерификации (из органической химии):
Необратимые реакции протекают только в одном направлении, до полного расходования одного из исходных веществ. Главное отличие их от обратимых реакций в том, что образовавшиеся продукты реакции не взаимодействуют между собой с образованием исходных веществ.
- Образуются малодиссоциирующие вещества (например — вода, однако есть исключения — реакция этерификации)
- Реакция сопровождается выделение большого количества тепла
- В ходе реакции образуется газ или выпадает осадок
Примеры необратимых реакций:
NaOH + HCl = NaCl + H2O (образуется вода)
2Na + 2H2O = 2NaOH + H2 (сопровождается выделением большого количества тепла)

Фазой в химии называют часть объема равновесной системы, однородную во всех своих точках по химическому составу и физическим свойствам и отделенную от других частей того же объема поверхностью раздела. Фаза бывает жидкой, твердой и газообразной.
Все реакции можно разделить на гетеро- и гомогенные. Гетерогенные реакции (греч. heterogenes — разнородный) — реакции, протекающие на границе раздела фаз, в неоднородной среде. Скорость таких реакций зависит от площади соприкосновения реагирующих веществ.
К гетерогенным реакциям относятся следующие реакции (примеры): жидкость + газ, газ + твердое вещество, твердое вещество + жидкость. Примером такой реакции может послужить взаимодействие твердого цинка и раствора соляной кислоты:

Гомогенные реакции (греч. homogenes — однородный) — реакции, протекающие между веществами, находящимися в одной фазе.
К гомогенным реакциям относятся (примеры): жидкость + жидкость, газ + газ. Примером такой реакции может служить взаимодействие между растворами уксусной кислоты и едкого натра.

Все реакции можно разделить на те, в ходе которых тепло поглощается, или, наоборот, тепло выделяется. Представьте пробирку, охлаждающуюся или нагревающуюся в вашей руке — это и есть тот самый тепловой эффект. Иногда тепла выделяется так много, что реакции сопровождаются воспламенением или взрывом (натрий с водой).
Экзотермические реакции (греч. exo — вне) — химические реакции, сопровождающиеся потерей энергии системой и выделением тепла (той самой энергии) во внешнюю среду. При написании химических реакций в конце экзотермических ставят «+ Q» (Q — тепло), иногда бывает указано точное количество выделяющегося тепла. Например:
2Mg + O2 = 2MgO + Q
Большинство реакций нейтрализации относятся к экзотермическим:
NaOH + HCl = NaCl + H2O + 56 кДж

К экзотермическим реакциям часто относятся реакции горения, соединения.
Исключением является взаимодействие азота и кислорода, при котором тепло поглощается:
Как уже было отмечено выше, если тепло выделяется во внешнюю среду, значит, система реагирующих веществ потеряло это тепло. Поэтому не должно казаться противоречием, что внутренняя энергия веществ в результате экзотермической реакции уменьшается.
Энтальпией называют (обозначение Н), количество термодинамической (тепловой) энергии, содержащееся в веществе. Иногда с целью «запутывания» в реакции вместо явного +Q при экзотермической реакции могут написать ΔH 0, так как внутренняя энергия веществ увеличивается. Например:
CaCO3 = CaO + CO2↑ ; ΔH > 0 (значит реакция эндотермическая, так как внутренняя энергия увеличивается)

Замечу, что не все реакции разложения являются эндотермическими. Широко известная реакция разложения дихромата аммония («вулканчик») является примером экзотермического разложения, при котором тепло выделяется.

Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Классификация реакций
1. Реакция взаимодействия углерода с кислородом является реакцией
Эндотермической, обратимой Эндотермической, необратимой Экзотермической, обратимой Экзотермической, необратимой
Показать подсказку
Реакция углерода с кислородом является необратимой, сопровождается выделением тепла (процесс горения) — экзотермическая.
2. Реакция взаимодействия азота с кислородом относится к
Эндотермическим Экзотермическим
Показать подсказку
Горение азота в кислороде, как это ни удивительно, относится к реакции эндотермической. Это связано с наличием в азоте очень прочной тройной связи, для разрыва которой нужно приложить много усилий.
3. Энтальпия экзотермической реакции
Принимает положительное значение (ΔH #60 0)
Показать подсказку
В ходе экзотермической реакции внутренняя энергия веществ уменьшается, часть ее выделяется во внешнюю среду в виде тепла. Поскольку внутренняя энергия уменьшается, то энтальпия принимает отрицательное значения (ΔH https://studarium.ru/article/160″ target=»_blank»]studarium.ru[/mask_link]