Найдите правильный ответ на вопрос ✅ «Определите массу молекулы серебра . » по предмету Физика, а если вы сомневаетесь в правильности ответов или ответ отсутствует, то попробуйте воспользоваться умным поиском на сайте и найти ответы на похожие вопросы.
Новые вопросы по физике
Проводники сообщили заряд 1*10’9 кл, его зарядили до потенциала 100 в. Определить электроемкость проводника?
Две стальные проволоки, имеющие одинаковые длины, но разные сечения, включены параллельно в цепь. В какой из них будет выделяться большее количество теплоты за одно и то же время?
Что определяется выражением Q/m
Скорость автобуса равна20 м/с а скорость гоночного автомобиля 360 км/ч. Во сколька раз скорость гоночного автомобиля больше скорости автобуса
Источник: iotvet.com
Размеры и массы молекул.
Атомная единица массы (а.е.м.) – 1,6 . 10 -27 кг — единица массы, равная 1/12 массы изотопа углерода с массовым числом 12.
Масса молекул. Количество вещества | Физика 10 класс #25 | Инфоурок
, где m0 — масса молекулы (атома);
m0С — масса атома углерода (изотоп 12 С)
– относительная атомная масса определяется по таблице Менделеева!
Относительная молекулярная масса сложного вещества определяется как сумма относительных атомных масс всех атомов, входящих в состав данного вещества.
ν — количество вещества; [ν]=моль;
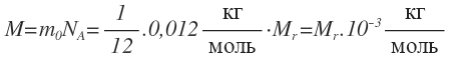
1 моль углерода имеет массу 0,012 кг
NA=6,02 . 10 24 моль -1 – число (постоянная) Авогадро – количество структурных элементов (атомов, молекул) в 1 моле вещества (в 12 г углерода 12 С).
, где М — молярная масса (масса 1 моля);
.
— концентрация — количество частиц в единице объема вещества. [n]=м -3
— плотность — масса единицы объема вещества.
Единицы плотности в СИ:
NA=6,02 . 10 24 моль -1
2. Оценим размеры молекулы, считая, что молекулы шарики.
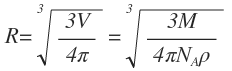
, следовательно, используя понятия плотности и молярной массы получим:
Например, для воды R=10 -10 м.
2. Другой способ оценки размеров молекул. Известно, что некоторые несмешивающиеся с водой жидкости (масло, нефть, олеиновая кислота и др.), растекаясь по поверхности воды, могут образовывать очень тонкие пленки (толщиной до одного молекулярного ряда). Можно провести опыт, в котором, зная объем жидкости и измерив площадь, которую она заняла на поверхности воды, можно оценить размер молекулы. Например:
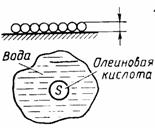
Олеиновая кислота — одноосновная насыщенная карбоновая кислота
Источник: www.eduspb.com
Урок 141. Количество вещества. Молярная масса. Оценка размеров молекул
Как определить массу одной молекулы серебра
Порядковый номер – 47. Строение атома показано на рис. 1. Металл d-семейства.
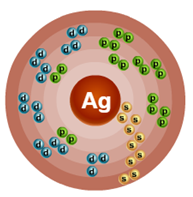
Рис. 1. Схема строения атома серебра.
В обычных условиях серебро представляет собой вещество белого цвета с гранецентрированной кубической решеткой. Металлу свойственна исключительная пластичность. Серебро значительно превосходит другие металлы по теплопроводности и электрической проводимости. Плотность 10,5 г/см 3 . Температура плавления 961,2 o C, кипения 2170 o C.
Молярная масса серебра равна 107,8682 г/моль. Данное значение показывает отношение массы вещества (m) е число моль данного вещества (n), обозначается M и может быть рассчитано по формуле:
Иными словами, молярная масса вещества – это масса 1 моль данного вещества, выраженная в г/моль или ккмоль.
Серебро не может существовать в виде газа, только в форме твердого вещества, поэтому для нахождения значения его молярной массы нельзя использовать величину молярного объема или производить расчеты по формуле Менделеева-Клапейрона.
Примеры решения задач
| Задание | Вычислите массовую долю нитрата серебра в растворе, полученном при растворении соли массой 40 г в воде количеством 20 моль. |
| Решение | Найдем массу воды (молярная масса 18г/моль): |
Рассчитаем массу раствора нитрата серебра:
msolution(AgNO3) = 40 + 360 = 400 г.
Вычислим массовую долю нитрата серебра в растворе:
| Задание | При растворении 3 г сплава меди и серебра в концентрированной азотной кислоте получили 7,34 г смеси нитратов. Определите массовые доли металлов в сплаве. |
| Решение | Запишем уравнения реакций взаимодействия металлов, представляющих собой сплав (медь и серебро), в концентрированной азотной кислоте: |
В результате реакции образуется смесь, состоящая из нитрата серебра и нитрата меди (II). Пусть количество вещества меди в сплаве составляет хмоль, а количество вещества серебра – у моль. Тогда массы этих металлов будут равны (молярная масса меди 64 г/моль, серебра – 108 г/моль):
Согласно условию задачи, масса сплава равна 3 г, т.е.:
По уравнению (1) n(Cu) : n(Cu(NO3)2) = 1:1, значит n(Cu(NO3)2) = n(Cu) =х. Тогда масса нитрата меди (II) составляет (молярная масса равна 188 г/моль) 188х.
Согласно уравнению (2), n(Ag) : n(AgNO3) = 1:1, значит n(AgNO3) = n(Ag) =y. Тогда масса нитрата серебра составляет (молярная масса равна 170 г/моль) 170y.
По условию задачи масса смеси нитратов равна 7,34 г:
Получили систему уравнений с двумя неизвестными:
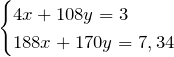
Выразим из первого уравнения х и подставим это значение во второе уравнение, т.е. решим систему методом подстановки.
Значит количество вещества серебра равно 0,01 моль. Тогда, масса серебра в сплаве равна:
m (Ag) = n (Ag) × M (Ag) = 0,01 × 108 = 1,08г.
Не вычисляя xможно найти массу меди в сплаве:
m (Cu) = malloy– m (Ag) = 3 – 1,08 = 1,92 г.
Примеры решения задач. ЗАДАЧА 3.1.1Вычислить массу и диаметр молекулы серебра, считая, что она имеет вид шарика и соприкасается с другими молекулами
ЗАДАЧА 3.1.1Вычислить массу и диаметр молекулы серебра, считая, что она имеет вид шарика и соприкасается с другими молекулами.
Дано: ; ; =107×10 -3 кг/моль;
Определим массу молекулы серебра . Объем молекулы определим как объем шара . Тогда диаметр молекулы серебра равен .
С другой стороны, выразим объём одной молекулы V0 через молярную массу .
Подставим V0 в формулу для диаметра и получим .
ЗАДАЧА 3.1.2Рассчитать среднюю длину свободного пробега молекул азота, коэффициент диффузии и вязкость при давлении 10 5 Па и температуре 17 0 С. Как изменятся найденные величины в результате двукратного увеличения объёма газа: а) при постоянном давлении; б) при постоянной температуре? Эффективный диаметр молекул азота равен 3,7·10 –8 см.
Найти: D — ? -?
Средняя длина свободного пробега может быть рассчитана по формуле , где . Тогда . Для расчёта коэффициента диффузии по формуле воспользуемся полученным результатом, определив предварительно среднюю арифметическую скорость . Тогда
D = 1,0·10 –5 м 2 /с. Коэффициент вязкости рассчитаем по формуле: .
Как видно из формулы, средняя длина свободного пробега зависит только от концентрации молекул. При двукратном увеличении объёма концентрация уменьшается вдвое. Следовательно, при любом процессе . Индексы 1 и 2 соответствуют состояниям до и после расширения газа.
В выражение коэффициента диффузии входит не только длина свободного пробега, но и средняя скорость. Следовательно, .
При постоянном давлении объём прямо пропорционален термодинамической температуре: . Таким образом, . Вязкость зависит только от скорости молекул, следовательно, и от температуры, т.е. . Это значит, что при постоянном давлении . При постоянной температуре коэффициент не изменяется.
ЗАДАЧА 3.1.3Вычислить коэффициенты вязкости и диффузии кислорода, находящегося при давлении 0,2 МПа и при температуре 280 К. Диаметр молекулы принять равным 0,29 нм.
Дано: р = 0,2 МПа = 2∙10 5 Па; m= 32∙10 –3 кг/моль; d = 0,29нм = 2,9∙10 –10 м.
Коэффициенты вязкости и диффузии равны соответственно
где – плотность газа;
– средняя арифметическая скорость молекул; (10)
– длина свободного пробега молекул; (11)
Из соотношения р=nkT имеем , где р – давление,
Подставляя значение в (11), получим
Определим численное значение коэффициента диффузии, подставляя (11) и (12) в (9):
Чтобы найти коэффициент вязкости (1), определим плотность газа , так как (масса 1-ой молекулы, N – число молекул);
Из (1) и (2) следует, что , то есть
3.2 Задачи к теме « Физическая кинетика. Явления переноса»
177. Определить градиент плотности углекислого газа в почве, если через площадь в 1 м 2 ее поверхности за 1 с в атмосферу прошел газ массой 8×10 — 8 кг. Коэффициент диффузии равен 0,04 см 2 /с.
178. Найти среднюю длину свободного пробега молекул азота при 0°С и при давлении 10 — 3 мм рт.ст. Диаметр молекулы равен 0,3 нм.
179.Определить массу газа, продиффундировавшего за время 12 ч через поверхность почвы площадью 10 см 2 , если коэффициент диффузии 0,05 см 2 /с. Плотность газа на глубине 0,5 м равна 1,2×10 — 2 г/см 3 , а у поверхности 1,0×10 — 2 г/см 3 .
180. Найти число столкновений, испытываемых в течение 1 с молекулой гелия при нормальных условиях. Диаметр молекулы гелия считать равным 2·10 -10 м.
181. Найти среднее число столкновений за 1 с и длину свободного пробега молекулы гелия, если газ находится под давлением 2 кПа при температуре 200 К. Эффективный диаметр молекулы 2×10 -10 м.
182. Найти число столкновений в 1 с молекул некоторого газа, если длина свободного пробега при этих условиях равна 5×10 -4 см и средняя квадратичная скорость 500 м/с.
183. Коэффициент диффузии водорода при нормальных условиях 0,91 см 2 /с. Определить коэффициент теплопроводности водорода.
184. Давление двухатомного газа вследствие сжатия увеличивается в 10 раз. Как и во сколько раз изменится длина свободного пробега молекул и коэффициент вязкости газа, если процесс: 1) изотермический;
2) адиабатический? Эффективный диаметр молекул считать
185. Оценить среднюю длину свободного пробега и время между двумя соударениями для протонов космических лучей в Галактике. Среднюю плотность межзвездного газа считать равной 10 4 частиц/см 3 , скорость протонов практически равна скорости света. Радиус протонов приблизительно равен 10 -13 см.
186. Двухатомный газ адиабатически расширяется до объема в два раза большего первоначального. Как и во сколько раз изменятся коэффициенты теплопроводности и диффузии? Эффективный диаметр молекул считать постоянным.
187. Найти зависимость коэффициента теплопроводности от температуры при изохорическом процессе. Изобразить эту зависимость на графике.
188. Найти коэффициент внутреннего трения азота при нормальных условиях, если коэффициент диффузии для него при этих условиях равен D =0,142 см 2 /с.
189. Найти зависимость коэффициента теплопроводности от давления при изотермическом процессе. Построить график.
190. В сосуде объемом 0,5 л находится водород при нормальных условиях. Найти общее число столкновений между молекулами водорода в этом баллоне за 1с.
191. Определить, во сколько раз отличается коэффициент диффузии D1 газообразного водорода от коэффициента диффузии D2 газообразного кислорода, если оба газа находятся при одинаковых условиях.
192. Найти среднюю длину свободного пробега и среднее число столкновений молекул азота при нормальных условиях.
193. Найти зависимость коэффициент теплопроводности λ от температура при изобарическом процессе.
194. Найти число столкновений в 1 с молекул углекислого газа при температуре 100 0 С, если средняя длина свободного пробега при этих условиях равна 8,7∙10 -2 см .
195. Вычислить коэффициенты вязкости и диффузии кислорода, находящегося при давлении 0,2 МПа при температуре 300 К. Диаметр молекулы принять равным 0, 29 нм.
196. При нормальных условиях коэффициент внутреннего трения азота 0,017 мПа∙с. Найти среднюю длину свободного пробега.
197. Найти коэффициент вязкости, теплопроводности, диффузии кислорода при нормальных условиях. Диаметр молекулы кислорода принять равным 0,27 нм.
198. Найти число столкновений, испытываемых в течение 1с молекулой водорода при нормальных условиях. Диаметр молекулы считать равным 0,23 нм.
199. Найти число столкновений, испытываемых в течение 1с молекулой кислорода при нормальных условиях. Диаметр молекулы кислорода считать равным 0,27 нм.
200. Найти коэффициент диффузии и коэффициент внутреннего трения воздуха при нормальных условиях. Диаметр молекулы воздуха принять равным 0,3 нм, массу киломоля — 29 кг/моль.
201. Баллон объемом 5 л содержит водород массой 1г при температуре 17 0 С. Определить среднее число соударений молекулы в секунду. Диаметр молекулы водорода принять равным 0,23 нм.
202. В баллоне, объем которого 2,53 л, содержится водород. Температура газа 127 0 С, давление 1000 мм рт.ст. Найти число молекул в баллоне и число столкновений, которые испытывает каждая молекула за 10 с. Диаметр молекулы водорода 0,23 нм.
203. Найти диаметр молекул газа, если для него при нормальных условиях длина свободного пробега молекул 112 нм. Какой это газ?
204. Определить концентрацию молекул водорода, если коэффициент диффузии водорода равен 1,4 см 2 /с, а коэффициент внутреннего трения 8,5×10 -6 с/м 2 .
205. Найти среднюю длину свободного пробега молекул азота при 0 0 С и при давлении 10 мм ртутного столба. Диаметр молекулы принять равным 0,3 нм.
206. Вычислить среднюю длину свободного пробега и время между двумя столкновениями молекул кислорода при давлении 1,510 -6 мм рт. ст. и температуре 17 0 С. Диаметр молекулы кислорода принять равным 0,27 нм.
207. В баллоне, объем которого 2,53 л, содержится водород. Температура газа 127 0 С, давление 1000 мм рт. ст. Найти число молекул в баллоне и число столкновений, которые испытывает каждая молекула за 10 с. Диаметр молекулы водорода 0,23 нм.
208. Найти диаметр молекул водорода, если для водорода при нормальных условиях длина свободного пробега молекул 112 нм.
Источник: fond-obshee-delo.ru