Все словари русского языка: Толковый словарь, Словарь синонимов, Словарь антонимов, Энциклопедический словарь, Академический словарь, Словарь существительных, Поговорки, Словарь русского арго, Орфографический словарь, Словарь ударений, Трудности произношения и ударения, Формы слов, Синонимы, Тезаурус русской деловой лексики, Морфемно-орфографический словарь, Этимология, Этимологический словарь, Грамматический словарь, Идеография, Пословицы и поговорки, Этимологический словарь русского языка.
Уважаемый пользователь, сайт развивается и существует только на доходы от рекламы — пожалуйста, отключите блокировщик рекламы.
рубидий
Толковый словарь
Химический элемент, мягкий металл серебристо-белого цвета, сходный по своим свойствам с калием и натрием.
Толковый словарь Ушакова
РУБИ́ДИЙ, рубидия, муж. (от лат. rubidus — красноватый). Химический элемент — мягкий металл серебристо-белого цвета, по свойствам сходный с калием и натрием.
Словарь существительных
РУБИ́ДИЙ, -я, м
7 САМЫХ СТРАННЫХ Химических элементов!
Химический элемент, серебристо-белый легкоплавкий металл (один из самых активных щелочных металлов).
В соприкосновении с воздухом рубидий воспламеняется, образуя главным образом различные перекиси.
Энциклопедический словарь
РУБИ́ДИЙ -я; м. [от лат. rubidus — красноватый] Химический элемент (Rb), мягкий металл серебристо-белого цвета, по своим свойствам сходный с калием и натрием.
◁ Руби́диевый, -ая, -ое.
руби́дий (лат. Rubidium), химический элемент I группы периодической системы; относится к щелочным металлам. Название от лат. rubidus — тёмно-красный (открыт по линиям в красной части спектра). Серебристо-белый металл пастообразной консистенции. Плотность 1,532 г/см 3 , tпл 39,32°C, tкип 687°C.
На воздухе мгновенно воспламеняется, с водой реагирует со взрывом. В природе рассеян, сопутствует калию и литию и добывается из их минералов. Применяется ограниченно (катоды для фотоэлементов, добавка в газоразрядные трубки, катализатор в органическом синтезе).
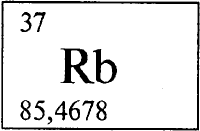
РУБИДИЙ — РУБИ́ДИЙ (лат. rubidium, от лат. rubidus — красный), Rb (читается «рубидий»), химический элемент с атомным номером 37, атомная масса 85,4678. Природный рубидий состоит из смеси стабильного нуклида 85 Rb (72,15% по массе) и слабо — -радиоактивного 87 Rb (период полураспада Т1/2 = 4,8·10 10 лет). Расположен в группе IA (щелочные металлы), в 5-м периоде. Электронная конфигурация внешнего слоя 5s 1 , Степень окисления +1 (валентность I).
Радиус нейтрального атома рубидия 0,248 нм, радиус иона Rb + 0,166 нм (координационное число 6). Энергии последовательной ионизации атома Rb 4,177, 27,5, 40,0, 52,6 и 71 эВ. Сродство к электрону 0,49 эВ. Работа выхода электрона 2,16 эВ. Электроотрицательность по Полингу (см.
ПОЛИНГ Лайнус) 0,8.
История открытия
Немецкие исследователи Р. В. Бунзен (см. БУНЗЕН Роберт Вильгельм) и Г. Р. Кирхгоф выполнили в 1861 спектральные исследования минерала лепидолита (см. ЛЕПИДОЛИТ) и осадка, образующегося после выпаривания минеральных вод из источников Шварцвальда. Спектры содержали темно-красную линию, принадлежащую новому элементу.
Рубидий — металл, который дороже золота.
После выпаривания минеральных вод из полученного остатка с помощью хлорплатината аммония (NH4)2PtCl6 была осаждена смесь хлорплатинатов калия, рубидия и цезия. Затем, хлорплатинаты были переведены в карбонаты и в соли винной кислоты — тартраты. Путем многократной дробной перекристаллизации кислых тартратов Бунзену удалось очистить рубидий от калия и цезия и получить первый препарат соли рубидия. В 1863 Бунзен за счет восстановления кислого тартрата рубидия с помощью сажи приготовил первый образец металлического рубидия.
Нахождение в природе
Содержание рубидия в земной коре 1,5·10 -2 % по массе. Не образует собственных минералов, как правило, сопутствует K или Li. Находится в минеральных источниках, озерной, морской и подземной водах.
Рубидий в основном получают при переработке или лепидолита на соединения Li, или карналлита, служащего сырьем при производстве Mg. Остаток, образующийся после отделения основных количеств Li, K и Mg и содержащий соли K, Rb и Cs, разделяют на фракции методами дробной кристаллизации, сорбции, экстракции и ионного обмена.
Металлический рубидий обычно готовят восстановлением галогенидов Rb кальцием (см. КАЛЬЦИЙ) или магнием. (см. МАГНИЙ)
Физические и химические свойства
Рубидий — мягкий серебристо-белый металл.
При обычной температуре имеет пастообразную консистенцию, температура плавления +39,32°C. Температура кипения рубидия 687,2°C. Кристаллическая решетка металла кубическая объемно центрированная, параметр ячейки а = 0,570 нм. Рубидий — легкий металл, его плотность 1,532 кг/дм 3 .
Реакционная способность рубидия очень высока. Его стандартный электродный потенциал -2,925 В. На воздухе и в атмосфере кислорода металлический рубидий воспламеняется, образуя смесь пероксида рубидия Rb2O2 и надпероксид рубидия RbO2. При незначительном содержании кислорода в газе, с которым реагирует Rb, возможно образование и оксида Rb2O. C водой рубидий реагирует со взрывом:
При нагревании под повышенным давлением Rb реагирует с H с образованием гидрида RbH. Rb непосредственно реагирует с галогенами, S с образованием сульфида Rb2S. С азотом рубидий в обычных условиях не реагирует, а нитрид рубидия Rb3N образуется при пропускании электрического разряда между электродами из рубидия, помещенными в жидкий азот. При нагревании рубидий реагирует с красным фосфором, образуя фосфид рубидия Rb2P5. Также при нагревании рубидий реагирует с графитом, причем в зависимости от условий проведения реакции возникают карбиды составов C8Rb и C24Rb.
Для рубидия характерно взаимодействие с аммиаком с образованием амида RbNH2. При реакции рубидия с ацетиленом возникает ацетиленид Rb2C2. Металлический рубидий способен восстанавливать кремний из стекла и из SiO2.
Со многими металлами рубидий образует интерметаллиды.
Гидроксид рубидия RbOH — сильное хорошо растворимое в воде основание, ведет себя аналогично КОН и NaOH.
Такие соли рубидия, как хлорид RbCl, сульфат Rb2SO4, нитрат RbNO3, карбонат Rb2CO3 хорошо растворимы в воде перхлорат рубидия RbClO4 и хлорплатинат рубидия Rb2PtCl6 плохо растворимы в воде
Металлический рубидий входит в состав смазочных композиций, используемых в реактивной и космической технике. Используется как компонент материала катодов фотоэлементов и фотоэлектрических умножителей. Пары рубидия используются в разрядных трубках, в лампах низкого давления. Некоторые соединения рубидия используют при изготовлении специальных стекол.
Особенности обращения
Хранят в ампулах из стекла пирекс в атмосфере аргона или в стальных герметичных сосудах под слоем обезвоженного вазелинового масла или парафина.
Большой энциклопедический словарь
РУБИДИЙ (лат. Rubidium) — Rb, химический элемент I группы периодической системы Менделеева, атомный номер 37, атомная масса 85,4678. Относится к щелочным металлам. Название от лат. rubidus — темно-красный (открыт по линиям в красной части спектра). Серебристо-белый металл пастообразной консистенции. Плотность 1,5248 г/см относится к щелочным металлам. Открыт немецкими учеными Р. Бунзеном и Г. Кирхгофом в 1861.
Орфографический словарь
Словарь ударений
Формы слов для слова рубидий
руби́дий, руби́дии, руби́дия, руби́диев, руби́дию, руби́диям, руби́дием, руби́диями, руби́диях
Синонимы к слову рубидий
сущ., кол-во синонимов: 2
Источник: sanstv.ru
Физические свойства
Рубидий — это щелочной металл. Белый, мягкий, весьма легкоплавкий. Чрезвычайно реакционноспособный. Сильнейший восстановитель.
Относительная молекулярная масса Mr = 85,468; относительная плотность для твердого состояния d(т) = 1,532; относительная плотность для жидкого состояния d(ж) = 1, 472; tпл = 39,3º C; tкип = 696º C.
Способ получения
1. Рубидий получают в промышленности путем разложения гидрида рубидия при температуре выше 200º С, при этом образуются рубидий и водород :
2RbH = 2Rb + H2
2. В результате электролиза жидкого гидроксида рубидия образуются рубидий, кислород и вода :
4RbOH → 4Rb + O2↑ + 2H2O
3. В результате разложения оксида рубидия при 400 — 550º С получается пероксид рубидия и рубидий:
4. Жидкий хлорид рубидия подвергают электролизу, в результате чего на выходе образуется рубидий и хлор:
2RbCl = 2Rb +Cl2↑
Качественная реакция
Качественная реакция на рубидий — окрашивание пламени солями рубидия в фиолетовый цвет .

Химические свойства
1. Рубидий — сильный восстановитель . Поэтому он реагирует почти со всеми неметаллами :
1.1. Рубидий легко реагирует с водородом при 300–350º C и повышенным давлением с образованием гидрида рубидия:
2Rb + H2 = 2RbH
1.2. Рубидий сгорает в кислороде (воздухе) с образованием надпероксида рубидия:
а если сгоранием происходит в холодной среде, то образуется оксид рубидия:
1.3. Рубидий активно реагирует при комнатной температуре с фтором, хлором, бромом и йодом . При этом образуются фторид рубидия, хлорид рубидия, бромид рубидия, йодид рубидия :
2Rb + F2 = 2RbF
2Rb + Cl2 = 2RbCl
2Rb + Br2 = 2RbBr
2Rb + I2 = 2RbI
1.4. С серой рубидий реагирует при температуре 100–130º C с образованием сульфида рубидия:
2Rb + S = Rb2S
2. Рубидий активно взаимодействует со сложными веществами:
2.1. Рубидий реагирует с водой . Взаимодействие рубидия с водой приводит к образованию гидроксида рубидия и газа водорода:
2Rb 0 + 2 H2 O = 2 Rb + OH + H2 0
2.2. Рубидий взаимодействует с кислотами . При этом образуются соль и водород.
2.2.1. Рубидий реагирует с разбавленной соляной кислотой, при этом образуются хлорид рубидия и водород :
2Rb + 2HCl = 2RbCl + H2 ↑
2.2.2. При взаимодействии с разбавленной и холодной с ерной кислотой образуется сульфат рубидия, оксид серы (IV), осадок сера и вода:
2.2.3. Реагируя с разбавленной и холодной азотной кислотой рубидий образует нитрат рубидия, газ оксид азота (II), газ оксид азота (I), газ азот и воду:
2.2.4. В результате реакции насыщенной сероводородной кислоты и рубидия в бензоле образуется осадок гидросульфид рубидия и газ водород:
2Rb + 2H2S = 2RbHS↓ + H2↑
2.3. Рубидий может взаимодействовать с основаниями:
2.3.1. Рубидий взаимодействует с гидроксидом рубидия при температуре 400º С, при этом образуется оксид рубидия и водород:
2Rb + 2RbOH = 2Rb2O + H2
2.4. Рубидий вступает в реакцию с газом аммиаком при 40-60º С. В результате данной реакции образуется амид рубидия и водород:
2.5. Рубидий может вступать в реакцию с оксидами :
2.5.1. В результате взаимодействия рубидия и оксида кремния при температуре выше 300º С образуется силикат рубидия и кремний:
Источник: chemege.ru
Характеристика рубидия
В соединениях рубидий одновалентен, проявляет степень окисления +1.
Рубидий как вещество
Способы получения рубидия:
- Восстановлением из гидрида рубидия при нагревании:
2RbH → 2Rb + H2
- Электролизом раствора соли рубидия:
2RbCl (ж) → 2Rb + Cl2↑
- В промышленности большую часть добываемого рубидия получают как побочный продукт при производстве лития из лепидолита.
Физические свойства рубидия:
- Мягкий щелочной металл серебристо-белого цвета.
- Кристаллы на свежем срезе имеют металлический блеск.
- Пар окрашен в зеленовато-синий цвет, пламя газовой горелки окрашивает в фиолетовый цвет.
- Хорошо сохраняется лишь под слоем парафинового или вазелинового масла.
- Температура плавления равна 39,3°С, температура кипения равна 696°С.
Химические свойства рубидия:
Чрезвычайно реакционно способен. Сильнейший восстановитель. Крайне неустойчив на воздухе (реагирует с воздухом в присутствии следов воды с воспламенением).
Энергично реагирует с кислородом воздуха, водой (с воспламенением), разбавленными кислотами, неметаллами, аммиаком, сероводородом. С ртутью образует амальгаму.
Не реагирует с азотом.
2Rb + H2 → 2RbH
2Rb + S → Rb2S
Применение рубидия:
Основные области применения: катализ, электронная промышленность, специальная оптика, атомная промышленность, медицина (входит в состав психотропных препаратов). Также широко используется в гамма-дефектоскопии, измерительной технике, при стерилизации лекарств и пищевых продуктов.
В виде хлористых, бромистых и иодистых солей рубидий используется в медицине как болеутоляющее и как средство для лечения эпилепсии.
Применение
2. Лидин, Р. А. Химические свойства неорганических веществ / Р. А. Лидин, В. А. Молочко, Л. Л. Андреева. – М.: Химия, 2000.
3. Таубе, П. Р. От водорода до … / П. Р. Таубе, Е. И. Руденко. – М.: Высшая школа, 1968.
Источник: mend-tab.ru