Моносахариды – бифункциональные соединения, поэтому их химические свойства обусловлены наличием в молекулах как карбонильных (в линейной форме), так и гидроксильных групп.
а) Удлинение и укорачивание цепи моносарида
Несмотря на то, что в смеси таутомерных форм равновесие сдвинуто в сторону образования циклических форм, в растворе моносахарида присутствует некоторое количество ациклической (открытой) формы, что позволяет ему вступать в реакции, характерные для альдегидов и кетонов. Так, при взаимодействии сахаридов с гидроксиламином образуется смесь оксимов циклических и ациклических форм. При действии на них уксусного ангидрида одновременно происходят ацетилирование и дегидратация с образованием нитрила. Обработка полученного нитрила метилатом натрия приводит к дезацетилированию и отщеплению молекулы HCN:
Таким путем углеродная цепь альдозы укорачивается на один атом углерода.
Удлинение углеродной цепи можно осуществить циангидринным методом. Взаимодействие альдозы с цианидом натрия приводит к образованию смеси двух изомерных нитрилов, которые легко гидро−лизуются в альдоновые кислоты. Последние при восстановлении амальгамой натрия дают альдозы:
80. Реактив Толленса
При восстановлении альдегидной или кето−группы моносахаридов образуются многоатомные спирты. Восстановление проводят водородом в присутствии металлического катализатора (Ni, Pd):
Альдозы образуют один полиол, кетозы дают смесь двух стереоизомеров. Так, из D−фруктозы образуются D−сорбит и D−маннит:
В щелочной среде моносахариды окисляются реактивами Толленса, Бенедикта и Фелинга. Окисление в щелочной среде, как правило, приводит к разрушению молекулы моносахарида, поэтому эти реакции используются для качественного обнаружения углеводов.
Реакция Фелинга
Реактив Фелинга — это смесь раствора №1 — сульфата меди и раствора №2 — щелочного раствора сегнетовой соли. Растворы хранятся отдельно друг от друга, а при использовании смешиваются в соотношении 1:1. При добавлении небольшого количества реактива Фелинга раствор глюкозы дает ярко-синее окрашивание.
В данном случае глюкоза растворяет Сu(ОН)2 и ведет себя как многоатомный спирт. При дальнейшем нагревании цвет раствора меняется до желтой окраски, что свидетельствует об образовании CuOH, с последующим переходом в осадок краснокирпичного цвета-образование закиси меди Cu2O. Глюкоза при этом окисляется до глюконовой кислоты. Избыток Сu(ОН)2 при нагревании приводит к образованию окиси меди-осадок черного цвета.
Реакция Бенедикта
Реактив Бенедикта – это смесь сульфата меди, раствора карбоната натрия и цитрата натрия.
Реакция Толленса (реакция серебряного зеркала)
Реактив Толленса – смесь растворов нитрата серебра, щелочи и аммиака. Растворы готовятся непосредственно перед определением углеводов и смешиваются в соотношении 1:1. Раствор аммиачного серебра при взаимодействии с глюкозой дает зеркальный налет металлического серебра.
Окисление в нейтральной или кислой среде позволяет сохранить углеродный скелет. Окисление в мягких условиях, например, бромной водой, позволяет окислить карбонильную группу до карбоксильной, не затрагивая гидроксильные группы. Образующиеся при этом кислоты называют альдоновыми.
Проба Фелинга на фенилпировиноградную кислоту
Использование сильного окислителя, например, разбавленной азотной кислоты, позволяет окислить обе концевые группы — карбонильную и первичную спиртовую до карбоксильных. Образующиеся при этом кислоты называют альдаровыми. Продукт такого окисления D−глюкозы называется D−глюкаровой кислотой:
При окислении D−галактозы азотной кислотой образуется
D−галактаровая или слизевая кислота, которая мало растворима в воде. Это позволяет использовать азотную кислоту для обнаружения D−галактозы.
Окисление моносахаридов в биологических системах носит более сложный характер. Так, при аэробном окислении D−глюкозы, катализируемом ферментом глюкозооксидазой, окислению подвергается не открытая, а циклическая форма. Глюкозооксидаза специфична к b−D−глюкопиранозе, которая вначале окисляется до d−лактона:
В кислой среде d−лактон легко превращается в g−лактон. Взаимные превращения лактонов приводят к мутаротации раствора глюконовой кислоты.
При окислении первичной спиртовой группы без затрагивания альдегидной образуются гликуроновые (уроновые) кислоты. Ввиду более легкой окисляемости альдегидной группы получение уроновых кислот представляет собой довольно сложную задачу. В этой связи окислению подвергают моносахарид с защищенной альдегидной группой, например, в виде гликозида:
Уроновые кислоты имеют большое значение. Они входят в состав различных полисахаридов. Так, глюкуроновая кислота является структурной единицей гепарина, гиалуроновой кислоты и др. Пектиновые вещества плодов и ягод являются полиуронидами.
В организме уроновые кислоты выполняют важную функцию: они связывают посторонние и токсические вещества и в виде глюкуронидов выводят их из организма вместе с мочой:
а) Углеродная цепь любого моносахарида содержит большое число OH−групп, обладающих электроноакцепторными свойствами. По этой причине гидроксильные группы в молекулах моносахаридов обладают большей кислотностью по сравнению со спиртами. В результате моносахариды могут образовывать алкоголяты (сахараты) не только с щелочными и щелочноземельными металлами, но и с их гидроксидами:
б) Образование простых эфиров
Образование простых эфиров в первую очередь происходит по гидроксилу, связанному с С1 (гликозидный, или полуацетальный гидроксил); такие эфиры носят название гликозидов. Гликозиды – широко распространенные природные соединения.
В более жестких условиях в реакцию вступают все гидроксильные группы углевода:
Простые эфиры не гидролизуются в слабокислой и щелочной средах. В то же время ацетали легко гидролизуются при кипячении с кислотой:
В результате кислотного гидролиза образуется полуацеталь, способный к аномеризации, и раствор такого сахарида мутаротирует.
в) Образование сложных эфиров
При действии на глюкозу ангидридов кислот образуются сложные эфиры:
Сложные эфиры моносахаридов легко гидролизуются и в кислой, и в щелочной средах. Это объясняется меньшей прочностью сложноэфирной связи по сравнению с простой эфирной связью.
Среди сложноэфирных производных моносахаридов наибольшее значение имеют фосфаты (сложные эфиры фосфорной кислоты):
3) Кето – енольная таутомерия
В разбавленных щелочных растворах при комнатной температуре моносахариды способны к кето – енольной таутомерии, обусловленной миграцией двойной связи. При переходе от ендиольной формы в кето – форму возможна перегруппировка заместителей у аномерного и соседнего с ним атомов углерода:
Следствием этого процесса является появление в растворе равновесной смеси эпимеров данного моносахарида.
При высоких температурах и высоких концентрациях щелочей моносахариды подвергаются расщеплению и полимеризации с образованием различных продуктов, в том числе молочной и муравьиной кислот.
Реакция Молиша
Реакция Молиша является качественной реакцией на углеводы.
В концентрированных растворах кислот при нагревании моносахариды подвергаются дегидратации. Отщепляя по три молекулы воды, альдопентозы образуют фурфурол, а альдо– и кетогексозы — 5–гидроксиметилфурфурол:
Фурфурол и 5−гидроксиметилфурфурол вступают в характерные реакции с замещенными бензолами с образованием окрашенных продуктов. С двумя молекулами фенола или α-нафтола, резорцина или тимола – образуются соединения фиолетового и красного окрашивания соответственно.
Реакция Селиванова
Обнаружение фруктозы в растворе по методу Селиванова проводят следующим образом. Сначала фруктозу переводят в 5–гидроксиметилфурфурол нагреванием с концентрированной HCl, затем добавляют резорцин (1,3–дигидроксибензол). Образующееся конденсированное соединение в кислой среде отщепляет воду, переходя в структуру с большим числом сопряженных двойных связей. Подобное строение имеют многие индикаторы кислотно–основного типа (фенолфталеин, метилоранж и др.). Присоединяя или отщепляя протон H + , они меняют свою окраску в зависимости от активной реакции среды.
Реакция Селеванова является качественной реакцией на фруктозу, которая при нагревании смеси дает красное окрашивание раствора.
Важным свойством моносахаридов является их ферментативное брожение. Брожению подвергаются в основном гексозы. Молекулы глюкозы способны к расщеплению под действием различных микроорганизмов. Основные виды брожения:
а) спиртовое брожение
Спиртовое брожение протекает под влиянием различных микроорганизмов или фермента зимазы, который содержится, например, в кожуре винограда. В результате спиртового брожения гексоз (для пентоз эта реакция не характерна) образуется этиловый спирт:
б) молочнокислое брожение
Молочнокислое брожение протекает при выработке различных молочнокислых продуктов, при солении огурцов, квашеной капусты и силосовании кормов:
в) маслянокислое брожение
г) лимоннокислое брожение
Лимоннокислое брожение протекает в присутствии особых плесневых грибков. Этот процесс используют для получения лимонной кислоты.
Источник: cyberpedia.su
Реакция фелинга это реакция серебряного зеркала
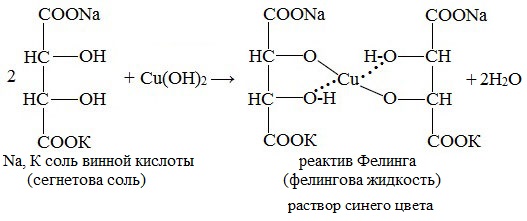
Реактив Фелинга (медно-тартратный реактив, фелингова жидкость) — состоит из равных объемов раствора сложной соли тартрата натрия-калия (сегнетова соль, натрий-калий виннокислый) в 10%-ном р-ре NaOH и раствора сульфата меди.
Приготавливается непосредственно перед анализом путем смешения двух растворов.
Применяется для качественного и количественного определения альдегидов жирного ряда и в особенности моносахаридов. Действие реактива Фелинга основано на восстановлении иона двухвалентной меди до одновалентной за счёт окисления альдегидных групп исследуемых соединений.
При этом на холоде выпадает оранжево-жёлтый осадок гидроксида меди (I) СuОН, а при нагревании – красный осадок оксида меди (I) Сu2O.
Впервые был предложен в 1850 году немецким химиком Г. Фелингом.
Реакция на моносахариды
Глюкоза окисляется свежеосажденным гидроксидом меди (II) в щелочной среде до глюконовой кислоты, восстанавливая ионы Cu +2 до Cu +1 . Углеводы подобного типа называют восстанавливающими.
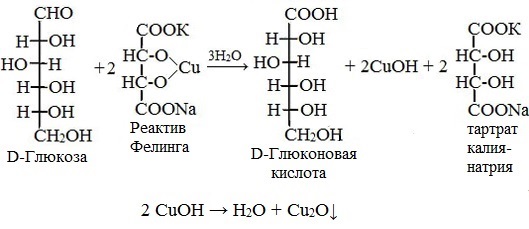
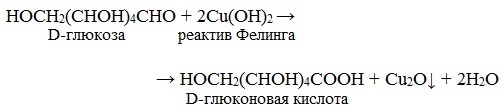
Эта реакция применяется для количественного определения сахаров в пищевых продуктах.
Реакция на альдегиды
Альдегиды жирного ряда восстанавливают двухвалентную медь в одновалентную.
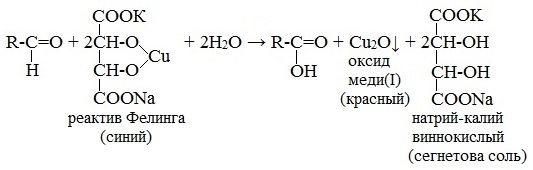
Ароматические альдегиды эту реакцию не дают.
Образование реактива Фелинга
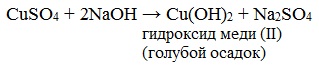
Реактив Фелинга используется как качественная реакция для определения альдегидной группы.

Рубрики: ИМЕННЫЕ РЕАКЦИИ
Источник: himija-online.ru
Окисление альдегидов – формула реакции
Альдегиды относятся к органическим веществам, которые обязательно имеют в своем составе карбонильную группу -COH. Эти вещества обладают различными химическими свойствами, среди которых окисление занимает важное место. Как же происходит окисление альдегидов, и какие реакции при этом происходят?

Общая характеристика альдегидов
Названия альдегидов образуются от соответствующих названий предельных углеводородов с суффиксом -аль, или используются названия соответствующих исторически сложившихся названий карбоновых кислот. Общая формула альдегидов выглядит следующим образом: CnH2nO
В отличие от спиртов и фенолов для альдегидов не характерно образование водородных связей, поэтому у них температура кипения и плавления ниже. К альдегидам относятся такие вещества, как формальдегид, ацетальдегид, акролеин и многие другие. Формальдегид или муравьиный альдегид CH2O является газом с резким запахом.
Это вещество необходимо для получения каучука и множества лекарственных веществ. ацетальдегид CH3COH. Это вещество бесцветно и с помощью него получают уксусную кислоту. Акролеин CH2 =CH-COH – это жидкость, которая легко улетучивается. Этот альдегид используется в основном для производства лекарственных препаратов.
Окисление альдегидов
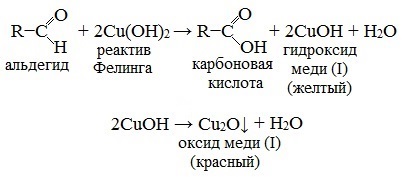
Для альдегидов характерны такие реакции, как присоединение, окисление, образование полимеров. Альдегиды очень легко окисляются, так как при окисленном атоме углерода есть атом водорода. Качественными реакциями на наличие альдегидной группы являются реакции «серебряного зеркала» и реакция восстановления свежеосажденного гидроксида меди (II) до образования красно-оранжевого осадка оксида меди (I):

Рис. 1. Формула окисление альдегидов – реакция серебряного зеркала.
Реакция «серебряного зеркала» – это восстановление гидроксида диамино-серебра или, как часто именуют, оксида серебра. Свое название реакция получила благодаря едва заметному налету, появляющемуся на стенках пробирки в процессе реакции. Температура, при которой происходит реакция, может достигать 80-100 градусов по Цельсию.
Достаточно эффективной является реакция окисления альдегидов гидроксидом меди (II). В процессе реакции двухвалентная медь восстанавливается до одновалентной в составе реактива Фелинга.
Реактив Фелинга – химический реактив, состоящий из раствора соли натрия-калия тартрата и раствора сульфата меди

Рис. 2. Формула окисления альдегидов – реактив Фелинга.
Окисление альдегидов также может происходить под действием реактива Джонса. При этом способе, в отличие от других, повышение температуры не требуется, и реакция проводится при температуре 0-20 градусов. Реагент состоит из оксида хрома (VI), который разбавлен в серной кислоте и ацетоне.

Рис. 3. Формула окисление альдегидов под действием реактива Джонса.
Иногда альдегиды могут окисляться йодом в присутствии щелочи, а также диоксидом селена и перманганатом калия.
Что мы узнали?
Альдегиды – сильные окислители. Эти соединения способны окисляться в результате реакции Фелинга, реакции «серебряного зеркала», а также под действием реактива Джонса, йода и диоксида селена.
Похожие записи:
- Гидролиз сахарозы — уравнение реакции, формула и свойства
- Таблица валентности химических элементов (8 класс, химия)
- Химические свойства уксусной кислоты, ее получение и физические особенности
- Свойства метана – физико-химическая основа молекулы
Источник: kupuk.net